昆仙胶囊联合改善病情抗风湿药治疗类风湿关节炎疗效及安全性的Meta分析研究
王舒桐,徐 楠,滕 亮
(新疆医科大学1药学院,乌鲁木齐 830017,2第一附属医院药学部,乌鲁木齐 830054)
类风湿关节炎(Rheumatoid arthritis,RA)是关节侵蚀性损害为表现的全身性进行性自身免疫病,可导致关节结构的破坏和关节功能的丧失。RA在全球和中国大陆地区的患病率约为1%[1]和0.42%[2]。西药在治疗RA方面根据药理作用分为改善病情抗风湿药(Disease-modifying arthritis drugs,DMARDs)、糖皮质激素、非甾体类抗炎药和生物制剂等,这些药物长期应用具有较强的毒副作用。昆仙胶囊(Kun Xian capsule,KX)为纯中药复方中成药,由昆明山海棠、淫羊藿、枸杞子、菟丝子等四味中药配伍,达到补肾通络,祛风除湿的作用,常用于治疗类风湿关节炎等免疫性疾病,有研究[3]认为其能明显改善类风湿性关节炎患者炎性症状,减缓疼痛,恢复关节的运动功能,与甲氨喋呤片等西药联用治疗效果更佳。另外,昆仙胶囊治疗RA的其他系统评价[4-5]也证明了其治疗效果,但其对比药物局限于甲氨蝶呤,甲氨蝶呤可直接抑制免疫炎症反应和滑膜细胞增生,长期服用会出现肝肾损伤等严重不良反应[6]。本研究对昆仙胶囊联合DMARDs治疗RA的随机对照试验(Randomized controlled trials, RCTs)进行系统评价,分析其临床疗效和安全性,为临床合理用药提供依据。
1 资料与方法
1.1检索策略计算机检索中国知网、VIP、万方、CBM、PubMed、Web of Science、EMbase、和Cochrane数据库(检索时限:建库-2021年8月),收集有关昆仙胶囊治疗RA的RCTs。英文检索词:kun xian,kun xian capsule,rheumatoid arthritis,rheumatism arthritis,rheumatoid,reumatoid,rheumatic,reumatic,中文检索词:昆仙胶囊、类风湿关节炎、类风关、类风湿病、类风湿性关节炎,并追踪纳入文献的参考文献。
1.2纳入标准(1)研究类型为临床RCTs;(2)研究对象为美国风湿病协会于1987年制定的RA诊断标准[7]或国家中医药管理局发布《中药新药临床研究指导原则》中医“痹证”诊断标准[8]确诊的RA患者。(3)干预措施:治疗组给予昆仙胶囊联合DMARDs(甲氨蝶呤、硫酸羟氯喹或来氟米特)治疗,对照组给与单用DMARDs治疗。疗程不少于12周。(4)结局指标:总有效率,临床指标为肿胀关节数、压痛关节数、疼痛视觉模拟评分(VAS)、晨僵时间,实验室指标为血沉(ESR)、类风湿因子(RF)、C反应蛋白(CRP)、抗环瓜氨酸多肽抗体(An-CCPA),安全性指标为肝功能异常、消化道不适、血常规异常、感染、月经紊乱等不良反应的发生率。
1.3排除标准(1)无法获取全文的研究;(2)RA诊断标准不清的研究;(3)重复发表的研究采用最新最全的数据;(4)无详细数据的研究。
1.4文献筛选及资料提取文献筛选、资料提取由2位研究者独立地完成并进行交叉数据核对等工作,争议部分进行讨论,如有必要与第三名研究者商讨后达成一致。按照检索式在中英文数据库中检索文献,通过EndNote软件进行文献管理,在阅读文献题目和摘要并排除无关文献后,下载文献全文阅读以确定最终纳入文献。提取资料至Excel表:(1)基本信息;(2)研究对象的基线特征;(3)偏倚风险评价要素;(4)干预措施的操作细节;(5)结局指标结果。偏倚风险评价根据Cochrane手册中的工具进行。
1.5统计学处理采用RevMan5.4软件进行Meta分析(检验水准α=0.05),分类变量的效应指标采用相对危险度(RR)及其95%的可信区间(CI)表示;连续性变量的效应指标采用标准化均数差(SMD)及其95%CI表示。异质性(I2)检验:当I2≤50%且P≥0.10时,采用固定效应模型;当I2>50%或P<0.10时,认为具有异质性,需进行异质性来源分析并采用随机效应模型。
2 结果
2.1文献筛选流程及结果检索到的178篇文献经筛选后纳入8个RCTs[9-16],包括患者704例,文献筛选流程及结果见图1。
2.2纳入研究文献的基本特征及质量评价纳入文献的基本特征见表1,治疗组352例,对照组352例;偏倚风险评价结果见表2,其中有1个研究[12]采用中心分层的区组随机法,1个研究[9]采用随机抽签法,2个研究[12,15]采用分配隐藏。偏倚风险图见图2。
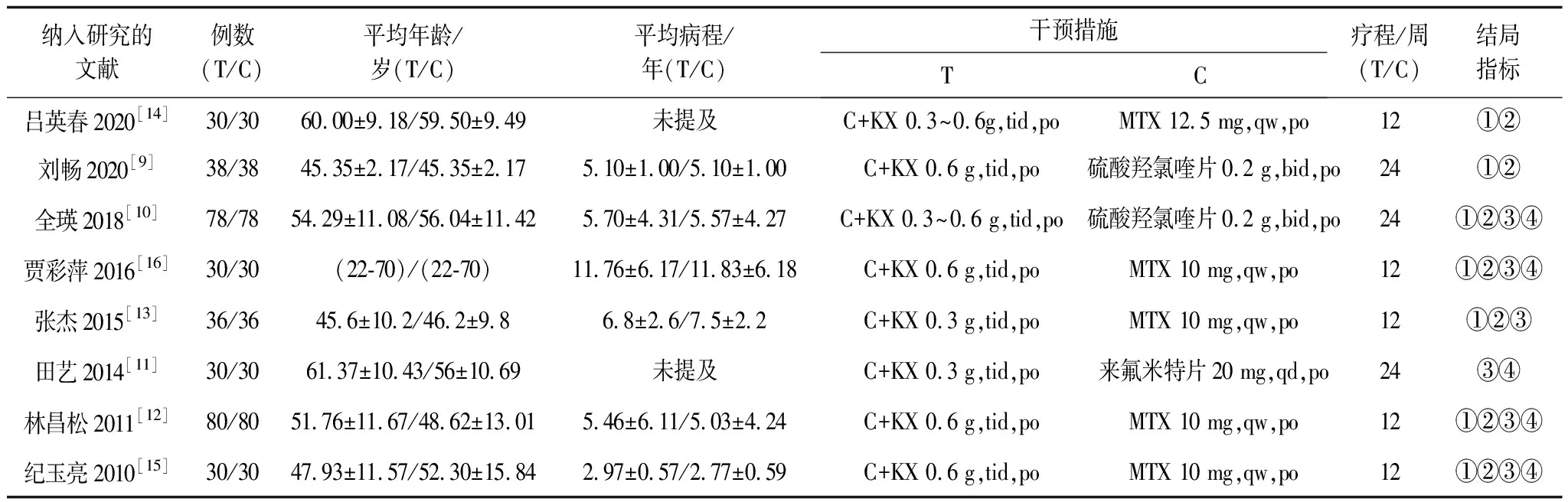
表1 纳入研究文献的基本特征
2.3Meta分析结果
2.3.1 总有效率 共7个研究[9,10,12-16]报道总有效率,包括642例患者。异质性检验结果(I2=0%,P>0.1)显示组间异质性较低,采用固定效应模型。Meta分析结果显示,治疗组总有效率高于对照组[RR=1.20,95%CI(1.12,1.28),P<0.05]。亚组分析依据为治疗组和对照组的干预措施。Meta分析结果显示,昆仙胶囊联合甲氨蝶呤组总有效率高于甲氨蝶呤组[RR=1.20,95%CI(1.11,1.31),P<0.05];昆仙胶囊联合硫酸羟氯喹组与硫酸羟氯喹组相比总有效率更高[RR=1.18,95%CI(1.07,1.31),P<0.05],见图3。1个研究[11]报道了昆仙胶囊联合来氟米特第12周、第24周疾病活动改善程度优于来氟米特单药治疗(P<0.05)。
2.3.2临床指标
2.3.2 .1 压痛关节数 共3个研究[12,15-16]报道压痛关节数,包括278例患者。异质性检验结果显示(I2=0%,P>0.1),采用固定效应模型。Meta分析结果显示,治疗组压痛关节数少于对照组[SMD=-0.81,95%CI(-1.06,-0.57),P<0.05],见图4。
2.3.2.2 肿胀关节数 共3个研究[12,15-16]报道肿胀关节数,包括278例患者。异质性检验结果显示(I2=0%,P>0.1),采用固定效应模型。Meta分析结果显示,治疗组肿胀关节数少于对照组[SMD=-0.67,95%CI(-0.91,-0.42),P<0.05],见图5。
2.3.2.3 晨僵时间 共5个研究[9,12-13,15-16]报道晨僵时间,包括350例患者。异质性检验结果显示(I2=0%,P>0.1)。固定效应模型分析结果显示,治疗组的晨僵时间少于对照组[SMD=-0.56,95%CI(-0.77,-0.35),P<0.05],见图6。
2.3.2.4 疼痛视觉模拟评分(VAS) 共4个研究[9-10,12,16]报道VAS评分,包括450例患者。异质性检验结果显示高度异质性(I2=96%,P<0.05)。敏感性分析剔除任何一项研究未能减少研究间异质性,采用随机效应模型分析。Meta分析结果显示,治疗组VAS评分低于对照组[SMD=-1.53,95%CI(-2.57,-0.48),P<0.05],见图7。
2.3.3实验室指标
2.3.3 .1 血沉(ESR) 共6个研究[10-13,15-16]报道ESR,包括566例患者。异质性检验结果显示(I2=0%,P>0.1),采用固定效应模型。Meta分析结果显示,治疗组ESR低于对照组[SMD=-0.55,95%CI(-0.71,-0.38),P<0.05],见图8。
2.3.3.2 C反应蛋白(CRP) 共6个研究[10-13,15-16]报道CRP,包括566例患者。异质性检验结果显示高度异质性(I2=86%,P<0.05)。敏感性分析剔除任何一项研究未能减少研究间异质性,采用随机效应模型分析。Meta分析结果显示,治疗组CRP低于对照组[SMD=-0.80,95%CI(-1.27,-0.32),P<0.05],见图9。
2.3.3.3 类风湿因子(RF) 共6个研究[10-13,15,16]报道RF,包括566例患者。异质性检验结果显示(I2=28%,P>0.1),采用固定效应模型。Meta分析结果显示,治疗组RF低于对照组[SMD=-0.44,95%CI(-0.60,-0.27),P<0.05],见图10。
2.3.3.4 抗环瓜氨酸多肽抗体(An-CCPA) 共3个研究[10,12,16]报道An-CCPA,包括374例患者。异质性检验结果显示高度异质性(I2=88%,P<0.05),敏感性分析剔除任何一项研究未能减少研究间异质性,采用随机效应模型。Meta分析结果显示,治疗组An-CCPA低于对照组[SMD=-0.73,95%CI(-1.37,-0.10),P<0.05],见图11。
2.3.4不良反应 共6个研究[10-12,14-16]报道不良反应,包括肝功能异常、消化道不适、血常规异常、感染、月经紊乱、骨髓抑制、肺间质病变。异质性检验结果显示组间异质性较低(I2=0%,P>0.1),治疗组不良反应例数与对照组比较差异无统计学意义[RR=0.66,95%CI(0.47,0.92),P>0.1],采用固定效应模型。亚组分析依据为治疗组和对照组的不良反应类型,结果显示两组消化道不适例数差异无统计学意义[RR=0.81,95%CI(0.47,1.39),P>0.1],治疗组肝功能异常例数差异无统计学意义[RR=0.56,95%CI(0.30,1.04),P=0.07],治疗组和对照组血常规异常例数差异无统计学意义[RR=0.56,95%CI(0.24,1.30),P>0.1],治疗组和对照组感染例数差异无统计学意义[RR=0.50,95%CI(0.16,1.61),P>0.1],治疗组和对照组月经紊乱例数差异无统计学意义[RR=0.85,95%CI(0.29,2.50),P>0.1],见图12。一个研究[14]报道了骨髓抑制和肺间质病变的不良反应,治疗组和对照组各30例研究对象,其中治疗组有1例而对照组有3例发生了骨髓抑制,治疗组没有而对照组有1例发生了肺间质病变。
3 讨论
RA是一种慢性、全身性、自身免疫病,常表现为对称性多关节病变,随着病情发展,多伴有关节损伤、功能丧失等症状,有些患者合并多组织和器官受损,严重影响生命质量。在发病机制不清楚的现状下,控制炎症、延缓组织和器官的功能损伤,从而控制疾病至最低活动状态至关重要。依据中医辨证论治,RA在内因肝肾亏虚的基础上,遭受风寒湿等外邪致病,大多表现为关节肿胀和活动受限,属于“痹症”。
昆仙胶囊作为治疗RA的雷公藤类中成药代表药,随着药理研究的深入,有效成分雷公藤甲素能诱导活化的CD4+、CD8+T细胞凋亡,减少细胞因子的表达和分泌,从而具有抑制免疫、拮抗细胞因子及镇痛作用[17],作用机制与非甾体类抗炎药类似,但消化道溃疡、出血等副作用较小。昆仙胶囊动物药效学试验表明,其可通过抑制大鼠滑膜及血清中IL-8的基因表达,从而抑制大鼠滑膜炎、控制RA炎症活动,且治疗效果随剂量增加而增加[18]。
本研究分析结果显示,昆仙胶囊联合甲氨蝶呤、硫酸羟氯喹或来氟米特治疗RA疗效优于DMARDs单药治疗,治疗组减少了肿胀关节数、压痛关节数、晨僵时间,降低了VAS评分,降低血沉、类风湿因子、C反应蛋白、抗环瓜氨酸多肽抗体等实验室指标,其中VAS评分异质性高可能与评价主体的差异性或主观性有关。在安全性上,纳入的研究在不良反应方面报道了肝功能异常、消化道不适、血常规异常、感染、月经紊乱、骨髓抑制、肺间质病变等,两组在以上不良反应方面差异无统计学意义。由于纳入的大部分研究质量不高,本研究存在局限性,结果可作为昆仙胶囊治疗RA有效性和安全性的参考:(1)由于数据库或者检索方法限制,纳入研究可能存在遗漏;(2)纳入研究存在随机方法、盲法处理、病历缺失或退出未清楚阐明,存在一定的偏倚风险;(3)纳入研究的样本量均较小;(4)纳入研究的疗程局限于24周,由于RA病情的延续性,缺乏长期随访数据,难以判断药物的远期疗效。昆仙胶囊的君药昆明山海棠为雷公藤类药物,雷公藤类药物的有效剂量与中毒剂量相近[19],毒性机制代谢组学研究显示[20]其具有肝毒性、肾毒性、生殖毒性和心脏毒性,昆仙胶囊中昆明山海棠与淫羊藿、枸杞子、菟丝子组方毒性是否有所改善,对于不同年龄、疾病严重程度和合并症的效果目前还不清楚,且RA的治疗常常需要联合多种药物,联合用药是否需要改变药物使用剂量、频次和疗程等仍不清楚,此可作为未来研究的方向进一步探索。
综上所述,昆仙胶囊联合DMARDs能够提高治疗RA的疗效,具有良好的应用前景。

