大鼠急性阻塞性睡眠呼吸暂停模型下的左侧肾神经活性变化*
王思嘉 杨杭 马嵋 何修远 木扎拜尔·卡日 薄雅坤 马会杰 张玲
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种最常见的睡眠呼吸障碍,美国大约25% 的成年人患有OSA[1],在50 ~70 岁的女性中发病率为9% ,在男性中为17%[2]。中国的流行病学显示,大约有13% 的中年男性和6% 的中年女性患有中度到重度OSA[3]。已有的研究显示OSA 可导致心血管疾病的发病率增加及影响患者的预后[4]。以往的研究发现交感神经的激活在OSA 患者相关心血管疾病发生发展过程中起着重要作用[5]。以往的交感神经活性主要是通过心率变异性及皮肤交感活性记录的[6],肾神经放电记录是最直接反映交感神经活性的方法,已有的研究尚缺乏通过肾神经直接记录反映OSA 大鼠交感神经活性的证据。笔者旨在提供一种稳定的可重复性高的肾神经记录方法学,并记录急性OSA 情况下监测肾交感神经活性(RSNA)的变化,为探讨交感神经变化提供实验证据。
1 材料与方法
1.1 实验动物的选择 成年SPF 级Sprague-Dawley(SD)大鼠10 只,雄性,体重(250±23)g,购自新疆医科大学动物实验中心,动物饲养在新疆医科大学动物饲养基地,实验于新疆医科大学第一附属医院临床医学研究院进行,动物可自由饮水、进食,环境室温20~23℃,空气湿度40% ~60%,采用大鼠普通颗粒饲料和普通饮用水喂养,控制明暗光照各12 h/d。
1.2 实验试剂 戊巴比妥钠(北京索莱宝科技有限公司,生产批号CAS:57-33-0),异氟烷(深圳市瑞沃德生命科技有限公司,生产批号21082101),肝素钠注射液(上海上药第一生化药业有限公司,生产批号2104102),轻质液状石蜡(南昌白云药业有限公司,生产批号20131106)。
1.3 实验仪器 数码显微镜(深圳市瑞沃德生命科技有限公司),小动物麻醉机-基础型(深圳市瑞沃德生命科技有限公司),Powerlab 16/35 电生理记录仪(AD Instruments,Australia),气管插管(江苏华夏医疗器械有限公司)。
1.4 实验准备 宠物剃毛器、玻璃分针、一次性使用静脉留置针、精细镊(两个)、弹簧剪、注射器(1 ml、5 ml)、自制拉钩(两个)、棉球、血管夹,无菌手术器械包:组织剪,线剪,眼科剪,止血钳,持针器,手术刀柄,一次性手术刀片,Allis′s钳,弯盘。气管插管、碘伏、纱布、口罩、帽子等。
1.5 实验过程 SD 大鼠用3% 戊巴比妥钠腹腔麻醉,经口气管插管后连接小动物麻醉机,经颈总动脉穿刺置管后连接压力换能器,监测动脉血压,连接肢导心电图监测心电图。经腹膜后路找到左侧肾神经,记录闭气前20 s、闭气期间、闭气后20 s的RSNA 变化,记录RSNA 的过程重复3次以上(图1)。

图1 记录大鼠左侧肾神经放电的步骤
1.6 气管插管及颈总动脉穿刺置管 诱导麻醉使用2%戊巴比妥钠,麻醉方式采用腹腔注射,用量为45 mg/kg。大鼠仰卧位固定,用胶带绑住四肢,针头固定胶布,在颈部剃毛。将大鼠的头垫高,使头与桌面呈45°,用血管钳将舌头向外向上提起,用棉签清理口腔分泌物,在光源下,见声门后置管,置管深度为从门齿至喉部的距离。连接小动物麻醉机,予持续低流量氧气吸入(1~2 L/min)。开气麻,1.5%异氟烷,切皮,用镊子提起皮肤,用组织剪在颈部正中剪纵切口,再用血管钳钝性分离皮下组织和胸骨舌骨肌,暴露出气管,在气管的后外侧找到颈总动脉和神经。用玻璃分针和镊子分离颈总动脉和神经,分离出颈总动脉后穿双股线,结扎远心端,近心端系松结,再用血管夹夹住近心端。在一次性使用静脉留置针里注入含肝素的生理盐水,穿刺置管,将松结系紧,连接动脉压力换能器,连接血压放大器(Bridge Amp,AD Instruments,Australia)记录血流动力学变化,监测血压。同时连接肢导心电图,连接生物电放大器(Bio Amp,AD Instruments,Australia)记录心电图。每个动物每小时腹腔注射戊巴比妥钠17 mg/kg维持麻醉及1% 异氟烷维持麻醉。
1.7 记录RSNA 的方法 用小夹子将颈部皮肤夹闭,将大鼠的双上肢一起绑,双下肢一起绑,改成右侧卧位,用针头固定,大鼠背部剃毛,范围为:下至髂前上棘,上至肋缘上1~2 cm,后至后正中线,用湿纱布将毛沾走,保持操作台洁净。
在脊柱左侧1 cm 左右,以肋缘的最低点为中点,用组织剪剪开4 ~5 cm ,用血管钳钝性分离皮下筋膜,直至可见浅层白色的腰最长肌。
在腰最长肌外侧用血管钳或小组织剪钝性分离肌肉,往腹部分离,直至可见左侧肾脏。
先找到肾门,可见粉红色的肾动脉和暗红色的肾静脉被脂肪组织包裹,沿着肾动脉往正中可见腹主动脉,由于腹主动脉位于肌肉深层,且腹主动脉与其背部的肌肉粘连紧密,此时可在肌肉与腹主动脉相连接处滴加1 ~2 滴液体石蜡油,再用玻璃分针钝性分离腹主动脉与肌肉,可见腹主动脉和肾动静脉构成“T”形(图2),腹主动脉和肾动脉呈粉红色,肾静脉呈暗红色,用两个自制铁片弯钩固定周围的组织,让“T”形区更好地暴露。
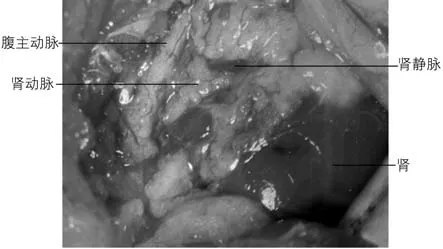
图2 腹主动脉及肾动静脉构成T 形
大鼠的肾神经沿腹主动脉走行,并在“T 型”区域发出分支,一支沿腹主动脉走行,另一只沿肾动脉附近走行。顺着其解剖位置,先找到左侧神经,用镊子和玻璃分针在显微镜下分离神经,注意不要弄破神经周围的血管,用Powerlab 双极银电极勾住神经,再滴加液体石蜡,防止神经干燥,保护神经。连接神经放大器(Neuro Amp EX,AD Instruments,Australia)进行监测。当双极银电极勾上肾神经后,夹闭气管导管,若记录的神经放电立即随闭气出现变化,则说明监测的确定为肾神经,若无变化,则有可能是白色的筋膜。当确定为肾神经时,多次闭气验证其重复性。实验结束后,给大鼠注射过量戊巴比妥钠实行安乐死。
实验过程中记录到的肾交感神经信号经神经放大器放大,在LabChart软件(AD Instruments,Australia)中以50 Hz为中心频率的陷波滤波,使用以100 ms的时间常数对原始RSNA信号进行积分。
1.8 统计学处理 计量资料以均数± 标准差表示,在实验中仅有一组大鼠,但数据有闭气前20 s、闭气20 s和闭气后20 s三组,分别选取其中两组进行两两比较,采用配对t检验,用SPSS 22.0 统计软件进行统计分析,以P<0.05 为差异具有显著性。
2 结果
2.1 RSNA 的 变 化 用Powerlab 电 生 理 记 录 仪直接记录大鼠的原始RSNA、积分RSNA、心率、血压、RR 间期。发现,在闭气期间RSNA 的表现主要有两种,一种以电压增加为主(图3),另一种以频率增加为主(图4)。与闭气前20 s相比,在闭气期间,RSNA 的电压明显增高(P<0.01),而与闭气期间相比,闭气后20 s的RSNA 的电压明显下降(P<0.01),闭气期间血压降低,心率减慢,见表1。以RSNA 频率增快为主的记录中(图4),与闭气前20 s相比,在闭气期间,RSNA 的频率增加(P<0.05),闭气期间血压降低,心率减慢,见表1。以信噪比(信号:噪声)大于3∶1来计算肾神经放电,如图5所示。

图3 Powerlab 电生理记录仪记录到的RSNA、血压和RR 间期的变化

图4 另一种模式的神经放电

图5 肾神经放电示意图
2.2 心率和血压的变化 与闭气前20 s相比,闭气20 s期间,RR 间期增加(P=0.04),如表1,与闭气前20 s相比,闭气20 s期间,血压明显下降(P<0.01),如表1。

表1 神经放电的频率、振幅、血压和心率在闭气前20 s、闭气时和闭气后20 s的变化
3 讨论
目前反映交感神经活动的方法如:常规静息心率和心输出量;ELISA 法检测心肌组织中去甲肾上腺素和肾上腺素浓度;高效液相色谱法检测血清中去甲肾上腺素浓度,上述方法是评价交感神经活性的间接指标。
在生理状态,肾脏由肾传入交感神经和传出交感神经共同支配,并通过感觉传入神经与中枢神经系统联系[7]。高位中枢对延髓头端腹外侧区发出神经冲动,调控交感神经的活动[7]。延髓头端腹外侧区通过其下行纤维直达脊髓中间外侧柱的交感神经节,组成肾传出神经[8]。肾内感受器可以感受肾内的一些变化,经过传入神经到达脊髓后脚,再到达相应中枢[9],RSNA 能直接反映交感神经的活性。
虽然RSNA 在反映交感活性方面有意义,但国内外关于RSNA 记录的相关动物研究中,对记录方法的描述不详细,难以根据描述直接记录肾神经放电。笔者结合文献描述的方法,经过反复摸索和改进,建立了稳定性高、重复性好的方法,稳定的RSNA 再结合血压的记录,可以反映交感神经的活动状况。成功记录RSNA 的关键环节有:①大鼠的肾神经沿腹主动脉走行,并在“T 型”区域发出分支,分支沿肾动脉附近走行,被包裹在脂肪组织中,仅在肾动脉上寻找神经的难度较大,即使在显微镜下,也难以与筋膜区分。寻找肾神经时,需首先暴露“T 型”区域,并将腹主动脉前的肌肉分离干净,从腹主动脉前,顺着肾神经的解剖位置寻找,这样更容易找到肾神经。②在寻找肾神经时,保持视野干净非常重要,虽然大鼠的凝血快,但若有毛细血管渗血,找肾神经则有较大的难度,可用0.9% 的生理盐水冲洗至视野干净。③在寻找肾神经时,用血管钳钝性分离肌肉,可减少出血,保持视野干净,更有助于实验的顺畅进行。④监测神经放电时,需要特别关注大鼠的麻醉深度。若麻醉过深,神经放电会受抑制,甚至无法监测到神经放电;若麻醉深度太浅,刺激大鼠时,大鼠会出现抵抗和躁动,则会导致神经放电监测失败。⑤在监测神经放电时,需要注意不要让周围组织碰到电极,必要时可以剪一小片塑料将电极与周围组织隔离开,否则将影响神经放电的监测结果。
本实验发现:闭气期间RSNA 升高,同时血压下降,结果与Lataro等[10]研究一致,在他们大鼠心力衰竭模型的研究中,RSNA 升高时血压下降。在杨胜昌等[11]的研究中,给对照组大鼠注射硝普钠会导致RSNA 升高,血压下降。注射苯肾上腺素会导致RSNA 下降,血压升高。在Huang等[12]的研究中,无论是正常饮食组大鼠还是高脂饮食组大鼠,在注射苯肾上腺素后,RSNA 下降,平均动脉压升高,心率减慢,在注射硝普钠后,RSNA 升高,平均动脉压下降,心率增快。Fink等[13]在大鼠的脑桥被盖注射DL-同型半胱氨酸,出现RSNA 和血压均升高的现象。
本文所述肾神经记录方法学,借鉴了河北医科大学Li等[14]的方法,但不同之处在于液体石蜡油的滴加次数及顺序,Li等的方法是在找到肾神经之后滴加液体石蜡油,笔者在寻找腹主动脉时,第一次使用石蜡油,目的是为了将腹主动脉与其背部的肌肉分离,由于腹主动脉与其背部的肌肉粘连紧密,用镊子去除肌肉时,容易扎破腹主动脉造成大出血,笔者在腹主动脉周围滴加少量液体石蜡油,再用玻璃分针分离腹主动脉及其背部的肌肉,这样能提高速度,且不会出血,更有利于新手实验操作。第二个优点在于,本方法的重复性好。第三点,RSNA 可以直接监测交感神经活性,比监测去甲肾上腺素浓度更加直观、快速,实验当时即可观察RSNA 变化。
本方法也存在一定的局限性,即根据解剖位置定位无法确定是真的肾神经,需要通过干预后神经放电变化来确定,若给予闭气后,同步记录的Labchart图像中RSNA 无变化,则说明并非肾神经,此时需要重新在“T”形区域附近的脂肪组织中重新寻找,神经操作要求动作轻柔和足够的耐心,反复练习一定能找到肾神经并记录RSNA。

