绥芬河河蟹种质遗传多样性参数优化
王世会,罗亮,张瑞,郭坤,徐伟,张旭彬,赵志刚
(1.中国水产科学研究院黑龙江水产研究所黑龙江省冷水性鱼类种质资源及增养殖重点开放实验室,黑龙江 哈尔滨 150070;2.中国水产科学研究院盐碱水域渔业工程技术研究中心(哈尔滨),黑龙江 哈尔滨 150070;3.黑龙江省水产技术推广总站,黑龙江 哈尔滨 150010)
河蟹即绒螯蟹(Eriocheir)是我国重要的水产经济蟹类之一[1]。根据现有文献报道,河蟹包括中华绒螯蟹(Eriocheir sinensis)、合浦绒螯蟹(Eriocheir hepuensis)和日本绒螯蟹(Eriocheir japonicus)三个有效种[2-4]。河蟹在我国分布范围较广,北到黑龙江省绥芬河流域,南至广西壮族自治区南流江流域均有野生河蟹的自然分布。从20 世纪末到21 世纪初,随着我国养殖河蟹产量逐年增长,对河蟹良种的需求量也逐年增加。截至2021 年4 月,我国共培育了“光合1 号”[5]、“长江1 号”[5]、“长江2 号”[6]、“江海21”[7]和“诺亚1 号”[8]五个国家级河蟹新品种。虽然河蟹良种数量逐渐增多,但良种覆盖率并不高。除了要加大现有河蟹良种的推广力度外,开发新的河蟹种质也是重要的途径之一。
随着种质资源调查及相关科研工作开展,越来越多的河蟹种质得到证实[9-13],其中绥芬河河蟹个体大而广受关注[14]。2003 年黑龙江省水产技术推广总站率先开展了“绥芬河河蟹人工繁育及养殖技术研究”的科技攻关,培育出大眼幼体80 kg,约1 400万只[14]。2020 年9 月调研表明,黑龙江省绥芬河天然水域河蟹雌体成蟹平均规格为(103.73±2.26)g,其中≥100 g 个体占比为46.39%;雄体成蟹平均规格为(148.63±7.27)g,其中≥150 g 个体占比为46.16%。这些数据说明,绥芬河河蟹规格差异较大,且大规格河蟹比例较高。同年秋季调研黑龙江省稻田养殖辽河水系河蟹的生长情况,发现雌体成蟹平均规格仅为60 g 左右,雄体成蟹平均规格仅为103 g 左右。虽然池塘养殖模式河蟹规格有所提高,但与黑龙江省土著绥芬河河蟹种质相比而言,其平均规格差异仍然较大。因此,系统评价绥芬河河蟹种质资源,分析其群体遗传多样性,对我省土著河蟹的种质开发利用及产业发展具有非常重要的现实意义。
目前开发利用的河蟹微卫星分子标记,均以中华绒螯蟹为对象。而绥芬河河蟹种质的分类地位目前存在一定争议。绥芬河在中国境内流经东宁市后,随后进入俄罗斯境内,在流经185 km 后注入阿穆尔湾,进入日本海。因为河蟹具有洄游生殖习性,需要海水完成交配繁殖过程,所以绥芬河河蟹被普遍认为是从日本海溯游到中国境内的符拉迪沃斯托克河蟹,即日本绒螯蟹[13]。赵乃刚等[15]研究发现:俄罗斯符拉迪沃斯托克的河蟹表型处于中华绒螯蟹和日本绒螯蟹之间,但更接近于日本绒螯蟹。王武等[16]证实,绥芬河河蟹能够与辽河水系中华绒螯蟹杂交,杂后代可以完成繁育,说明两者之间不存在生殖隔离。随后XU 等[4,17]证实绥芬河河蟹为中华绒螯蟹与日本绒螯蟹的分布混杂区,但姜晓东[13]通过地标点法表明,绥芬河河蟹应属于中华绒螯蟹,而非日本绒螯蟹。虽然绥芬河河蟹的分类地位有待商榷,但种质遗传多样性分析的前提是要先确定河蟹样本数量、多态性位点数量以及性比等关键参数。本研究通过探究影响绥芬河河蟹种质遗传多样性的关键参数,以期为绥芬河河蟹遗传多样性分析及种质开发利用提供基础数据支撑。。
1 材料与方法
1.1 样品来源
2020 年9 月,在黑龙江省东宁市绥芬河流域(131.18°E,44.07°N)采用地笼捕捉野生河蟹60 只(♀∶♂=1∶1),体质量在100~150 g 之间,冷链活体运输至黑龙江水产研究所,取其附肢肌肉保存于-80℃冰箱中。
1.2 DNA 提取
采用天根生化科技(北京)有限公司生产的磁珠法动物组织基因组DNA 提取试剂盒(DP341-2,)提取绥芬河河蟹肌肉组织的DNA,随后1.5%琼脂糖电泳检测DNA 的完整性。DNA 样品稀释至50 ng/μL,-20℃贮存备用。
1.3 引物筛选及PCR 扩增
从已报道[18-22]的河蟹微卫星引物中筛选出20对多态性较高的引物应用于本实验。引物位点特征信息如表1 所示。所有正向引物(5' 端)采用FAM或HEX 荧光标记,所有反向引物采用生工生物工程(上海)股份有限公司生产的常规引物。PCR 反应体系为20 μL,包括1 μL DNA 模板稀释液、0.5 μL正向引物、0.5 μL 反向引物、2×Es Taq Master Mix(Dye)(CW0690,康为世纪生物科技有限公司生产)和8 μL ddH2O。PCR 反应程序为:94℃预变性2 min,随后共进行35 个循环,包括94℃变性30 s,根据每个引物适宜的温度退火30 s,72℃延伸30 s,最后72℃延伸10 min。取少量PCR 产物3%琼脂糖凝胶电泳检测,确认目的条带后,其余PCR 产物置于-20℃贮存备用。将2 个不同荧光标记(1 个FAM标记和1 个HEX 标记)的PCR 产物合并。将混合后的产物送至生工生物工程(上海)股份有限公司毛细管电泳检测,根据分子标记重复序列数和扩增片段碱基数范围,修正目的片段长度,将目的条带数值导入Microsoft Excel 中分析备用[10]。
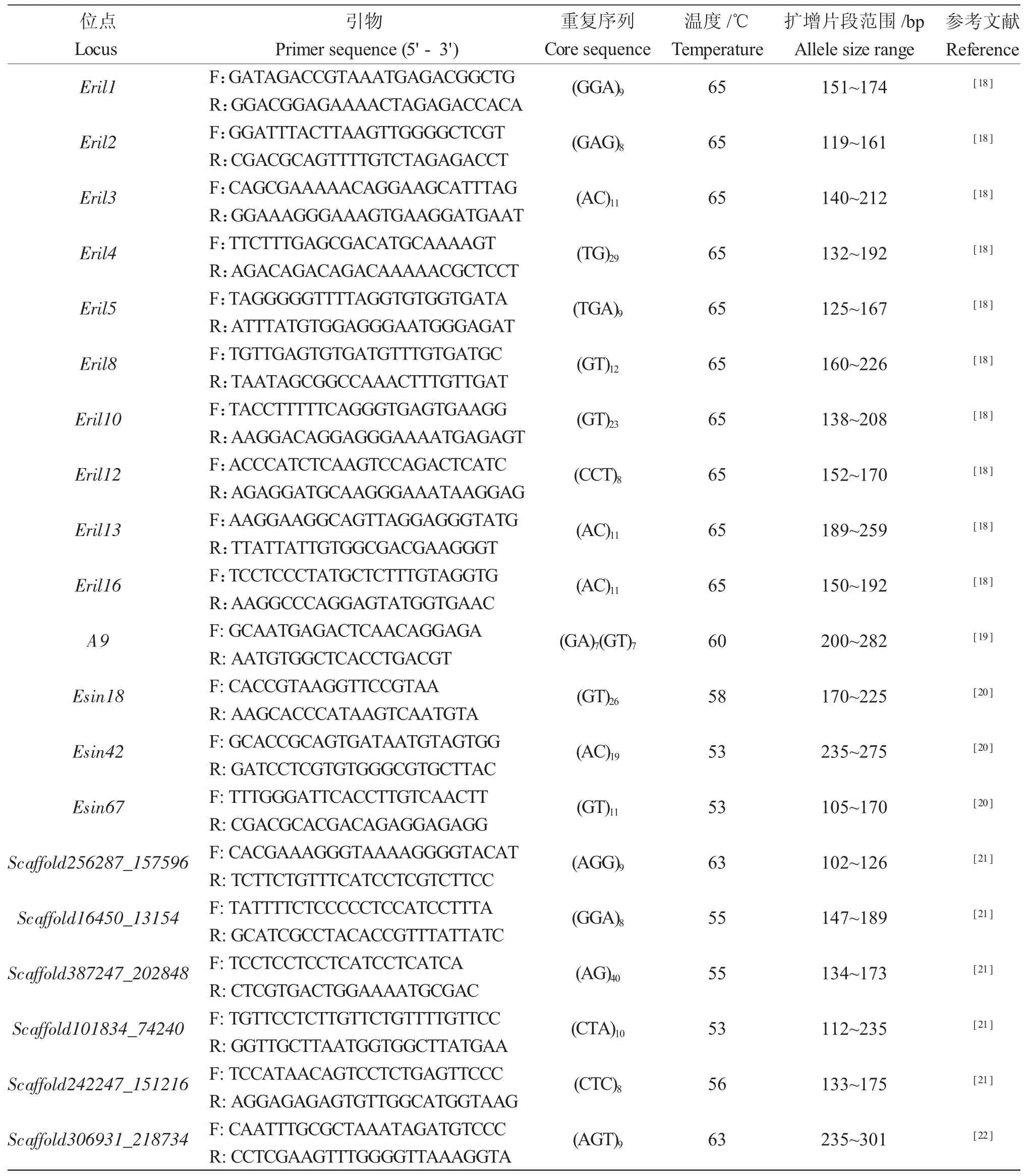
表1 河蟹微卫星引物位点特征Tab.1 Characterization of microsatellite loci in mitten handed crab
1.4 数据分析
根据各位点基因片段长度,确定每个样品各位点的基因型。利用Popgen 1.32 软件分析遗传多样性参数信息,包括等位基因数(Na)、有效等位基因数(Ne)、香农威纳指数(I)、观测杂合度(Ho)和期望杂合度(He)[23];采用PIC_Calc 6.0 软件计算多态性信息含量(PIC)[24]。
本实验探究了不同样本量、位点数和性别比对遗传多样性参数的影响。(1)不同样本数量对遗传多样性参数的影响分为6 组(60 样本组、50 样本组、40 样本组、30 样本组、20 样本组和10 样本组),每个样本组采用的位点数量均为20 个,雌雄性别比均为1∶1;(2)不同位点数量遗传多样性参数影响共分为4 组(20 位点、15 位点、10 位点和5 位点),所用样本数量为60 只,雌雄性别比为1∶1;(3)不同性别比对遗传多样性参数影响分为5 组:全部雌体、雌雄比2∶1、1∶1 和1∶2 及全部雄体,所用样本数量为30 只,位点数量为20 个。
所有数据采用平均值±标准误(Mean±SE)表示,应用SPSS 19.0 软件进行统计学分析,采用ANOVA 进行方差分析,Duncan 氏法多重比较,P<0.05 表示差异显著。
2 结果与分析
2.1 不同样本数量遗传多样性参数比较
不同样本数量各位点等位基因数量如图1 所示。整体而言,随着样本数量减少,每个位点的Na值也呈下降趋势,其中20 和10 样本组的Na值下降明显。等位基因数越多的位点,Na值下降幅度越大。60 样本组Eril 3 位点的Na值最高,达到了26 个;Eril 1 位点的Na值最低,为7 个。10 样本组Eril 16和Esin18 位点的Na值最高,均为12 个,而Eril 12位点的Na值最低,仅为3 个。不同样本数量蟹各位点有效等位基因数量除Eril 1 和Eril 2 位点外,其余10 样本组各位点的Ne值均最低,从60 样本组到10 样本组的Ne值整体上呈下降趋势。60 样本组Eril 3 位点的Ne值最高,达16.5 个;Eril 5 位点的Ne值最低,仅2.4 个。10 样本组Scaffold242247_151216 位点Ne值最低,仅1.7 个(图2)。
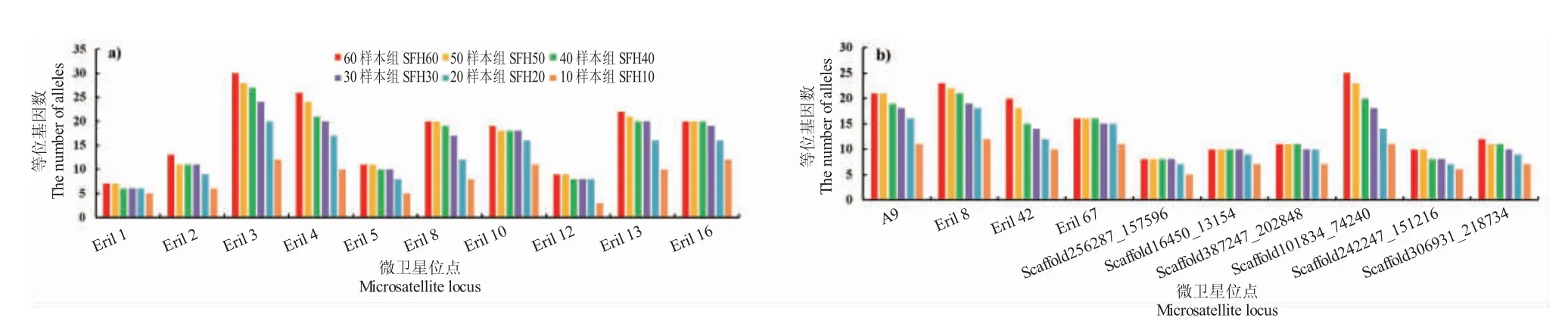
图1 不同样本数量各位点等位基因数量Fig.1 The number of alleles in different individual numbers

图2 不同样本数量各位点有效等位基因数量Fig.2 The number of effective alleles at each locus in different sample individual number groups
各位点观测杂合度随着样本量的减少,除位点Eril 3、Eril 10、Eril 13 和Eril 16 的Ho值相差不大外,其余位点Ho值均变化明显(图3)。10 样本组样本量太少,明显影响数据的真实度。
各位点期望杂合度数值变化情况,除Eril 1、Eril 2、Eril 5、Eril 12 和Scaffold256287_157596 位点He值随样本量变化较大外,其余位点He值随样本量变化不大(图3)。10 样本组Eril 12 位点He值较60 样本组下降了27.8%。
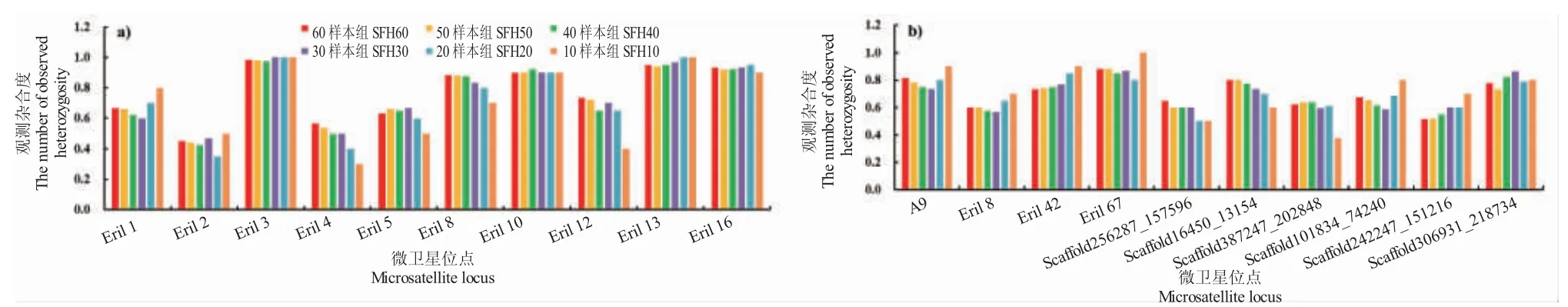
图3 不同样本数量各位点观测杂合度Fig.3 The number of observed heterozygosity at each locus in different sample individual number groups

图4 不同样本数量各位点期望杂合度Fig.4 The number of expected heterozygosity at each locus in different sample individual number groups
各位点多态性信息含量变化情况,绝大部分位点随样本量变化不大,仅20 和10 样本组的Eril 5、Eril 12 和Scaffold256287_157596 位点PIC 值变化较大,其中10 样本组Eril 12 位点PIC 值较60 样本组下降幅度最大,约40%(图5)。

图5 不同样本数量各位点多态性信息含量Fig.5 The polymorphism information content at each locus in different sample individual number groups
各位点香农威纳指数随着样本量的变化,I 值变化明显。其中10 样本量组与其它样本量组差异较大。其中Eril 12 位点I 值较60 样本组下降了51.04%,说明10 样本组的样本量太少,显著影响了整体数据的真实度(图6)。
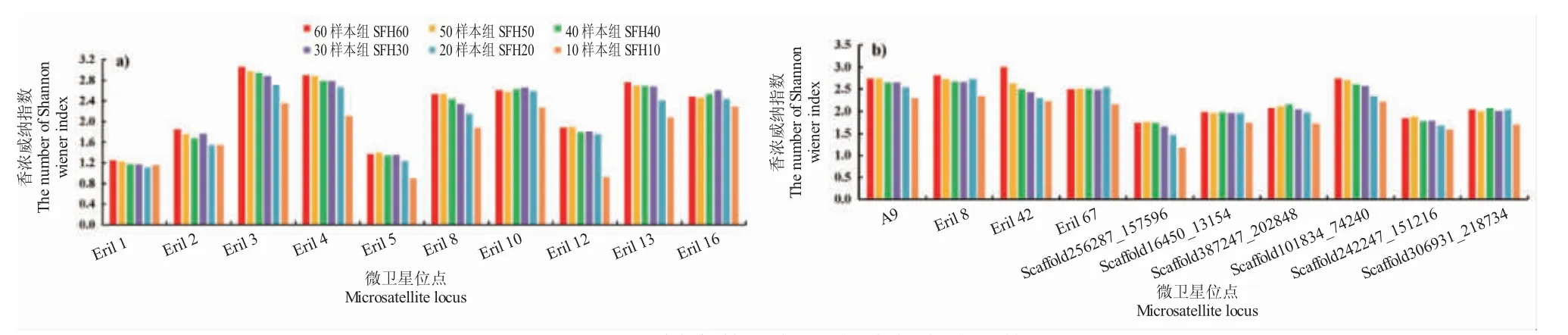
图6 不同样本数量各位点香农威纳指数Fig.6 The Shannon Wiener Index at each locus in different sample individual number groups
不同样本数量20 个位点的平均遗传多样性参数,60 样本组与30~50 样本组、20 样本组和10 样本组平均Na值存在显著性差异(图7-a)(P<0.05),30~50 样本组内平均Na值无显著性差异(图7-a)(P>0.05)。50~60 样本组与20~40 样本组、10 样本组的平均Ne值存在显著性差异(图7-a)(P<0.05),50~60 样本组内、20~40 样本组内平均Ne值则无显著性差异(图7-a)(P>0.05)。不同个体数的平均Ho值、He值和PIC 值则无显著性差异(图7-b)(P>0.05)。30~60 样本组与20 样本组、10 样本组I值存在显著性差异(图7-b)(P<0.05)。

图7 不同样本数量遗传多样性参数比较Fig.7 Comparison of genetic diversity parameters in different sample individual number groups
2.2 不同位点数量遗传多样性参数比较
60 个样本量不同位点数量的遗传多样性参数如图8 所示。不同位点数的平均Na、Ne、Ho、He、PIC和I 均无显著性差异(P>0.05)。由20 位点到15 位点的遗传多样性参数值差别不大,而5 位点的参数下降较为明显,标准误值明显增大。说明位点数少会影响群体遗传多样性评价的准确性。
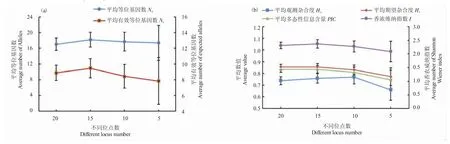
图8 不同位点数量遗传多样性参数比较Fig.8 Comparison of genetic diversity parameters in different premier loci in different sample individual number groups
2.3 不同性别比遗传多样性参数比较
30 样本量不同性别比的遗传多样性参数如图9 所示。不论哪种性别组合,不同位点数的平均Na、Ne、Ho、He、PIC 和I 均无显著性差异(P>0.05),说明雌雄性别比对群体遗传多样性分析无显著影响。
3 讨论
遗传多样性是评价物种资源状况的重要依据和从本质上揭示物种起源、变异和进化的重要手段[25]。遗传多样性参数包括等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、多态性信息含量(PIC)和香农威纳指数(I)等[12],与基因丰度呈正相关[26]。
本研究表明:不同样本数量绥芬河河蟹Na值差异较大,主要原因是Na严重依赖于样本量的大小,大样本量包含更多的等位基因[27]。针对同一位点Esin18 而言,辽河、黄河和长江水系野生与养殖中华绒螯蟹共360 个样本的Na为34 个[10],长江水系中华绒螯蟹早熟与晚熟品系共480 个样本的Na为52 个[28],长江、瓯江、闽江和南流江水系野生河蟹共128 个样本的Na为39 个[12]。而本研究绥芬河河蟹共60 个样本的Na为23 个,明显低于已往文献报道数值,主要原因有三点:一是本研究样本量为60个,而上述相关研究的样本量显著多于本研究的样本量;二是绥芬河河蟹为单一地理群体,而上述相关研究为多地理群体,多地理群体会增加基因丰富度;三是本研究所用位点为针对中华绒螯蟹开发的分子标记,对绥芬河河蟹种质可能存在一定的不适性。因此本研究Na值会较低。其余位点如Esin42、Esin67、Scaffold256287_157596、Scafold16450_13154、Scaffold387247_202848、Scaffold101834_74240、Scaf fold242247_151216、Scaffold306931_218734 等Na值与已往报道文献[10,12,28]数值的差异原因同上。本研究中不同样本量每个位点的Ne值均小于Na值,可能是等位基因在不同样本量中分布不均匀、等位基因频率分布不均所致[29]。
本研究中,不同样本数量绥芬河河蟹Ho差异较大,主要原因是Ho很容易受到样本量的影响[30]。He受样本数量影响相对较小,本研究中仅20%位点受到样本量影响,其余80%位点则相对较为稳定,这与阮惠婷等[30]在飘鱼(Pseudolaubuca sinensis)中的研究结果相似,因此He可以作为遗传多样性分析的重要参数,He数值越大,表明遗传多样性越高。PIC 是反应群体的遗传变异和等位基因位点多样性的重要指标[31]。当PIC≥0.5 时,为高度多态位点;0.25<PIC<0.5 时为中度多态位点;PIC≤0.25 时为低度多态位点。本研究中仅20 和10 样本量Eril 5、Eril 12 和Scaffold256287_157596 位点PIC 值变化较大,且数值均大于0.5,说明绥芬河河蟹天然群体遗传多样性很高,但样本量较少会影响PIC 数值的精确性。I 是反应群体均匀性分布的一个重要指标,一般情况下I 值介于1.5~3.0 之间[32]。本研究中10样本量95%位点I 值明显低于20~60 样本量I 值,说明I 值受低样本量影响较大。而超过20 样本量后,I 值受样本量差异影响较小。
现有文献报道,影响河蟹遗传多样性参数的位点数从6[33,34]到30 个[28]不等。本研究中20、15、10 和5 位点四种情况对遗传多样性参数的影响结果表明:5 位点对Ne、Ho、He、PIC 和I 值影响较大,且标准误数值偏大。这与目前无文章采用5 位点分析河蟹群体遗传多样性相一致[12,34,35]。Wang 等[12]采用30 只样本量,8 个多态性位点分析长江、瓯江、闽江和南流江水系野生河蟹群体显示,Ne分别为10.266、9.969、9.491 和7.308;熊良伟等[18]采用30 只样本量,10 个多态性位点分析辽宁养殖、江苏养殖和长江野生群体的遗传多样性参数,表明每个群体的Ne分别为8.710、8.770 和9.030;刘青等[10]采用60 只样本量,29 个多态性位点分析辽河、黄河和长江水系野生与养殖中华绒螯蟹群体的遗传多样性参数,表明每个群体的Ne值分别为13.080、13.757、14.099、13.550、14.006 和14.078;Li 等[28]采用60 只样本量,30 个多态性位点分析长江水系中华绒螯蟹早熟品系表明,不同选育世代(G0-G3)的Ne分别为16.729、13.391、15.038 和14.981,晚熟品系(G0-G3)的N 分别为16.591、14.775、13.236 和14.942。在检索河蟹群体遗传多样性相关文献时,发现一般样本量较多的文献,其应用的位点数也较多,而Ne值受样本量、检测群体等多因素影响,因此,单纯依靠现有文献报道无法确定最小的位点数目。而本研究表明,60 只样本量,20、15、10 和5 位点的Ne分别为8.870、9.464、8.432 和7.836,标准误分别为0.971、1.214、1.512 和2.989。相同群体样本量可以精确不同位点数量对遗传多样性参数的影响数据。不同性别比对河蟹遗传多样性参数影响目前暂无文献报道。本研究表明,性别比对遗传多样性参数无显著性影响,故在实验期间性别比对遗传多样性参数的影响可以忽略不计。
综上所述,不同样本量对绥芬河河蟹各位点遗传多样性参数Na、Ne和Ho影响较大,且10 样本量降低了参数PIC 和I 数值。5 位点明显降低参数Ne、Ho、He、PIC 和I 数值,性别比对参数无显著影响。

