药物洗脱支架与金属裸支架治疗颅内动脉狭窄比较
唐超坤, 齐 立, 周 维, 王 琳
颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是我国缺血性脑卒中人群的主要病因之一,占比高达30%~50%[1]。尽管强化药物治疗可明显减少ICAS患者缺血性脑卒中复发[2-3],但仍有4%~37%患者出现复发[4-6]。基于一系列高质量研究的积极结果,支架植入成为治疗ICAS新选项[7-10]。然而传统金属裸支架(bare-metal stent,BMS)植入术后1年支架内再狭窄(in-stent restenosis,ISR)发生率为15%~33%,其临床广泛应用受到限制[11-14]。药物洗脱支架(drug-eluting stent,DES)可明显减少ISR发生率及相关缺血事件[15-16],但在颅内血管应用仍较少。本研究回顾性分析80例ICAS患者临床资料,比较DES与BMS治疗ICAS的效果,以期为ICAS血管内治疗支架选择提供实践依据。
1 材料与方法
1.1 一般资料
收集2020年3月至2021年11月解放军第九二四医院收治的80例ICAS患者临床资料。根据所使用支架类型分为DES组和BMS组,每组40例,其中男43例,女37例,中位年龄66.5(59.0~72.0)岁;狭窄部位:椎动脉颅内段20例,基底动脉18例,大脑中动脉15例,颈内动脉颅内段27例。入组标准:①ICAS诊断明确并成功植入DES或BMS;②术后即刻残余狭窄<30%[17];③如期完成随访;④患者及家属签署手术知情同意书。主要排除标准:①存在血管串联病变或其他血管狭窄,并于手术同时或研究随访期内再次植入支架;②手术为ISR治疗。本研究获医院伦理委员会批准。
1.2 术前准备
术前完善DSA或CTA检查,对患者动脉狭窄程度、是否有斑块或夹层、斑块位置形态和性质等进行评估,出现以下情况视为高风险手术:①严重动脉硬化,血管迂曲细小,支架可能难以通过;②靶血管狭窄段较长或存在多处狭窄,需植入多枚支架,且支架会出现重叠情况,可能会对血管造成较大损伤;③斑块位于穿支动脉开口处,球囊扩张可能造成穿支闭塞;④靶血管狭窄段有明显钙化斑块,有分叉处斑块或不规则斑块。术前予以口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)双联抗血小板聚集药,连续3~5 d。
1.3 手术方法
两组手术均在全身麻醉下进行,术中动态监测患者血压、心率、呼吸、血氧饱和度等生命体征,采用股动脉或桡动脉入路,Seldinger技术置入6 F动脉鞘,全身肝素化,泥鳅导丝配合下将6 F指引导管头端置于合适位置;根据靶血管狭窄段长度和远端管径选择合适支架,0.014英寸微导丝引导将支架(DES或BMS)输送至靶血管狭窄段;路图及透视下调整支架位置,能完全覆盖靶血管狭窄段并超出其两端各2 mm以上;压力泵缓慢加压,支架扩张满意后迅速撤压,复查造影,确认血管成形情况良好后回撤输送装置,必要时再次球囊扩张。
1.4 术后处理及随访
术后4 h复查头颅CT平扫,排除出血事件后继续口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)至术后3~6个月,序贯阿司匹林(100 mg/d)或氯吡格雷(75 mg/d)单药治疗。严格控制患者血压、血糖、血脂及其他危险因素。术后1、3个月门诊随访,6个月复查DSA或头颅CTA,期间出现明显缺血事件则随时复查。
1.5 观察指标
观察分析术中和术后并发症,如支架内血栓形成、夹层形成、血管破裂、穿支或远端血管闭塞、高灌注损伤、支架移位或断裂、靶血管相关缺血事件等发生情况;术后即刻残余狭窄;术后6个月ISR发生情况。血管狭窄率计算依照文献中WASID方法[18]。ISR定义:支架内或支架两端5 mm内血管狭窄>50%,或在原血管狭窄基础上绝对管腔丢失>20%[11]。
1.6 统计学方法
采用SPSS 26.0软件进行统计学分析。正态分布计量资料以均数±标准差表示,组间比较用两独立样本t检验;非正态分布计量资料以M(P25,P75)表示,组间比较用Mann-WhitneyU检验。计数资料以例(%)表示,组间比较用χ2检验或Fisher检验。P<0.05为差异有统计学意义。
2 结果
两组患者一般资料比较差异无统计学意义(P>0.05),见表1。DES组、BMS组术后即刻残余狭窄分别有2例(椎动脉20.0%、大脑中动脉25.0%各1例)、3例(椎动脉28.0% 1例,大脑中动脉20.0%1例、15.0% 1例),发生率分别为5.0%、7.5%,差异无统计学意义(OR=0.65,95%CI=0.10~4.11,P>0.05);术后6个月ISR分别有3例、10例,发生率分别为7.5%、25.0%,DES组明显低于BMS组(OR=0.24,95%CI=0.06~0.96,P=0.03),见表2。
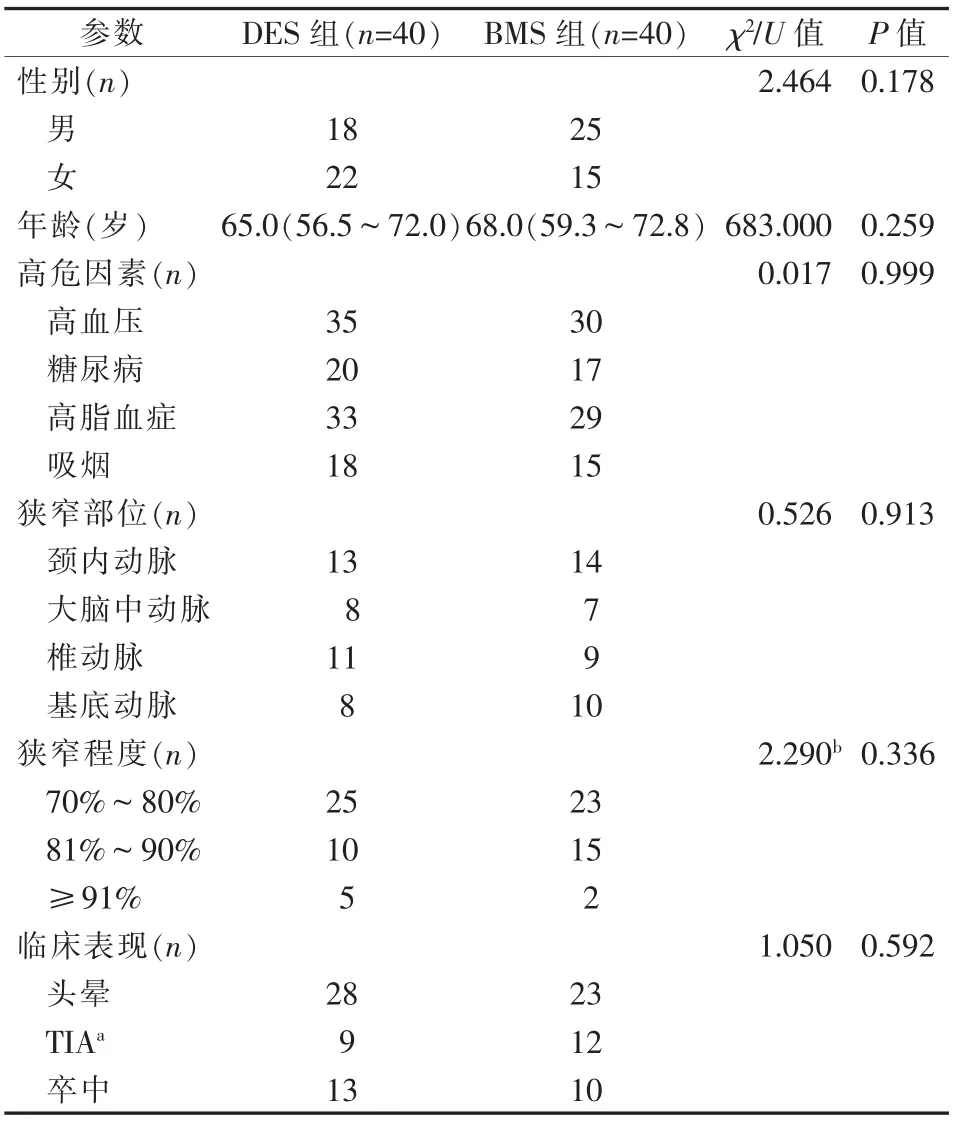
表1 两组患者一般资料比较
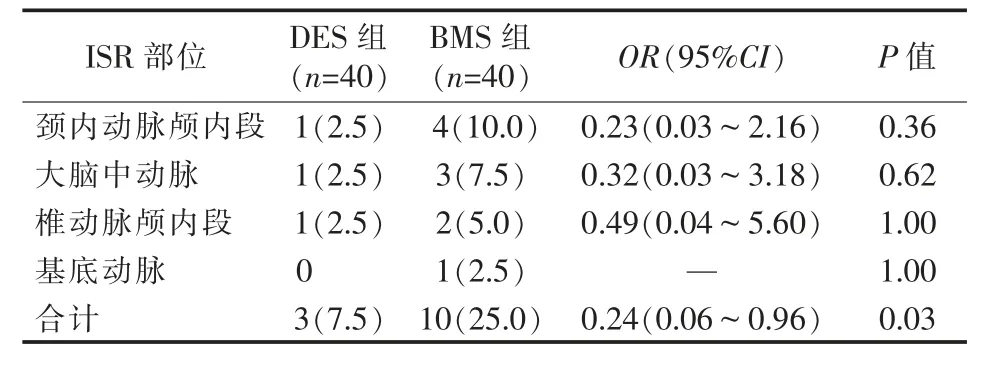
表2 两组患者术后6个月ISR发生率比较 [n(%)]
两组术中和术后并发症发生情况见表3,未出现血管破裂、支架移位或断裂等并发症。DES组并发症发生率较BMS组低,但差异无统计学意义(OR=0.78,95%CI=0.19~3.14,P>0.05)。
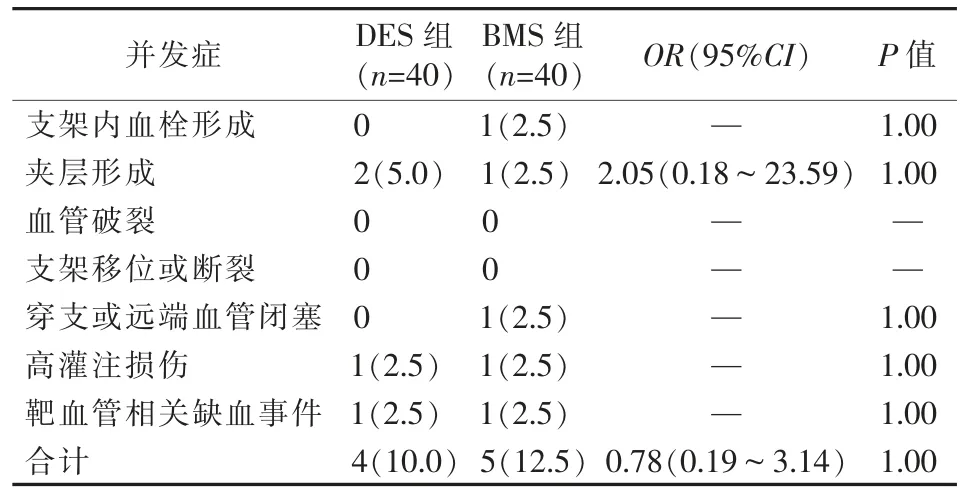
表3 两组患者术中和术后并发症发生情况比较 [n(%)]
3 讨论
有症状的ICAS患者通过支架植入治疗可大幅度降低缺血性脑卒中发生风险[19],但由于颅内血管形态和结构特殊性,血管迂曲走行会极大地增加球囊和支架到位难度,导致颅内血管支架成形术难以快速发展[20]。随着材料科学不断发展,支架通过性和顺应性逐渐得到完善和提升,其在颅内血管疾病的应用越来越广泛[21]。BMS是传统治疗ICAS最常用支架。Dong等[22]报道采用Enterprise支架治疗ICAS患者20例,随访发现ISR发生率为15%。蔡栋阳等[17]、王震宇等[21]研究显示Wingspan支架治疗后ISR发生率为16.7%。Zhang等[12]报道ISR发生率高达33.3%。本研究中BMS组ISR发生率为25%。无论是否发生缺血事件,BMS治疗均面临ISR发生率较高的困境。
DES被认为是BMS困境的突破口,其通过药物涂层缓慢释放,抑制支架植入后血管内皮细胞和平滑肌细胞增殖和迁移,从而有效降低ISR风险[23]。但早期研究多来源于冠状动脉支架跨适应证使用,仍存在因顺应性不足所致通过性不佳问题[24-27]。近期一项随机对照研究报道新型颅内动脉专用支架NOVA支架临床应用效果,显示有98.5%成功植入率,ISR发生率为9.5%,表明性能良好[28]。有研究显示Maurora椎动脉支架ISR发生率为5%,随访1年无脑卒中复发[29]。ICAS治疗将逐渐进入DES时代。
夏金超等[30]研究显示,DES组ISR发生率为11.0%,明显低于BMS组37%,差异有统计学意义。本研究中DES组ISR发生率为7.5%,明显低于BMS组25.0%,差异有统计学意义。这表明DES可有效降低ISR发生。同时,本研究中DES组并发症发生率与BMS组相当,表明DES在ICAS治疗中无额外风险增加,具有较高安全性。
综上所述,DES治疗颅内动脉狭窄具有较高的有效性和安全性,与BMS相比术后ISR发生率更低,同时相关并发症少,可维持手术远期疗效,减轻患者家庭及社会负担,具有较高的临床推广价值。

