罗沙司他治疗血液透析肾性贫血患者的疗效及安全性观察
蒋飞飞,洪大情,杜亚琴,甘 措,陈 琴,关 欣,邓 菲*
0 引言
近年来,慢性疾病发病率逐步提高,其中,慢性肾脏病(Chronic kidney disease,CKD)成为公共卫生领域面临的一项重大挑战[1]。目前,我国CKD患者多达1.32亿,其中约40万患者需要接受透析治疗[2],而维持性血液透析是终末期肾病患者的主要治疗手段[3]。
CKD并发症中,肾性贫血最为常见[4]。其原因主要为慢性肾脏病肾脏功能受损,导致促红细胞生成素(Erythropoietin,EPO)生成受阻,同时,铁、叶酸等造血原料缺乏,胃肠道铁吸收受限,炎症状态,失血,透析器及管路血液残留等多因素也会加重贫血[5-6],使得肾性贫血在透析人群中的发生率高达98.2%[7],且较低的知晓率、治疗率与达标率严重危及患者生命健康,缩短患者预寿命[8]。
针对肾性贫血的治疗,临床上常用外源性EPO联合铁剂以通过促进红细胞增殖分化来治疗肾性贫血[9-10]。然而,由于使用静脉铁剂会促进患者炎症状态,使用外源性EPO对血压可能产生影响,因此,上述2种治疗方式的安全性一直备受关注[11-12]。近年来,随着肾性贫血治疗相关研究不断深入,新型药物罗沙司他在中国率先完成Ⅲ期临床研究,其作为低氧诱导因子-脯氨酰羟化酶抑制剂(Hypoxia-inducible factor-proline hydroxylase inhibitors,HIF-PHI),主要通过上调EPO水平的同时,降低铁调素,改善铁利用,从而达到治疗肾性贫血的目的[13]。本研究探讨罗沙司他治疗血液透析肾性贫血患者的疗效,并通过观察其毒副作用以评估其安全性。
1 资料与方法
1.1 临床资料 收集2019年8月至2021年8月在成都市金牛区人民医院血液透析半年内的肾性贫血患者,共60例,随机分为3组,每组20例,所有研究对象签署知情同意书,研究通过医院伦理审核(伦理号:KY202018)。
1.1.1 纳入标准 符合CKD肾性贫血诊断标准[14];既往未使用EPO或已停用3个月以上;签署知情同意书;具有完整疗效评价资料。
1.1.2 排除标准 年龄小于18岁或大于80岁;急慢性活动性出血;合并严重肝功能损害、恶性肿瘤或其他严重合并症、并发症;精神异常或不配合研究;对相关药物严重过敏。
1.2 治疗方法 均采取每周3次血液透析治疗。其中,A组采用小剂量(每周剂量小于10 000 U)EPO皮下注射,B组患者采用大剂量(每周剂量10 000~20 000 U)EPO皮下注射,C组患者采用罗沙司他胶囊口服(体重40~60 kg,每次口服100 mg;体重>60 kg者,每次口服120 mg;所有患者每周均口服3次)。所有患者均口服多糖铁复合物0.15 g qd,连续治疗12周。
1.3 观察指标 分别检测3组治疗前、治疗4周及12周的红细胞比容(Red blood cell specific volume,HCT )、血红蛋白(Hemoglobin,HB)、铁蛋白(Ferritin,FER)以及血压(BP)变化。并且密切观察所有患者不良反应。
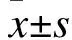
2 结果
2.1 一般资料 三组患者一般资料比较差异无统计学意义(P>0.05),见表1。
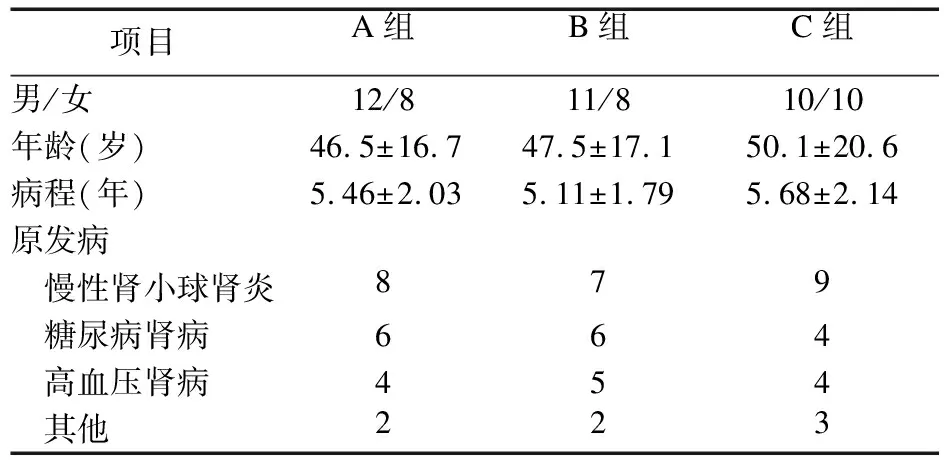
表1 三组患者一般资料比较
2.2 动态监测指标及疗效评估
2.2.1 HCT、HB变化情况 治疗前,三组患者HB及HCT比较差异无统计学意义(P>0.05);治疗4周,B组和C组HB、HCT均高于治疗前,且C组高于B组(P<0.05),B组高于A组(P<0.05);治疗12周,三组HB、HCT均高于治疗前,B组与C组比较差异无统计学意义(P>0.05),且均高于A组(P<0.05)。见表2~表4。
2.2.2 FER变化情况 治疗前以及治疗4、12周,三组FER比较差异无统计学意义(P>0.05);C组治疗12周FER较治疗前降低(P<0.05)。见表5。
2.2.3 BP变化情况 治疗前以及治疗4周,三组BP比较差异无统计学意义(P>0.05);治疗12周,A组、C组BP均低于B组(P<0.05),但两组比较差异无统计学意义(P>0.05)。见表6、表7。
2.3 不良反应 A组恶心2例次,腹泻2例次,不良反应发生率20.0%(4/20);B组恶心2例次,腹泻2例次,头痛1例次,心力衰竭1例次,不良反应发生率30.0%(6/20);C组恶心1例次,腹泻1例次,头痛1例次,皮肤瘙痒1例次,不良反应发生率20.0%(4/20)。三组不良反应发生率比较差异无统计学意义(P>0.05)。全部患者诊疗均保持连续性,无治疗延迟及治疗引起相关死亡,经积极治疗能有效缓解。
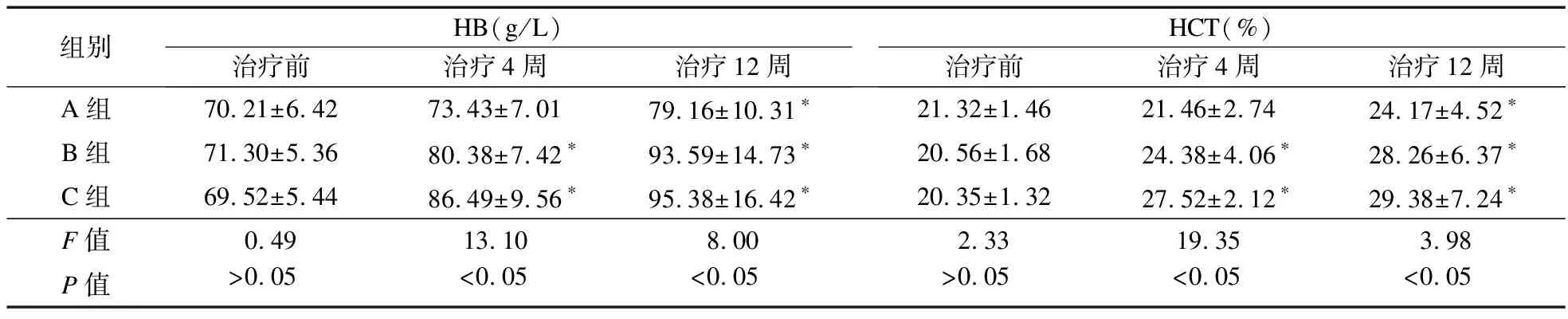
表2 三组患者HB、HCT比较
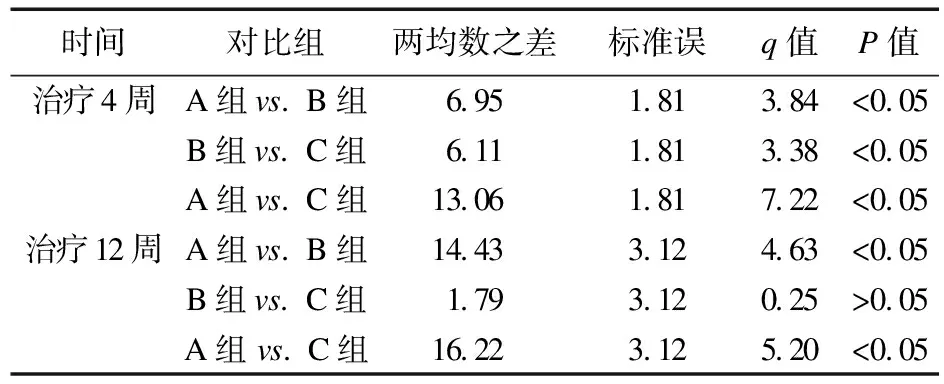
表3 三组治疗有效患者治疗4、12周HB SNK检验结果
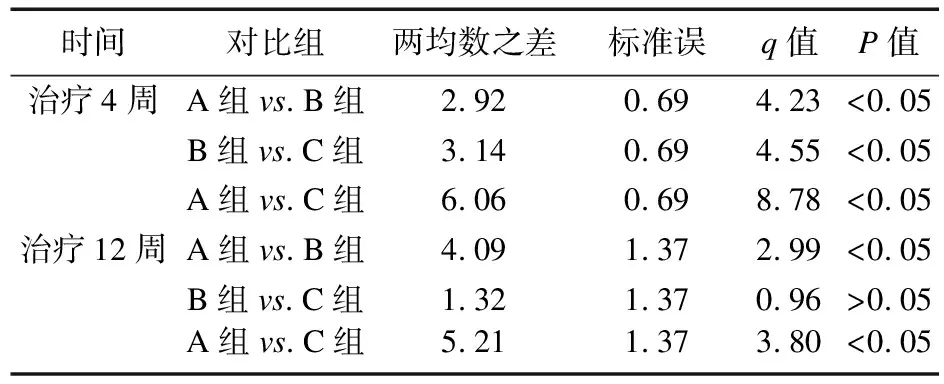
表4 三组治疗有效患者治疗4、12周HCT SNK检验结果
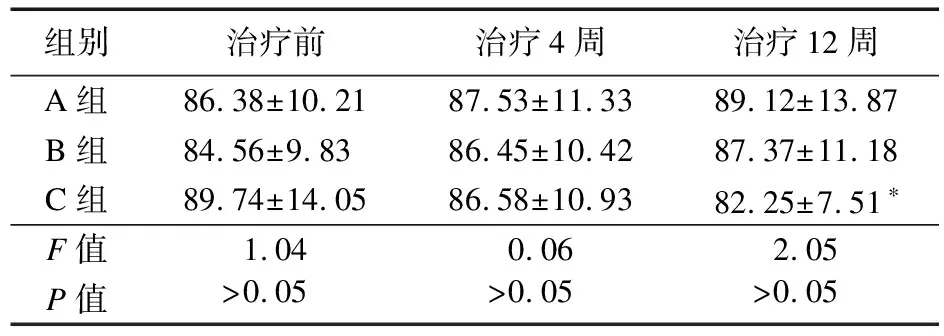
表5 三组患者FER比较(μg/L)
3 讨论
肾性贫血常与铁缺乏、骨髓造血系统微环境改变、肾间质分泌促红素不足等密切相关,贫血可引起患者氧利用率降低、心室缺氧肥厚,从而降低患者生活质量和生存率等严重不良后果[15],因此,肾性贫血的诊治有着举足轻重的地位。多年来,肾性贫血治疗方案主要采用EPO及铁剂[16],通过促进造血母细胞分化,改善肾脏贫血。但由于存在EPO抵抗及铁剂的感染风险,近年来,科学家通过模拟机体缺氧状态,使HIF得以稳定,从而调控下游靶基因编码,诱导内源性EPO合成。罗沙司他为纠正肾性贫血的新型口服药物,能够有效改善患者贫血状况[17-18]。
本研究结果表明,在治疗早期即治疗4周,小剂量EPO组贫血无明显改善,而罗沙司他与大剂量EPO均有效纠正贫血,且在治疗早期罗沙司他纠正贫血疗效优于大剂量EPO;治疗后期即治疗12周,罗沙司他、大剂量EPO及小剂量EPO均可以有效纠正贫血,且罗沙司他及大剂量EPO疗效明显优于小剂量EPO,而治疗12周罗沙司他与大剂量EPO纠正贫血疗效相当,提示纠正肾性贫血罗沙司他较大剂量EPO起效更快。
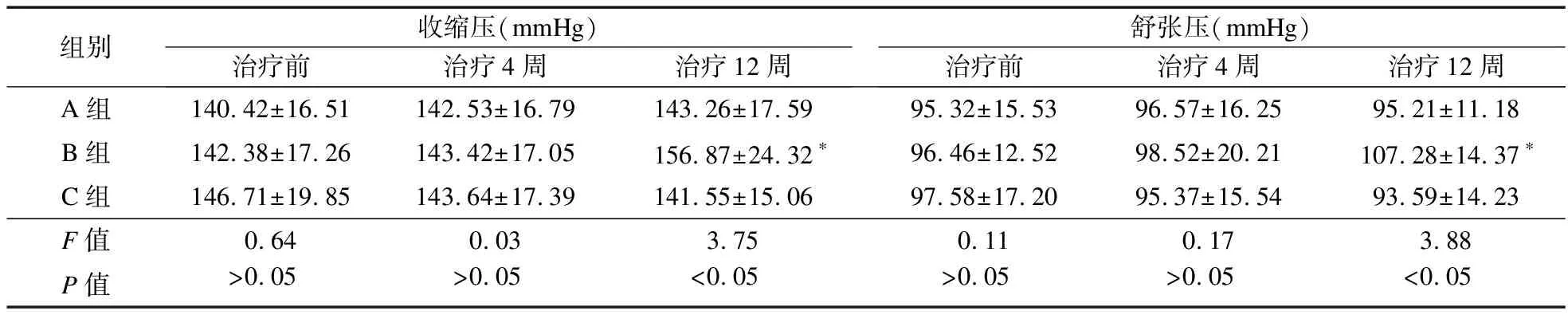
表6 三组患者BP比较
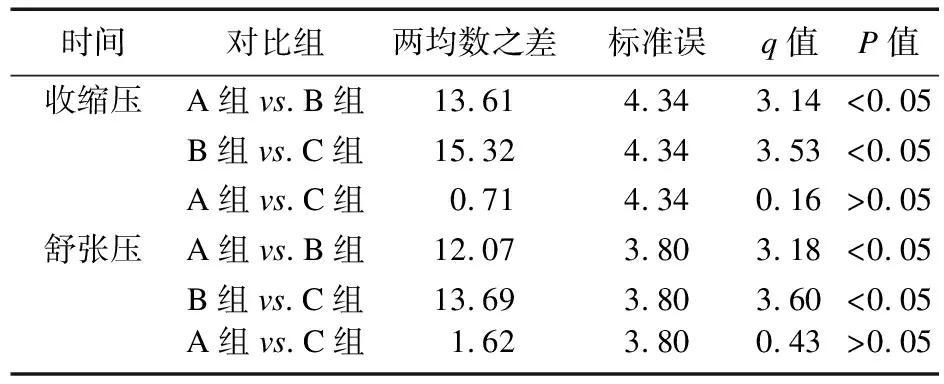
表7 三组治疗12周血压有差异患者收缩压、舒张压SNK检验结果
本研究中,治疗12周后,大剂量EPO组、小剂量EPO组铁蛋白与治疗前差异无统计学意义,而罗沙司他治疗12周铁蛋白较治疗前降低,但并不影响纠正贫血疗效,提示罗沙司他纠正贫血对铁的依赖不高,主要由于罗沙司他通过激活机体对血液中氧含量降低的自然反应,此反应涉及多个相互协同过程的调节,从而可以在减少铁剂使用的情况下管理贫血。而许多肾性贫血患者对EPO疗效差或治疗无反应,是由于慢性肾脏病患者本身缺铁,EPO无法直接促进红细胞合成,需要补充使用铁剂。因此,在用EPO治疗时,首先保证体内充足铁储备。
应用EPO会出现高血压,本研究中,治疗4周后,大剂量EPO、小剂量EPO及罗沙司他组均未出现血压升高;而治疗12周后,大剂量EPO组出现血压升高,提示大剂量EPO后期会引起血压升高,对于血压未控制的重度高血压患者,EPO容易进一步导致血压升高,从而引发心脑血管疾病。因此,如果血压无法控制,需立即停止使用EPO,而使用罗沙司他组并未出现血压升高现象。
另外,在治疗过程中,所有患者均无治疗延迟及治疗引起相关死亡,不良反应轻微且经积极治疗均能有效缓解,说明罗沙司他、小剂量EPO和大剂量EPO均较安全。有研究表明,与罗沙司他治疗相关的不良事件的发生率低于5%,且多数为1~2级[19]。
由于本研究样本量局限性,是否能够准确反映总体水平有待进一步考证;且本研究收集病例的观察期较短,无法得到长期随访数据,下一步应继续进行随访,探讨罗沙司他疗效及不良反应;罗沙司他对铁依赖不高,下一步研究将探讨罗沙司他有效纠正贫血所需铁的靶点。
综上所述,本研究表明,罗沙司他能有效纠正肾性贫血,且起效较快,对铁剂的依赖性不高,且较安全。
——忌食

