氧化及不同离子强度下猪肉肌原纤维蛋白结合风味物质的研究
甘 潇,赵 玲,吴 倩,陈希文,*
(1.绵阳师范学院生命科学与技术学院,四川 绵阳 621000;2.动物疫病防控与健康养殖工程技术研究中心,四川 绵阳 621000)
肉及肉制品风味特点是衡量其品质特征的重要指标之一,在很大程度上影响了消费者对肉及肉制品的接受情况。蛋白质是继脂肪组织外影响肉制品风味的又一重要组分。肌肉蛋白对肉及肉制品风味形成的贡献主要表现在两个方面:一是蛋白质的降解氧化作用,在这个过程中蛋白质可以降解为小肽、氨基酸和醛类等风味前体物质,而风味前体物质可以通过进一步的Strecker 降解反应或美拉德反应生成风味化合物[1]。这些风味化合物与脂肪氧化形成的风味物质及非挥发性化合物等共同构成肉及肉制品的整体风味[2]。蛋白质对风味的影响更多的是通过物理或化学方式结合和释放风味物质,从而影响肉品基质呈现出来的整体风味。国内外学者通过研究初步了解肉品基质结合与释放风味物质的机制从而调节产品风味,改变产品感官品质特性[3]。大量的研究也表明肌肉蛋白质本身是没有味道的,之所以呈现出风味是因为蛋白与风味物质的交互作用从而影响肉制品的风味[4]。为了更加全面地了解蛋白质-风味物质之间的相互作用机制,很多研究[5-6]报道了关于模型体系研究蛋白质对风味物质结合的机理。总结国内外的研究报道可以看出,蛋白质和风味物质本身的结构及种类、反应体系的离子强度、外部温度、pH 等因素都会影响蛋白对风味物质的结合[7]。根据前期的研究发现,腊肉加工过程中蛋白质经历了氧化和降解过程,而氧化降解的蛋白质除了本身会产生风味物质外,还会发生结构改变从而改变对风味物质的结合能力,以至于呈现出不同的风味[8]。在肉及肉制品的加工和贮藏过程中,随着蛋白质氧化过程的发生,其结构也随之发生变化。离子强度改变如目前倡导的低盐肉制品体系中,钠离子的部分替代也导致肉品体系离子种类和强度的改变,这些都会影响蛋白质与风味物质的结合。
因此,为了探究肉及肉制品的蛋白质-风味物质结合机理,本文构建了猪肉肌原纤维蛋白的氧化体系,了解氧化引起的蛋白质结构变化,并采用顶空自动进样(HS)结合气相色谱(GC)法分析氧化后猪肉肌原纤维蛋白在不同离子强度下与特征风味物质的结合特性。本研究为肉及肉制品在加工及贮藏过程中风味的保持,食盐部分替代肉制品风味分析机制提供了理论基础。
1 材料与方法
1.1 材料与仪器
猪里脊肉 购于绵阳市高薪区永辉超市;磷酸二氢钾钠、磷酸氢二钠、叠氮化钠、氯化镁、氢氧化钠、乙二胺四乙酸二钠、氯化钠、氯化钾、氯化钙、三氯乙酸等 均购于成都市科龙化工试剂厂;5,5'-二硝基(2-硝基苯甲酸)、2,4-二硝基苯肼(DNPH)、尿素、盐酸胍、十二烷基硫酸钠(以上试剂均为分析纯)、三甲基丁醛、正己烷、己醛、辛醛、芳樟醇、苯乙酮(以上试剂均为GC 纯)等 购于上海阿拉丁生化科技股份有限公司。
XHF-D 内切式匀浆机 宁波新芝生物科技股份有限公司;Avanti J-30I 冷冻离心机 美国贝克曼库尔特公司;722 型可见分光光度计 上海元析仪器有限公司;F-2500 荧光分光光度计、UV-2450 紫外分光光度计、GC-2010 Plus 气相色谱 日本岛津公司。
1.2 实验方法
1.2.1 肌原纤维蛋白(MP)的提取 参考Wang 等[9]的方法适当修改后提取MP。取10 g 绞碎的新鲜猪肉样品,加入4 倍体积10 mmol/L 磷酸盐缓冲液(含0.1 mol/L 的NaCl,1 mmol/L 的乙二胺四乙酸二钠,2 mmol/L 的氯化镁,pH7.0)7000 r/min 均质30 s,暂停3 min 再均质30 s,4 ℃ 2000×g 下离心15 min,去除上清液,重复上述操作3 次。沉淀中加入40 mL 0.1 mol/L 的NaCl 溶液,7000 r/min 均质30 s,2000 g条件下离心15 min,重复操作2 次,最后一次离心用20 mmol/L 的pH6.0 磷酸盐缓冲液离心,沉淀即为MP,以上操作均在冰浴条件下进行。
1.2.2 MP 氧化体系的制备 提取的MP 最终用含0.6 mol/L NaCl 的20 mmol/L 磷酸盐缓冲液(pH6.0)分散并稀释至浓度为15 mg/mL(含0.5 mg/mL NaN3)并分成4 等份,然后添加2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH),使其在MP 中的浓度分别为0、10、20、50 mmol/L。将各MP 溶液在37 ℃反应1.5 h。样品溶液在冰浴中冷却至4 ℃并离心(2000×g,10 min,4 ℃),使用蒸馏水将所得沉淀物洗涤两次并在相同条件下离心终止反应。不含MP 且未经氧化处理的缓冲液试剂瓶为对照样。
1.2.3 蛋白羰基的测定 参考Wang 等[10]的方法适当修改后测氧化处理MP 的羰基含量。经氧化处理的MP 用20 mmol/L 的缓冲液(pH6.0,含0.6 mol/L NaCl)调至5 mg/mL。分别取两份400 μL 的MP 溶液,一份加入800 μL 的HCl (2 mol/L,内含0.2% (w/v)的DNPH)处理,另一份样品加入800 μL 的HCl(2 mol/L)处理后作为空白。放置30 min 后,加入400 μL 的三氯乙酸溶液(40%),在5000×g 条件下离心5 min。随后沉淀中加入1 mL 乙醇-乙酸乙酯(1:1[v/v])混合液并在10000×g 条件下离心处理5 min。重复上述操作3 次后,在沉淀中加入1.5 mL 的磷酸盐溶液(pH6.5,20 mmol/L,含有6 mol/L 的盐酸胍)。待蛋白质溶解后在4 ℃条件下放置12 h,分别在280 和370 nm 处测定吸光度。按如下公式计算蛋白羰基值:

式中:A 代表吸光度;22000 表示摩尔吸光系数,L/(mol·cm)。
1.2.4 蛋白巯基的测定 参考Wang 等[11]的方法适当修改后测定氧化处理MP 总巯基含量。经氧化处理的MP 用20 mmol/L 的缓冲液(含0.6 mol/L NaCl,pH7.0)调至4 mg/mL。取1 mL 处理的MP 加入9 mL磷酸盐缓冲液(50 mmol/L,pH7.0,内含8 mol/L 的尿素、10 mmol/L 的EDTA 和0.6 mol/L 的NaCl)。在10000 r/min 条件下冷冻离心15 min 后,取3 mL离心上清液,加入400 μL 的50 mmol/L 乙酸钠溶液(内含10 mmol/L DTNB),在40 ℃条件下加热处理25 min,冷却后在412 nm 处测定吸光度。按如下公式计算蛋白总巯基值:

式中:D 代表稀释倍数;C 代表MP 浓度,mg/mL;13600 为摩尔吸光系数,L/(mol·cm)。
1.2.5 蛋白内源荧光的测定 参照Jiang 等[12]的方法适当修改测定MP 内源荧光。将MP 用0.6 mol/L NaCl 溶液溶解为质量分数为0.5 mg/mL 的蛋白溶液。0.6 mol/L NaCl 溶液作为空白,对蛋白溶液进行荧光光谱检测。仪器参数设置为:激发波长295 nm,发射光谱范围300~400 nm,扫描范围300~400 nm,扫描速度1500 nm/min,激发和发射狭缝均为2.5 nm,扫描3 次。
1.2.6 蛋白表面疏水性的测定 参照Chelh 等[13]的方法测定MP 表面疏水性。将MP 用0.02 mol/L、pH7.0 的磷酸盐缓冲液配制成质量浓度为5 mg/mL的蛋白溶液。取1 mL 蛋白样液和200 μL 1 mg/mL溴酚蓝(蒸馏水溶解)溶液于离心管中,同时做对照(1 mL 0.02 mol/L 磷酸盐缓冲液和200 μL 1 mg/mL溴酚蓝于离心管中),室温下振荡10 min,在8000×g条件下离心l0 min,取上清液400 μL 稀释10 倍,用分光光度计在595 nm 处测定吸光度值,空白为0.02 mol/L、pH7.0 的磷酸盐缓冲液,肌原纤维蛋白质表面疏水性以结合溴酚蓝的量表示,其计算公式如下:

1.2.7 蛋白溶解度的测定 参照曹云刚等[14]的方法修改测定蛋白溶解度。用50 mmol/L 磷酸盐缓冲液(含0.6 mol/L NaCl,pH6.25)冰浴条件下2800 r/min均质处理氧化的MP,制成蛋白浓度2.5 mg/mL 的MP 溶液。4 ℃条件下放置1 h,4 ℃,8000 r/min 离心15 min,取上清测MP 浓度(双缩脲法测定),空白为磷酸盐缓冲液。

1.2.8 HS-GC 检测氧化对蛋白质结合风味物质能力的影响 将选定风味物质溶于正己烷制成储备液。在含AAPH 浓度分别为10、20、50 mmol/L 的氧化体系中,用20 mmol/L 磷酸盐缓冲液(含0.6 mol/L NaCl,pH6.0)稀释到9 mg/mL,并添加风味物质储备液,使得各风味物质(2-甲基丁醛、3-甲基丁醛、己醛、辛醛和壬醛)在MP 中的终浓度均为2.5 mg/mL,然后分别检测不同程度氧化蛋白对风味物质结合能力的影响。五种风味物质的选择是基于其在干腌发酵肉制品中的特殊贡献[15-16]。风味物质的检测参照Estévez 等[17]的方法有所改进。取5 mL 样品于20 mL的顶空萃取瓶中,用PTEE 硅胶隔垫和螺帽密封。将样品在旋涡振荡器上振摇30 s。空白对照瓶用20 mmol/L 磷酸盐(含0.6 mol/L NaCl,pH6.0)替代蛋白样品,空白对照及含蛋白样品的萃取瓶均置于35 ℃振摇反应12 h。反应的样品萃取瓶置于顶空自动进样器中待分析。顶空条件设置为:顶空平衡时间为30 min,平衡温度为80 ℃,顶空固定管温度为150 ℃,传输线温度为150 ℃。使用GC-2010 Plus气相色谱仪对顶空风味物质进行检测。样品在250 ℃的进样口进行解吸。使用氮气为载气,流速为1.0 mL/min。用Rtx-Wax 柱(30 m×0.25 mm×0.25 μm)分离各样品的挥发性化合物。风味提取物通过自动顶空进样器进样注入,分流比为10:1。GC 炉温最初在40 ℃保持60 s;以8 ℃/min 升温至90 ℃并保持60 s;进一步以6 ℃/min 升温至205 ℃,保持60 s;以20 ℃/min 上升至230 ℃并保持4 min,总加热时间为33.5 min。当风味物质满足GC 火焰离子化检测器(FID)中的火焰温度被电离,FID 直接检测并定量风味物。通过测量风味物质的出峰时间与标品进行比较来确定风味物质。蛋白样品顶空风味物质浓度以百分比表示,100%表示的是不含蛋白仅含相同体积缓冲液的对照萃取瓶中各种风味物质在萃取瓶顶空的浓度。所有分析均进行三次。
1.2.9 HS-GC 检测不同离子条件下氧化蛋白结合风味物质的能力 在含AAPH 浓度为15 mmol/L 的氧化体系中,用20 mmol/L 磷酸盐缓冲液(含 0.6 mol/L NaCl,pH6.0)稀释到9 mg/mL,并添加风味物质储备液,使得各风味物质在MP 中的终浓度均为2.5 mg/mL,然后添加NaCl、KCl、CaCl2和MgCl2到氧化的MP 中,使得最终浓度为0.5 mmol/L。然后如1.2.8 检测不同离子条件下氧化蛋白结合风味物质的水平。
1.3 数据处理
运用SPSS 19.0 对试验数据进行单因素方差(analysis of variance,ANOVA)分析、最小显著差数法(least significant difference,LSD)多重比较。用Origin 8.1 作图。
2 结果与分析
2.1 氧化处理MP 羰基含量的变化
AAPH 经常被用于在不同的氧化系统模型中热分解产生过氧自由基[18],其不仅在脂质氧化中起着重要作用,也是促进蛋白氧化的活性氧物质[19]。蛋白羰基是蛋白质氧化的重要产物[20]。不同浓度AAPH 氧化处理MP 蛋白羰基含量如图1 所示,随着AAPH浓度的增加羰基含量显著增加(P<0.05)。本试验中,氧化空白的MP 羰基含量为1.59 nmol/mg,与周非白[21]的研究结果类似,也与对照组(鲜肉蛋白)羰基含量结果无显著差异(P>0.05),当AAPH 浓度达到50 mmol/L 时,蛋白羰基含量显著增加到17.53 nmol/mg蛋白(P<0.05),说明MP 随着AAPH浓度的增加发生了不同程度地氧化。羰基是蛋白氧化的标准产物[20],很多研究都是用羰基值来衡量蛋白的氧化程度。Wen等[22]研究了哈尔滨香肠钠盐替代对脂肪和蛋白氧化及风味物质变化的影响,文章对蛋白质氧化对羰基等影响进行了研究,随着时间的延长,对照和替代组蛋白羰基含量均显著增加,KCl 替代组羰基含量显著低于KCl 和其它物质共同替代组,说明在香肠发酵过程中发生蛋白质氧化反应,而不同替代对蛋白质氧化程度有显著影响。马国源[23]比较了牦牛肉和肌肉肌红蛋白羰基值的差异,从而得出低剂量烟硝酸钠抑制牦牛肉肌红蛋白氧化的结论。本研究的前提条件是猪肌原纤维蛋白发生氧化反应,因而也对羰基值进行了检测。

图1 氧化处理MP 羰基含量的变化Fig.1 Changes in carbonyl content of MP upon oxidation
2.2 氧化处理MP 总巯基含量的变化 蛋白质巯基(半胱氨酸残基)损失是蛋白质氧化的标志之一,含硫氨基酸的巯基(硫醇残基)极易发生氧化反应[24]。不同浓度AAPH 氧化处理MP 总巯基含量如图2 所示,总巯基从15.46 nmol/mg 降到4.41 nmol/mg。随着AAPH 浓度的增加,MP 的巯基含量显著下降(P<0.05),说明MP 发生了氧化。在肉体系中,过氧自由基可以从半胱氨酸的S-H 基团中抽取氢原子以产生硫基自由基[25],并进一步与其他硫醇/硫醇盐反应产生二硫化物或与分子氧反应生成硫代过氧自由基[26]。Zhang 等[27]强调巯基属于弱二级键,有助于稳定蛋白质的三级结构。因此,可以推测巯基的损失会导致MP 三级结构的变化。

图2 氧化处理MP 巯基含量的变化Fig.2 Changes in sulfhydryl content of MP upon oxidation
2.3 氧化处理MP 色氨酸荧光的变化 色氨酸残基位于天然蛋白质的内核中并在295 nm 光谱激发下可以在330~370 nm 内发射荧光[28]。色氨酸残基的直接氧化降解和蛋白质去折叠都能够导致荧光强度的损失[29]。不同浓度AAPH 氧化处理MP 色氨酸荧光变化如图3 所示。随着AAPH 浓度的增加,色氨酸荧光强度逐渐降低。在本试验中,色氨酸残基易受过氧自由基的氧化,因为过氧自由基可以在色氨酸吲哚环的1 位抽取氢原子,从而产生色氨酰基[30]。值得注意的是色氨酸在蛋白质中的位置可以影响它们对过氧自由基的反应性[31]。因此,色氨酸在蛋白质表面上的暴露可能使它们变得更容易受到过氧自由基的攻击。Diao 等[31]表明荧光强度与色氨酸浓度密切相关。因此,降低的荧光强度可能与过氧自由基对色氨酸的消耗有关。

图3 氧化处理MP 色氨酸荧光的变化Fig.3 Changes in tryptophan fluorescence of MP upon oxidation
2.4 氧化处理MP 表面疏水性的变化 表面疏水性普遍用于评价疏水性氨基酸残基在蛋白质表面的分布程度[32]。不同浓度AAPH 处理MP 的表面疏水性变化如图4 所示。对照组和氧化空白样品表面疏水性无显著差异(P>0.05),随着AAPH 浓度从0 mmol/L增加到50 mmol/L,表面疏水性显著增加到最大(P<0.05)。一般来说,蛋白质氧化是自由基链式连锁反应。在蛋白质分子中,氧化损伤可以通过自由基进行连锁反应,如初始氧化半胱氨酸的巯基可以导致随后的α-位(主链)和β-位(侧链)的碳原子团的形成,并且这些碳原子基团会导致下游的链式反应,因此这种氧化损伤会从蛋白质表面通过自由基链式反应传递到蛋白质的内部[24]。因此过氧自由基很可能会传递到蛋白质包埋的氨基酸,如芳香氨基酸里面的酪氨酸和色氨酸残基极易被过氧自由基氧化[33]。此外,芳香族氨基酸残基的氧化可以产生一些带电基团,增强这些侧链的亲水能力,这可能迫使氧化的芳香族侧链分布在蛋白质表面上[34]。因此,随着AAPH浓度的增加,表面疏水性增加。
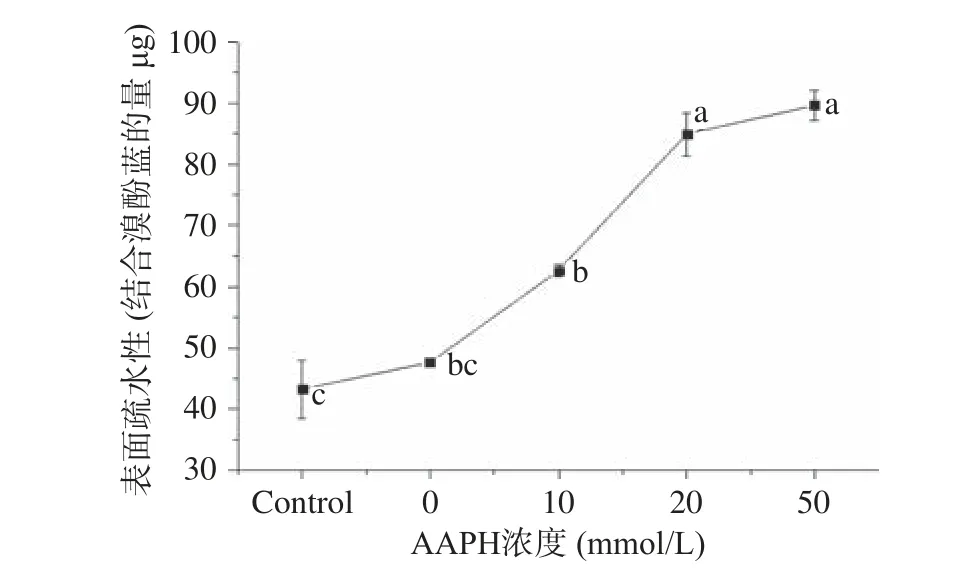
图4 氧化处理MP 表面疏水性的变化Fig.4 Changes in protein surface hydrophobicity of MP upon oxidation
2.5 氧化处理MP 溶解度的变化 不同浓度AAPH氧化处理MP 可溶性的变化如图5 所示。对照组和AAPH 氧化空白组MP 可溶性最高且无显著差异(P>0.05),随着AAPH 浓度的增加,MP 溶解度显著降低(P<0.05),由氧化空白组的72.85%降低到AAPH 浓度为50 mmol/L 时的38.25%。一般认为蛋白质溶解度的降低是因为蛋白-水相互作用的降低[30]。在AAPH 作用下,蛋白质表面疏水性氨基酸侧链基团的暴露,增加了蛋白质的聚集,从而降低了蛋白质在水中的溶解度。

图5 氧化处理MP 可溶性的变化Fig.5 Changes in solubility of MP upon oxidation
2.6 氧化对MP 结合特征风味物质能力的影响 蛋白结构是影响蛋白结合风味物质能力的重要因素[3]。在表征蛋白氧化后结构改变的基础上,试验进一步研究了氧化引起蛋白结构变化对其结合风味物质能力的影响。试验选取5 种风味物质在对照及氧化蛋白的萃取瓶顶空的含量(%)对比分析如图6 所示。试验发现2-甲基丁醛和壬醛在对照瓶顶空的含量显著低于氧化MP 在萃取瓶顶空的含量(P<0.05),表明氧化处理的MP 对2-甲基丁醛和壬醛有促释放作用。实验表明当AAPH 达10 mmol/L 浓度时,MP 的氧化促进了其对己醛和辛醛的吸附作用,对2-甲基丁醛和壬醛有促释放作用。当AAPH 达20 mmol/L 浓度氧化MP 时,MP 促2-甲基丁醛、3-甲基丁醛、辛醛、壬醛等的释放能力显著高于对照组(P<0.05)。当AAPH 浓度达到50 mmol/L 时,3-甲基丁醛、己醛、辛醛和壬醛含量均显著低于(P<0.05)AAPH 浓度为20 mmol/L 时顶空瓶上空的含量,说明MP 的高强度氧化使得其对3-甲基丁醛、己醛、辛醛和壬醛的吸附能力增强。Zhou 等[3]研究了氧化诱导的肌纤维蛋白结构修饰对其与芳香化合物结合能力的影响,结果发现芳香化合物的结合受到蛋白质氧化水平的强烈影响。本实验同样检测到当AAPH 浓度为20 mmol/L 时,其结合风味化合物能力降低,可能是一定程度氧化导致蛋白质结构的再折叠,加速蛋白质的聚集,降低了芳香化合物的亲和力,从而降低了结合能力。而当AAPH 浓度为50 mmol/L时,蛋白质会发生再聚集和部分降解,进而对蛋白质的表面性质进行修饰,表面褶皱的聚集蛋白有利于与芳香化合物的疏水相互作用,形成蛋白质-芳香化合物复合物,从而增强其结合能力。

图6 氧化对MP 结合特征风味物质能力的影响Fig.6 Effect of oxidation on the ability of MP to bind characteristic flavor substances
2.7 不同离子Na+、K+、Ca2+、Mg2+对氧化处理MP结合风味物质的影响 蛋白质结合风味物质的能力与环境中不同离子及离子浓度有关,先前研究表明20 mmol/L 的AAPH 可以使蛋白质发生氧化,加速蛋白质的聚集,降低芳香化合物的亲和力,因而为避免此浓度的过度氧化使蛋白质聚集后结合位点被遮蔽,从而影响加入离子后的反应效果,选择AAPH 浓度为15 mmol/L 时氧化MP 的基础上,试验研究了不同离子一定浓度对氧化后的蛋白质结合风味物质能力的影响。试验所选的5 种风味物质在对照及添加不同离子Na+、K+、Ca2+和Mg2+的氧化蛋白的萃取瓶顶空含量(%)分析如图7 所示。Na+、K+、Ca2+和Mg2+离子条件下的MP 对2-甲基丁醛、3-甲基丁醛、己醛、辛醛、壬醛都有吸附作用(顶空风味物质浓度百分比<100%),并且,Na+的添加使己醛在顶空瓶上空的含量显著增加(P<0.05),说明Na+的添加对己醛有促释放的作用,可能是由于盐析作用的影响,这与María 等[34]的研究结果一致。而Mg2+的添加使己醛在顶空瓶上空的含量减少,说明Mg2+的添加对己醛有吸附作用,K+和Ca2+的添加对蛋白质和己醛相互作用无显著影响(P>0.05)。Na+、K+、Ca2+和Mg2+的添加使顶空瓶上空2-甲基丁醛、3-甲基丁醛、辛醛和壬醛的含量显著降低(P<0.05),说明Na+、K+、Ca2+和Mg2+的添加促进了蛋白对2-甲基丁醛、3-甲基丁醛、辛醛和壬醛的吸收。近年来,国内外的研究学者大多从盐部分替代后的肉制品品质变化进行研究,认为低盐肉制品之所以呈现出某种性质是因为替代盐本身的特质,而本研究旨在说明肉制品在盐部分替代状态时表现出来的不同风味可以从盐离子影响蛋白质吸附风味物质的能力方面进行分析考虑。因此,本研究为盐部分替代肉制品风味分析机制提供了理论基础。
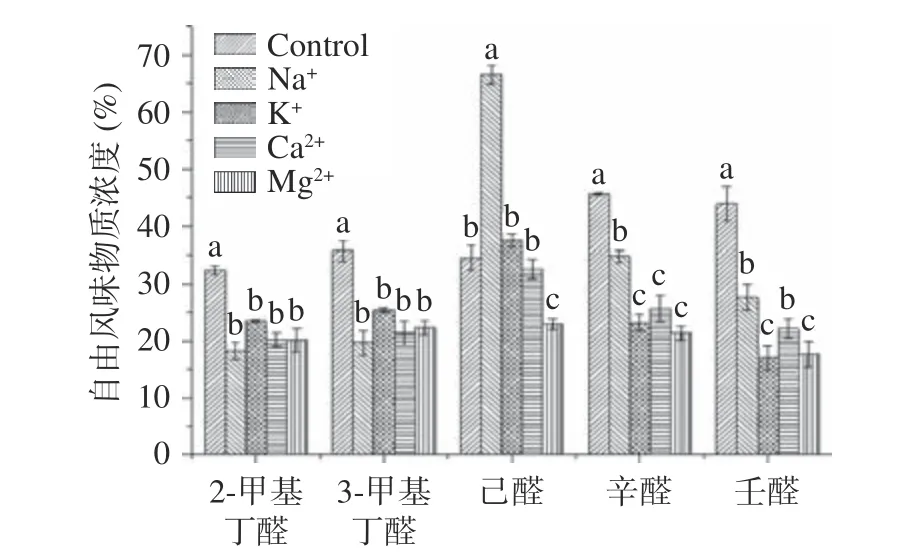
图7 不同Na+、K+ 、Ca2+、Mg2+浓度对氧化处理的MP 结合风味物质能力的影响Fig.7 Effects of different sodium, potassium, calcium and magnesium concentrations on the flavor substances of oxidized MP binding properties
3 结论
本实验采用AAPH 氧化体系诱导MP 的氧化,从蛋白氧化的角度修饰MP 的结构,经氧化的MP 羰基含量升高,巯基含量降低,色氨酸荧光减少,表面疏水性增加,MP 溶解度降低。因氧化的MP 其结构改变导致其结合风味物质的能力有所改变。蛋白的氧化会提高促进蛋白对2-甲基丁醛、3-甲基丁醛、辛醛和壬醛的释放,但该释放作用呈AAPH 浓度依赖性。不同盐离子Na+的添加促进了氧化蛋白对己醛的释放,而Na+、K+、Ca2+和Mg2+的添加促进了氧化蛋白对2-甲基丁醛、3-甲基丁醛、辛醛和壬醛的吸收。因此,在氯化钠被部分替代的肉制品加工及贮藏过程中,蛋白质易发生氧化而改变其结构功能,进而影响蛋白质结合风味物质的能力,从而使肉制品风味发生变化。

