水蛭chitotriosidase-1-like基因的原核表达及功能初步研究
卢昱希,程搏幸,赵 宇,张 涛,唐远江,陶小燕,周思旋,刘 飞
(1.贵州省农业科学院 畜牧兽医研究所,贵州 贵阳 550002;2. 贵州师范学院 生物科学学院,贵州 贵阳 550018;3. 盐城工学院 海洋与生物工程学院,江苏 盐城 224051)
水蛭Hirudo nipponica隶属于无吻蛭目Arhynchobdellida Blanchard,医蛭科Hirudinidae Whitman,医蛭属HirudoLinnaeus。作为2020年版《中国药典》收录的水蛭药材的基原动物[1],水蛭在我国分布广泛,通常栖息于常年积水或排水不良的水田及与其相通的沟渠、池塘和沼泽中,靠吸食动物的新鲜血液为生[2]。近二十年来,随着对水蛭研究的深入,发现其体内含有多种药用活性成分。具有凝血酶抑制功效的大分子化合物水蛭素(Hirudin)[3-4]、具有抗凝活性的多肽New Leech Protein-1(NLP-1)[5]和蚂蟥寡肽-1(Whitide-1)[6]能抑制血小板聚集的多肽Saratin[7]、Decorsin[8]以及具有药用活性的蛋白酶抑 制 剂Destabilase[9]、Guamerin[10]、Bdellin-HM-2[11]、Hirudinaria manil-lensis[12]、Heparin cofactor II[13]等多种活性成分已被鉴定并从水蛭中分离出来。越来越多的研究表明水蛭具有抗凝血[14]、溶血栓[15]、抗炎[16]等药用功效,可应用于心脑血管疾病的治疗[17],药用价值潜力巨大。
一直以来,水蛭作为我国一味传统中药,其研究主要集中在抗凝血活性及机理方面,有关其抗菌活性的研究鲜见报道。但随着对水蛭研究的深入,研究人员发现水蛭不仅会分泌水蛭素以防止血液凝固,在其摄食和储食过程中,还会分泌其它生物活性物质以防止血液中外来病原体入侵,且这些活性物质中含有大量蛋白,能有效抑制革兰氏阳性菌和革兰氏阴性菌[18-19]。基于上述研究,本研究以水蛭Hirudo nipponica作为实验材料,从其转录组数据中筛选到1条与抗菌生物活性相关的基因序列,克隆水蛭chitotriosidase-1-like基因的cDNA 全长序列,构建原核表达载体并转化至大肠杆菌表达菌株进行表达,得到重组蛋白后进行抑菌活性测定,并分析该基因在水蛭不同摄食期表达规律,为后期深入研究chitotriosidase-1-like基因生物学功能及水蛭摄食、储食机理奠定基础。
1 材料与方法
1.1 材料
实验用水蛭来源于贵州省黔南布依族苗族自治州荔波县境内,经贵州师范学院程搏幸副教授鉴定为水蛭药材的基原动物水蛭H.nipponica。养殖30 d后,取外表健康、体质量0.5 g左右的水蛭,一部分水蛭在冰上无菌解剖,取出水蛭唾液腺组织,储存于-80℃冰箱,用于提取总RNA;另一部分水蛭让其饱食新鲜血液1次,并按上述方法分别采取摄食前、摄食中、摄食后第1天、摄食后第2天、摄食后第3天、摄食后第5天、摄食后第7天、摄食后第9天、摄食后第12天、摄食后第15天水蛭唾液腺组织,储存于-80℃冰箱,用于测定chitotriosidase-1-like基因相对表达量。
1.2 菌种与载体
大肠杆菌菌株TOP 10、大肠杆菌表达菌株BL21(DE3)来自贵州师范学院生物科学学院实验室保存,实验用大肠杆菌25922、金黄色葡萄球菌6538、沙门氏菌13076来自贵州省畜牧兽医研究所实验室保存,均为标准菌株。
1.3 试剂
RNAiso Plus总RNA 提 取 试 剂、PrimeScript™II 1st Strand cDNA Synthesis Kit 反转录试剂盒、TB Green® Premix Ex TaqTMⅡ(Tli RNase Plus)荧 光定量试剂盒均购于宝生物工程(大连)有限公司;pEASY-Blunt Cloning Kit平端克隆载体试剂盒购于北京全式金生物技术有限公司;FastPure® Gel DNA Ex-traction Mini Kit胶回收试剂盒、Phanta Max Super-Fidelity DNA Polymerase高保真酶等购于南京喏唯赞生物科技股份有限公司;DNA胶纯化试剂盒、质粒小提试剂盒购于爱思进生物技术(杭州)有限公司;(AXYGEN)Protein Marker购于赛默飞世尔科技有限公司(Thermo);IPTG、Acr、Bis、Tris购于默克科学技术有限公司(Sigma);SDS购于Amresco公司,TEMED购于BIO-RAD公司;限制性内切酶购于宝日医生物技术(北京)有限公司(TaKaRa);Pfu DNA聚合酶购于南京钟鼎生物有限公司;Tyrptone、Yeast Extract购于OXOID公司,Agarose购于上海基因公司,0.22 μm无菌滤器和透析带购于密理博公司(Millipore);Ni-IDA亲和层析胶购于安诺伦(北京)生物科技有限公司(Novagen);LB培养基购于上海生工生物有限公司,其它试剂均为国产分析纯或化学纯。
1.4 基因数据获取
在水蛭唾液腺转录组数据库(SRP151118)中筛选到1条转录本序列,该序列比对到鸭嘴海豆芽Lingula anatina的chitotriosidase-1基 因 序 列,E值为6.0×10-138。本研究将该序列作为研究对象,命名为chitotriosidase-1-like。
1.5 总RNA的提取
按照RNAiso Plus总RNA 提取试剂操作步骤提取水蛭唾液腺总RNA,经1.0%凝胶电泳与微量分光光度计检验,将质量合格的总RNA通过PrimeScript™II 1st Strand cDNA Synthesis Kit 反转录为cDNA,供克隆使用。
1.6 chitotriosidase-1-like基因的克隆
利 用DNAMAN设 计chitotriosidase-1-like基 因cDNA扩增引物,上、下游引物见表1。以水蛭唾液腺cDNA为模版,运用Phanta Max Super-Fidelity DNA Polymerase高保真酶对chitotriosidase-1-like基因进行PCR扩增,1.5%凝胶电泳检验PCR产物,使用FastPure® Gel DNA Extraction Mini Kit胶回收试剂盒对条带大小正确的DNA片段进行胶回收,按照pEASYBlunt Cloning Kit平端克隆载体试剂盒操作说明,将胶回收后的目的片段连接到克隆载体上,转入克隆用大肠杆菌,将阳性克隆送至上海生工公司测序。
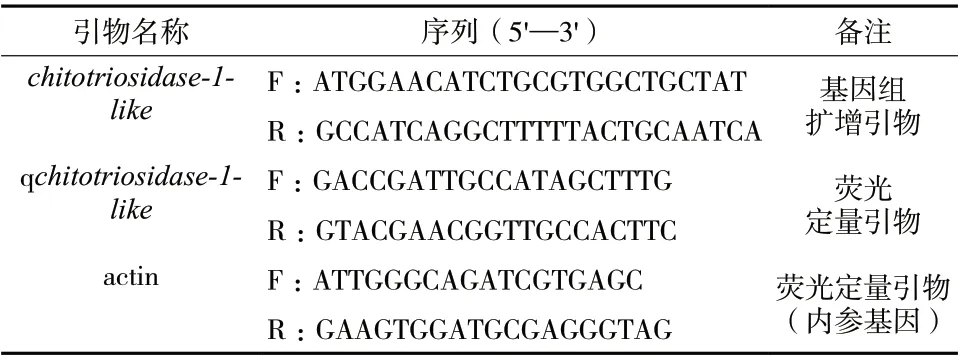
表1 水蛭chitotriosidase-1-like基因克隆及荧光定量所用引物Tab. 1 Primer for clone and fluorescence quantitation of chitotrosidase-1-like gene in Hirudo nipponica
1.7 chitotriosidase-1-like基因序列的生物信息学分析
在NCBI在线网站中,利用ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder/)查找该基因开放阅读框(ORF),将测序得到的chitotriosidase-1-like基因序列通过DNAMAN软件翻译成氨基酸序列,利用SinalP 5.0(https://novopro.cn/tools/signalp.html)进行蛋白序列的信号肽预测分析。通过Cell-PLoc 2.0在线网站(http: //www. csbio. sjtu. edu. cn/bioinf/Cell-PLoc-2/)对蛋白进行亚细胞定位分析。通过Expasy在线网站中的Protparam工具(https: //web. Expasy. org/protparam/)分析蛋白去除信号肽后的理化性质。通过Expasy在线网站中的ProtScale工具(https: //web. Expasy. org /protscale/)进行蛋白亲/疏水性分析。通过TMHMM Server 2.0在线网站(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测蛋白跨膜结构域。通过NetPhos 3.1 Server在线网站(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)进行蛋白磷酸化位点分析。通过NCBI在线网站(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构域。
1.8 chitotriosidase-1-like基因的原核表达
1.8.1chitotriosidase-1-like基因的原核表达载体的构建
根据克隆结果及核酸序列分析,去除chitotriosidase-1-like基因的信号肽序列,针对原核表达系统,优化密码子,基因合成由南京钟鼎生物有限公司合成,并将合成片段连接到pEt-32a上,获得重组质粒pEt-32a-chitotriosidase-1-like,将获得的重组质粒pEt-32achitotriosidase-1-like转入TOP10克隆菌株,挑取阳性克隆子测序。进行质粒酶切鉴定,构建质粒梅切体系,体系为:质粒3 μL,内切酶10.25 μL,内切酶20.25 μL,10×Buffer 1.0 μL,DDW 10 μL,进行酶切鉴定。
1.8.2 重组载体的诱导表达 将构建好的原核表达载体质粒转入BL21(DE3)感受态细胞,在LB液体培养基中,37 ℃,220 r/min振摇培养1 h,离心后全部涂布于含50 μg/mL氨苄西林(以下简称Amp)的LB固体培养基中,37 ℃培养过夜。挑取固体培养基上的单克隆接种于含50 μg/mL Amp的3 mL LB液体培养基中,37 ℃,220 r/min振摇培养过夜。次日按1∶100接种于含50 μg/mL的 Amp的30 mL LB液体培养基中,37 ℃振摇至OD600值为0.6 ~ 0.8,取1 mL培养物,10 000 r/min室温离心2 min,弃上清液,用100 μL 1×上样缓冲液重悬菌体沉淀;向剩余的培养物中加入IPTG至终浓度为0.5 mM,37℃诱导培养4 h,取1 mL培养物,离心弃上清后用上述上样缓冲液重悬菌体沉淀;剩余培养物继续离心10 min,弃上清后用PBS重悬菌体沉淀,重悬液进行超声破碎,破碎后取上清液与沉淀液加入上述上样缓冲液重悬,将4次缓冲液重悬样品进行12% SDS-PAGE检测分析。
1.8.3 包涵体蛋白的变复性 将菌体沉淀重悬于20 mL裂解液,超声破碎后于4 ℃、10 000 r/min离心20 min,收集沉淀,使用包涵体洗涤液洗涤包涵体3次,用溶解缓冲液按一定比例溶解包涵体,4 ℃放置过夜;次日恢复至室温,10 000 r/min离心15 min,将30 mL上述溶液逐步滴加到30 mL 0.15 M NaCl,20 mM Tris-HCl,pH 8.0缓冲液中,缓慢搅拌,滴加速度为1 mL/min,再将稀释蛋白溶液装入透析袋于0.15 M NaCl,20 mM Tris-HCl,pH 8.0溶液中透析过夜。
1.8.4 Ni柱纯化 利用低压层析系统,按0.5 mL/min流速,将上清溶液上样至Ni-IDA Binding-Buffer预平衡的Ni-IDA-Sepharose C1-6B亲和层析柱,按0.5 mL/min流速,用Ni-IDA Binding-Buffer冲洗,冲洗至流出液OD280值到达基线,按1 mL/min流速,用Ni-IDA Washing-Buffer (0.15 M NaCl,20 mM咪唑,20 mM Tris-HCl,pH 8.0)冲洗,冲洗至流出液OD280值到达基线,按1 mL/min流速,用Ni-IDA ELution-Buffer(0.15 M NaCl,250 mM咪唑,20 mM Tris-HCl,pH 8.0)洗脱目的蛋白,收集流出液,将收集的流出液加入透析袋中,使用0.15 M NaCl,20 mM Tris-HCl,pH 8.0进行透析过夜,进行12% SDS-PAGE分析。
1.9 chitotriosidase-1-like基因的抑菌活性测定
将大肠杆菌25922、金黄色葡萄球菌6538、沙门氏菌13076冻存液接种于5 mL LB液体培养基中,37 ℃、120 r/min振摇培养12 h;菌体复苏后接种于LB固体培养基上,37 ℃过夜培养;从固体培养基中挑取3 ~ 5个菌落接种于5 mL LB液体培养基中,37 ℃、120 r/min振摇培养8 h;取100 μL菌体溶液滴于新的LB固体培养基平板中央,用玻璃棒从各个方向涂抹均匀,采用纸片扩散法,根据抑菌圈大小判断抑菌活性。
1.10 不同摄食期chitotriosidase-1-like基因表达规律分析
根据chitotriosidase-1-like基因的cDNA序列,设计chitotriosidase-1-like基因荧光定量引物,模版为不同摄食时期的唾液腺(HN0、HN、HN1、HN2、HN3、HN5、HN7、HN9、HN12、HN15)的cDNA,内参基因选取β-Actin基因。利用ABI StepOne Real-Time PCR测定chitotriosidase-1-like基因的相对表达 量,按 照TB Green® Premix Ex TaqTMⅡ(Tli RNase Plus)荧光定量试剂盒操作说明书要求,分别加 入2 μL的cDNA,0.4 μL的ROX Reference Dye(50×),10 μL的TB Green Premix Ex TaqⅡ(Tli RNase Plus)(2×),各0.8 μL的引物,RNase Free dH2O 0.6 μL,反应体积为20 μL。按照试剂盒说明书设定程序进行反应,每组设置3个重复,计算chitotriosidase-1-like基因在不同摄食时期唾液腺中的相对表达量,使用Excel软件进行数据的统计与分析。
2 结果与分析
2.1 chitotriosidase-1-like基因克隆
根据水蛭唾液腺转录组中chitotriosidase-1-like基因的cDNA序列设计特异性引物F:ATGGAACATC TGCGTGGCTGCTAT、R:GCCATCAGGCTTTTTACTG CAATCA,以水蛭唾液腺cDNA为模版,进行PCR扩增,利用琼脂糖凝胶电泳检测扩增产物,发现在理论值附近出现特异性条带,测序结果与转录本碱基序列一致。
2.2 chitotriosidase-1-like基因的核酸分析
在NCBI在线网站中,利用ORF Finder对chitotriosidase-1-like基因序列进行分析,chitotriosidase-1-like基因开放阅读框全长1 872 bp,编码624个氨基酸,包含18个氨基酸组成的信号肽和606个氨基酸组成的成熟蛋白序列见图1,属于分泌蛋白,定位于细胞外。
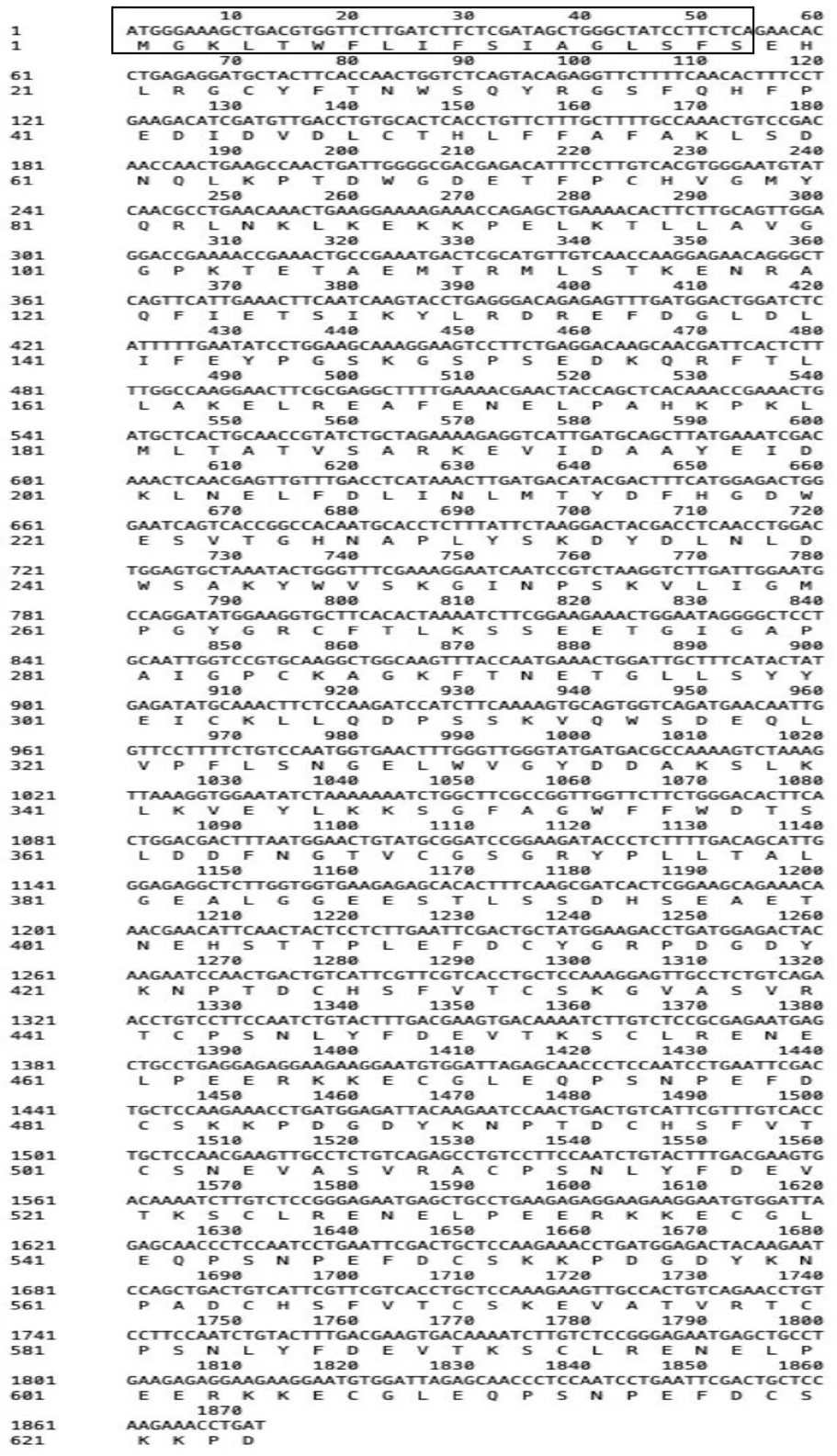
图1 水蛭chitotriosidase-1-like蛋白质开放阅读框及其氨基酸序列Fig. 1 Open Reading Frame of chitotriosidase-1-like protein in Hirudo nipponica and its amino acid sequence
2.3 chitotriosidase-1-like基因编码蛋白理化性质分析
除去chitotriosidase-1-like蛋白质信号肽后,成熟chitotriosidase-1-like蛋白氨基酸序列蛋白质分子式为C3028H4627N795O962S32,原子总数为9 444,相对分子质量为68.585 KD,理论等电点(pI)为4.96,该蛋白含有73个碱性氨基酸(Arg + Lys),含有103个酸性氨基酸(Asp + Glu),谷氨酸(Glu)含量最多,含有60个,占9.9%,其次是亮氨酸(Leu),含有58个,占9.6%。脂肪酸系数为61.47,不稳定指数为36.24,属于稳定蛋白。成熟chitotriosidase-1-like蛋白中第33个氨基酸(Arg)处疏水性最强,最高值为1.822,第469个氨基酸(Cys)和第538个氨基酸(Cys)处亲水性最强,最低值为-2.833,亲水性(GRAVY)总平均值为-0.694,属于亲水蛋白(图2A)。成熟的chitotriosidase-1-like蛋白无跨膜结构域,不属于跨膜蛋白(图2B)。该蛋白含有多个磷酸化位点,分别为丝氨酸(Ser)31个,苏氨酸(Thr)20个,酪氨酸(Tyr)5个(图2C)。通过保守结构域分析,该蛋白属于GH18超级家族(图2D)。
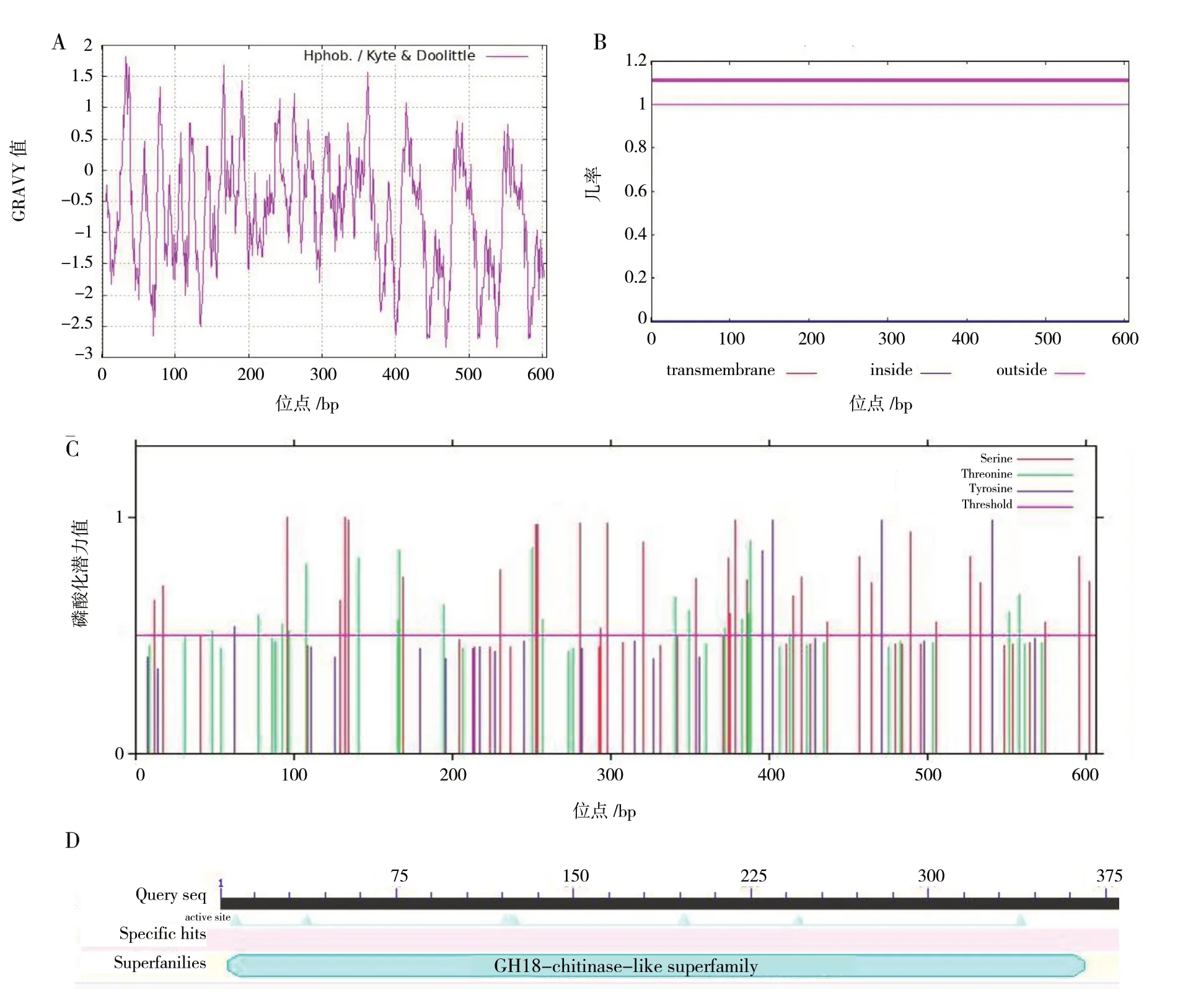
图2 水蛭chitotriosidase-1-like蛋白理化性质分析Fig. 2 Physical and chemical properties of chitotriosidase-1-like protein in Hirudo nipponica
2.4 重组质粒pEt-32a-chitotriosidase-1-like的获得
对重组质粒pEt-32a-chitotriosidase-1-like进行测序验证,测序结果与预期序列一致。此外,为了进一步验证重组质粒pEt-32a-chitotriosidase-1-like的准确性,将重组质粒进行BamH I和Xho I双酶切,见图3。酶切出2条带,一条与pEt-32a质粒大小一致,另一条与目的片段大小一致,以上结果表明,成功获得了重组质粒pEt-32a-chitotriosidase-1-like。
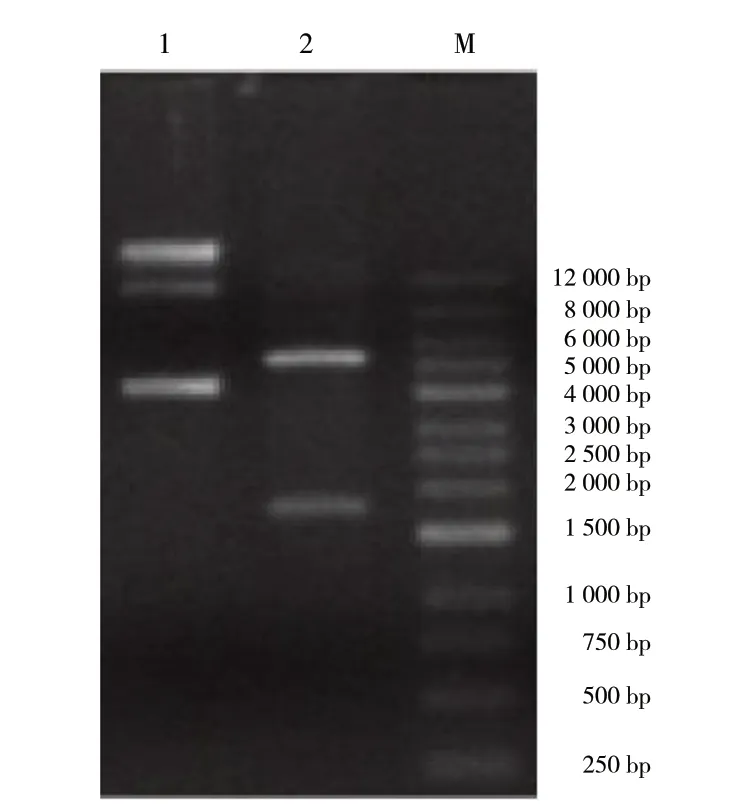
图3 重组质粒双酶切鉴定Fig. 3 Identification of double digestion of recombinant plasmid
2.5 chitotriosidase-1-like基因重组载体的诱导表达
重组菌株表达后收集菌体并进行破碎裂解,以未诱导的菌体作为对照,对诱导后的菌体、诱导破碎后上清、诱导破碎后沉淀进行12% SDS-PAGE分析,该蛋白大小理论分子量为69.46 KD左右,从图4中可以看到,诱导后的菌体及破碎后沉淀中均能看到目的条带,目标蛋白主要存在于诱导破碎后的沉淀中。
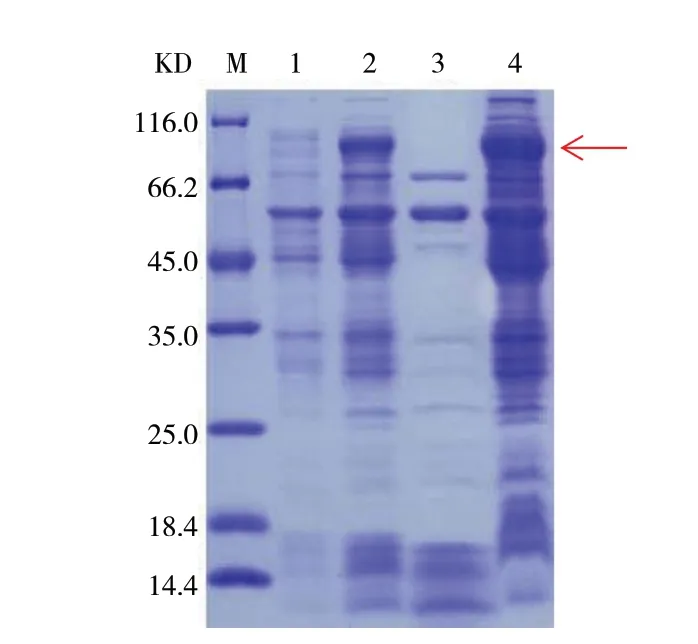
图4 蛋白表达鉴定SDS-PAGE分析Fig. 4 SDS-PAGE for identification of protein expression
2.6 包涵体蛋白变复性和纯化
通过12% SDS-PAGE分析,在洗脱液中得到目的蛋白,见图5。
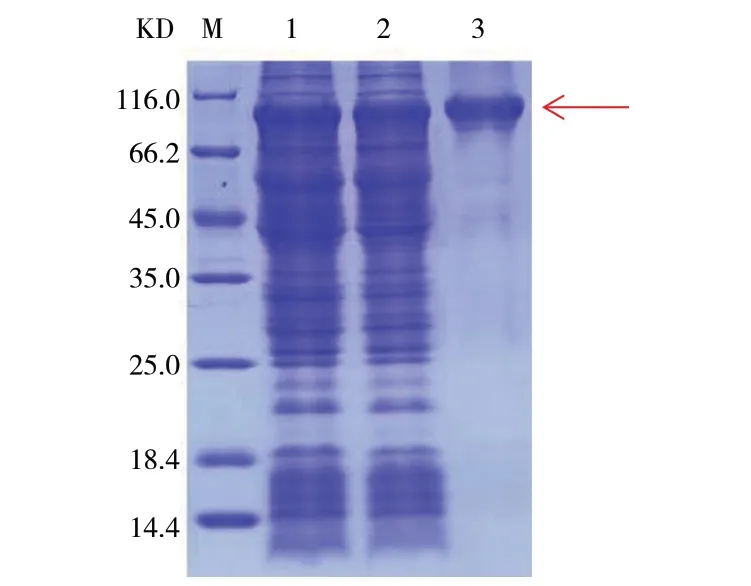
图5 蛋白纯化SDS-PAGE分析Fig. 5 SDS-PAGE for identification of protein purification
2.7 chitotriosidase-1-like基因的抗菌活性
利用BCA蛋白浓度测定试剂盒测得原核表达收集得到的重组蛋白浓度为0.3 mg/mL,在该浓度下,重组蛋白对金黄色葡萄球菌具有抑菌效果,抑菌圈直径为12 mm,对大肠杆菌、沙门氏菌无抑菌效果,结果见表2。

表2 chitotriosidase-1-like重组蛋白对不同细菌的抗菌活性Tab. 2 Anti-microbial activity against different bacterial of recombinant protein chitotriosidase-1-like
2.8 不同摄食期chitotriosidase-1-like基因的表达规律
利用实时荧光定量PCR检测chitotriosidase-1-like基因的相对表达量,从图6中可以看到,在摄食血餐时,chitotriosidase-1-like基因在水蛭唾液腺中的表达量很低,在摄食1 d后,chitotriosidase-1-like基因在水蛭唾液腺中的表达量陡然增高且达到最大,之后在未进食的情况下鲜有表达。
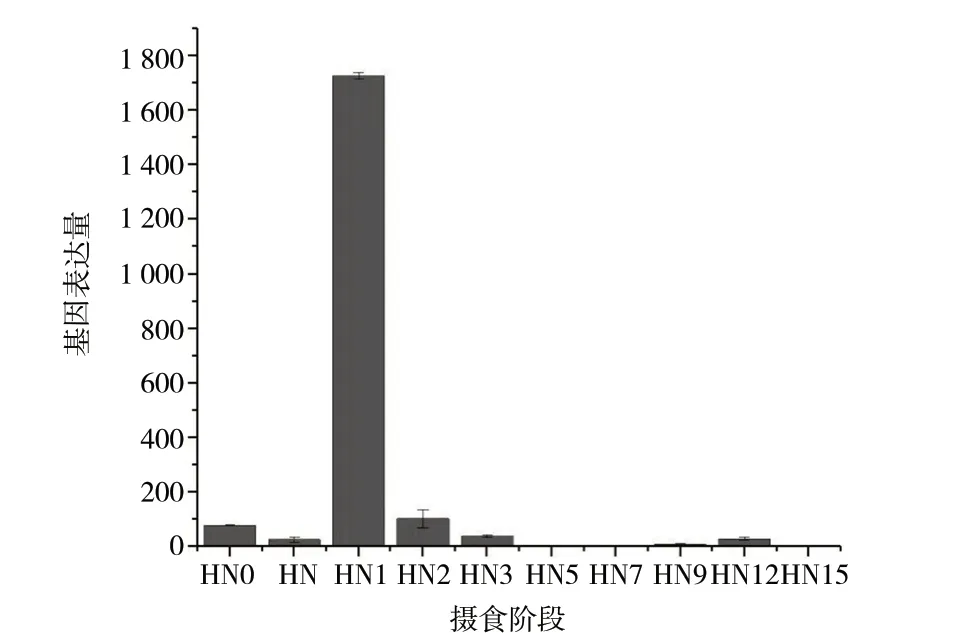
注:HN0. 未摄食;HN. 摄食中;HN1. 摄食后1 d;HN2. 摄食后2 d;HN3. 摄食后3 d;HN5. 摄食后5 d;HN7. 摄食后7 d;HN9. 摄食后9 d ;HN12. 摄食后12 d;HN15. 摄食后15 d。
3 讨论
抗菌肽(AMPS)是生物机体产生的一种具有自我防御功能的多肽[20]。上世纪80年代,科学家从天蚕蛹体内分离得到一种具有抗菌活性的小分子多肽,并将这种具有抑菌活性的小分子多肽命名为天蚕素(Cecropins)。次年,其氨基酸序列被公布,这是历史上首次发现抗菌肽[21]。截至2021年7月,ADP3数据库(http://aps.unmc.edu/AP/)中收录的已知编码抗菌肽或预测的抗菌肽基因序列已达7 000多个。其广泛分布于动物[22]、植物[23]、微生物[24]中。抗菌肽主要通过损伤细胞膜[25-26]、细胞内抑制[27-28]等机理发挥抑菌作用,尤其对一些耐药性细菌具有较好的抑菌活性[29]。正是因为具备稳定的抗菌活性、绿色、无公害等优点,抗菌肽被广泛地应用于医学、畜牧业及食品工业等方面[30-32],具有较大的应用价值。一直以来,对水蛭的研究主要集中在溶血栓、抗凝血方面。水蛭作为一种吸血蛭类,靠吸食动物的新鲜血液为生,且饱食一次血液,可维持长达1年的生命活动[2]。因此推测其在摄食、储食过程会分泌抗菌活性蛋白,抵御外源性病原微生物入侵,以便于其顺利摄食和长久储食。随着研究的深入,一些新的抗菌活性蛋白也从水蛭中提取分离出来并获得其氨基酸序列,将其命 名 为Theromacin、Theromyzin、Neuromacin[33-34]、Grafskaia等[35],从水蛭体内分离鉴定得到6种抗菌肽,对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌具有抑制作用。本研究通过水蛭唾液腺转录组筛选1条可能具有抑菌活性的转录本序列,通过原核表达得到重组蛋白,对重组蛋白进行体外抑菌活性测定,发现其对金黄色葡萄球菌具有抑制作用,根据抑菌圈大小判定,金黄色葡萄球菌对重组蛋白中度敏感。
生物在新陈代谢的过程中,由于功能需求不同,某一特定基因的表达严格按特定的时间顺序发生,即基因的表达在时间维度上具有特异性。研究基因表达的时间特异性,分析某一基因在特定时间顺序内的表达规律,对阐述该基因的功能和作用机制具有重要意义。食物信号作为一种外源信号,对基因表达量的高低具有非常重要的调控作用。有研究表明,从埃及伊蚊唾液腺中分离得到的LTRIN蛋白,在埃及伊蚊摄食时,可通过影响 NF-κB转录因子信号通路和抑制炎症因子的产生,从而增加寨卡病毒(Zika virus)传播性和致病性的作用,且在吸血过后,埃及伊蚊唾液腺内LTRIN基因表达量显著上调[36]。DING A D等[37]研究水蛭摄食不同阶段Hmc基因表达规律时发现,Hmc基因的表达量在摄食前最低,在摄食时,Hmc基因的表达量出现上调,并在摄食结束后24 h其表达量达到最大值,明显高于其它阶段,说明该基因对水蛭摄食功能具有重要影响。一般情况下,动物体内会储藏相关功能蛋白,当摄食时分泌出来,摄食结束后,通过基因高表达翻译蛋白后储存在体内,蛋白含量达到摄食前水平,以便在下次进食时发挥功能作用。本研究结果表明,水蛭摄食前和摄食中,chitotriosidase-1-like基因表达较少,在摄食后1 d,chitotriosidase-1-like基因在水蛭唾液腺中的表达量明显上升且达到最大,之后在未进食的情况下鲜有表达,说明血餐能刺激和诱导chitotriosidase-1-like基因的表达,摄食后1 d,chitotriosidase-1-like基因会大量表达蛋白储存在水蛭唾液腺内,以便为水蛭下一次摄食做准备。
4 结论
本研究证实了chitotriosidase-1-like基因主要与水蛭摄食功能相关,在水蛭摄食时,chitotriosidase-1-like基因表达的蛋白会大量释放,抵御血液中外源病原体入侵,以便于水蛭能顺利进食和长久储食,摄食结束后chitotriosidase-1-like基因会大量表达蛋白储存于水蛭体内,为水蛭下一次摄食做准备。本研究结果对后期深入研究chitotriosidase-1-like基因生物学功能及水蛭摄食、储食机理奠定了基础,对水蛭中药材的多元化开发和利用具有重要意义。

