右美托咪定对重型颅脑损伤患者围术期脑氧代谢的影响及脑保护作用研究
杨俊杰
(河南省开封市人民医院神经外科 开封 475000)
重型颅脑损伤属典型的神经外科急危重症,发病率占全部颅脑损伤的20%左右,具有病情进展急骤、致死率高、致残率高等特点[1]。患者常伴有不同程度的意识障碍、谵妄、疼痛等,若未及时治疗可引发继发性脑水肿、脑出血等。理想的颅脑手术脑保护药物应能有效保护颅脑调节功能,维持脑氧供需与能量代谢稳定,保持血流动力学稳定等[2~3]。目前,临床多采取体位转换、过度通气、术中维持亚低温等措施,但脑保护作用不理想。右美托咪定属于一种高选择性α2受体激动药物,可通过抑制大脑缺氧缺血性脑损伤、调节脑氧代谢、减少脑氧摄取率等诸多机制,来发挥保护神经功能,促进认知功能恢复,减少麻醉并发症的作用[4~5]。但目前关于右美托咪定在重型颅脑损伤围术期脑保护中的应用尚缺乏充足的循证依据。基于此,本研究探讨右美托咪定对重型颅脑损伤患者围术期脑氧代谢、脑保护的作用。现报道如下:
1 资料与方法
1.1 一般资料 按随机对照原则将2020年6月至2022年1月于开封市人民医院接受手术治疗的重型颅脑损伤患者80例分为两组。对照组40例,男24例,女16例;年龄24~69岁,平均(47.52±6.34)岁;受伤至就诊时间0.4~3.0 h,平均(1.64±0.27)h;受伤原因,坠落伤10例,交通伤27例,打击伤3例;血肿类型,脑内血肿6例,硬膜下血肿13例,硬膜外血肿21例。研究组40例,男25例,女15例;年龄22~75岁,平均(48.62±5.72)岁;受伤至就诊时间0.2~3.0 h,平均(1.96±0.38)h;受伤原因,坠落伤12例,交通伤24例,打击伤4例;血肿类型,脑内血肿5例,硬膜下血肿15例,硬膜外血肿20例。两组上述资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经开封市人民医院医学伦理委员会批准(批准文号:开封市人民医院伦理字201900320号)。
1.2 纳入与排除标准(1)纳入标准。符合重型颅脑损伤诊断标准[6],并经头颅MRI或CT等影像学检查确诊;格拉斯哥昏迷评分(GCS)3~8分;有明确手术指征;受伤至就诊时间不超过3 h;患者家属自愿签署知情同意书。(2)排除标准。凝血功能障碍或伴有血液系统疾病;既往有神经系统障碍或损伤;既往有脑血管疾病、脑肿瘤;重要脏器功能受损;伴有呼吸衰竭、心力衰竭、休克等;脑死亡或脑疝晚期;入院1周内死亡。
1.3 麻醉方法 患者入室后建立静脉通道,常规心电监测,吸氧。麻醉诱导前,研究组经静脉输液泵注0.8μg/kg右美托咪定(国药准字H20183219),后持续静脉泵注0.2μg/(kg·h)维持至术毕24 h。对照组经静脉输液泵注等剂量的0.9%氯化钠注射液。麻醉诱导:依次注射咪达唑仑注射液(国药准字H10980025)0.05~0.20 mg/kg、依托咪酯(国药准字H32022379)0.3 mg/kg、芬 太 尼(国 药 准 字H20123297)10μg/kg、顺苯磺酸阿曲库铵(国药准字H20133373)0.2 mg/kg。气管插管,调节呼吸参数,控制呼吸频率为10~12次/min,潮气量为8~10 ml/kg,吸呼比为1:2,呼气末二氧化碳分压为30~35 mm Hg。麻醉维持:静脉泵注瑞芬太尼(国药准字H20123421),0.1~0.4μg/(kg·h),间断静脉输注顺苯磺酸阿曲库铵0.05 mg/kg、舒芬太尼(国药准字H20203650)5~10μg,维持BIS在40~60范围内。
1.4 观察指标 (1)记录两组瑞芬太尼用量、丙泊酚用量、舒芬太尼用量、拔管时间与苏醒时间。(2)脑氧代谢。采集患者入室后5 min(T0)、切皮时(T1)、术毕(T2)、术后12 h(T3)4个时间点的桡动脉血及颈内静脉球部血,采用全自动血气分析仪测定颈静脉氧饱和度(SjvO2)、动脉血氧分压(PaO2)、颈内静脉血氧分压(PjvO2),脑动静脉氧含量差(AVDO2)=Hb×1.34×(SaO2-SjvO2)+0.03×(PaO2-PjvO2),通过cas-med fore-sight脑氧饱和度监测仪(CAS Medical Systems)测定局部脑氧饱和度(rScO2)。(3)神经损伤标志物。采集T0~T3时患者颈静脉球部血3 ml,通过免疫夹心双抗体酶联免疫吸附法测定血浆神经元特异性烯醇化酶(NSE)、中枢神经特异蛋白(S100-β)水平。(4)不良反应发生情况,包括皮肤瘙痒、胃肠道反应、低血压、嗜睡等。
1.5 统计学方法 采用SPSS23.0统计学软件分析数据。麻醉相关药物用量、苏醒质量、脑氧代谢、神经损伤标志物水平等计量资料以(±s)表示,行t检验,多时间点的比较采用重复测量设计的方差分析;计数资料用%表示,行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组麻醉相关药物用量及苏醒质量对比 研究组瑞芬太尼用量、丙泊酚用量低于对照组,拔管时间、苏醒时间短于对照组(P<0.05)。见表1。
表1 两组麻醉相关药物用量及苏醒质量对比(±s)
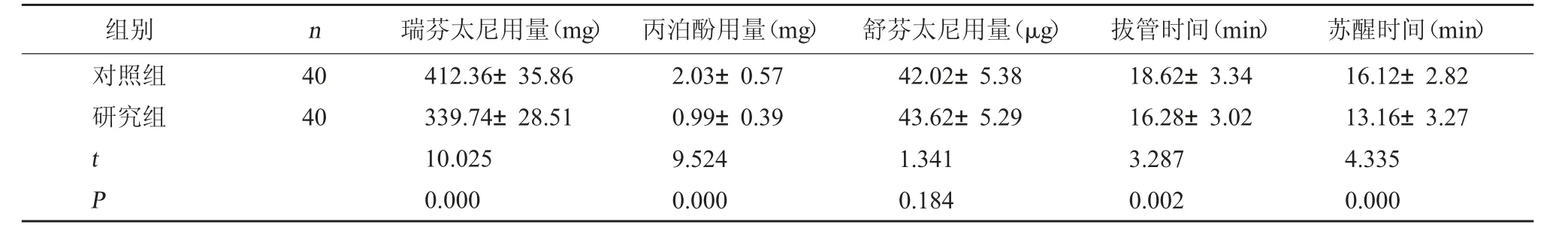
表1 两组麻醉相关药物用量及苏醒质量对比(±s)
组别 n 瑞芬太尼用量(mg) 丙泊酚用量(mg) 舒芬太尼用量(μg) 拔管时间(min) 苏醒时间(min)对照组研究组40 40 t P 412.36±35.86 339.74±28.51 10.025 0.000 2.03±0.57 0.99±0.39 9.524 0.000 42.02±5.38 43.62±5.29 1.341 0.184 18.62±3.34 16.28±3.02 3.287 0.002 16.12±2.82 13.16±3.27 4.335 0.000
2.2 两组脑氧代谢指标对比 研究组患者在T1、T2时rScO2、SjvO2水平均高于对照组,AVDO2水平低于对照组,差异具有统计学意义(P<0.05)。见表2。
表2 两组脑氧代谢指标对比(±s)
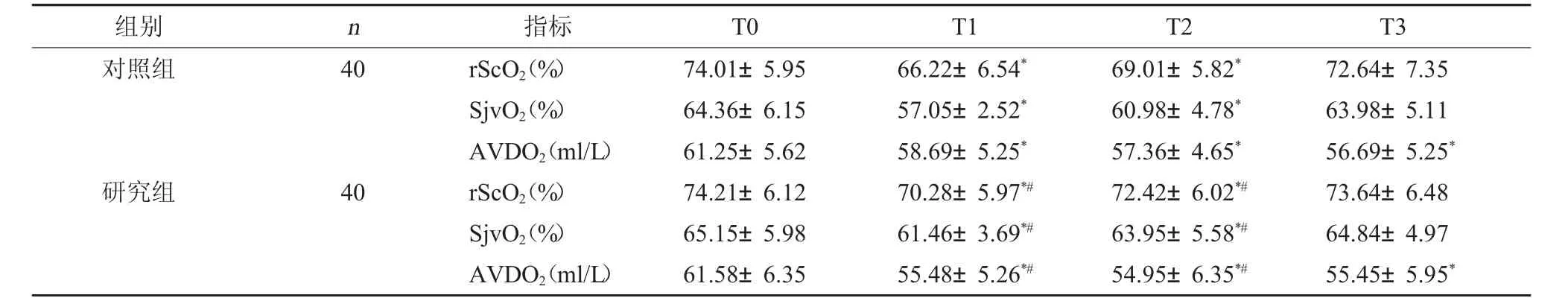
表2 两组脑氧代谢指标对比(±s)
注:与本组T0时相比,*P<0.05;与同时间对照组相比,#P<0.05。
组别 n 指标 T0 T1 T2 T3对照组40研究组40 rScO2(%)SjvO2(%)AVDO2(ml/L)rScO2(%)SjvO2(%)AVDO2(ml/L)74.01±5.95 64.36±6.15 61.25±5.62 74.21±6.12 65.15±5.98 61.58±6.35 66.22±6.54*57.05±2.52*58.69±5.25*70.28±5.97*#61.46±3.69*#55.48±5.26*#69.01±5.82*60.98±4.78*57.36±4.65*72.42±6.02*#63.95±5.58*#54.95±6.35*#72.64±7.35 63.98±5.11 56.69±5.25*73.64±6.48 64.84±4.97 55.45±5.95*
2.3 两组神经损伤标志物水平对比 两组T0时NSE、S100-β水平比较无显著差异(P>0.05)。研究组T1、T2、T3时NSE、S100-β水平低于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 两组神经损伤标志物水平对比(μg/L,±s)
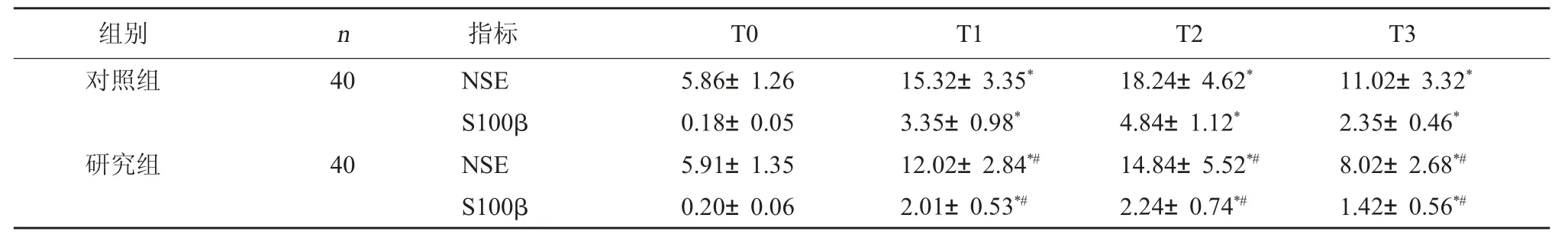
表3 两组神经损伤标志物水平对比(μg/L,±s)
注:与本组T0时相比,*P<0.05;与同时间对照组相比,#P<0.05。
组别 n 指标 T0 T1 T2 T3对照组40研究组40 NSE S100β NSE S100β 5.86±1.26 0.18±0.05 5.91±1.35 0.20±0.06 15.32±3.35*3.35±0.98*12.02±2.84*#2.01±0.53*#18.24±4.62*4.84±1.12*14.84±5.52*#2.24±0.74*#11.02±3.32*2.35±0.46*8.02±2.68*#1.42±0.56*#
2.4 两组不良反应发生情况对比 研究组麻醉不良反应发生率12.50%,与对照组的7.50%相比,差异无统计学意义(P>0.05)。见表4。
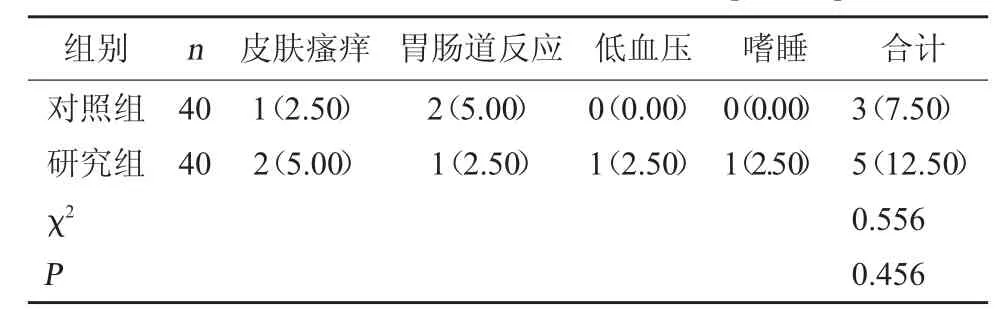
表4 两组麻醉不良反应发生情况对比[例(%)]
3 讨论
目前,重型颅脑损伤临床多采用手术治疗,迅速清除颅脑组织受压状态、清除血肿与失活脑组织是手术治疗的关键。但由于大部分颅脑损伤患者存在组织坏死、炎症反应、脑细胞与组织缺氧缺血等病理生理性改变,多伴有不同程度的中枢神经功能受损与缺氧缺血性脑损伤,而术中麻醉、机械性操作等会进一步加剧脑损伤,影响患者预后[7~8]。因此,如何采用药物进行脑保护,以维持正常脑功能、减轻脑损伤程度是临床亟待解决的问题。
NSE是神经元损伤的典型标志物,由神经细胞与神经内分泌细胞分泌,当脑组织处于缺氧缺血状态时会导致神经元出现变性、坏死,破坏血脑屏障,致使NSE含量增高[9~10]。作为神经胶质细胞中之一,S100β多表达于星形胶质细胞中,可间接反映继发性脑损伤程度与原发性脑损伤程度。本研究中,研究组T1、T2、T3时NSE、S100β水平低于对照组,由此可见右美托咪定可保护脑功能,减轻脑损伤。究其原因,右美托咪定可通过调节低氧诱导因子-1α和血管内皮生长因子表达,而间接促进缺血再灌注损伤的神经细胞快速修复。此外,右美托咪定的脑保护作用机制还与抑制炎症反应、降低应激反应、减少兴奋性氨基酸释放等有关[11~13]。本研究中,研究组瑞芬太尼用量、丙泊酚用量低于对照组,拔管时间、苏醒时间短于对照组,两组麻醉不良反应未见显著性差异,可见麻醉诱导前泵注右美托咪定可提高患者苏醒质量,减少相关麻醉用药剂量,且安全性高。
重型颅脑损伤术中各项操作会导致患者大脑处于暂时性缺血、缺氧状况,引起脑氧代谢异常。加之术后持续性炎症应激反应的刺激,会释放大量炎性因子,进一步加重交感神经兴奋,损伤脑细胞间信息交换能力,从而导致脑细胞缺氧缺血、脑微循环障碍的发生。因此,在脑组织保护中,保持脑氧代谢平衡与稳定具有重要意义。rScO2、SjvO2是常见的脑氧代谢监测指标,前者可反映局部脑组织氧供需平衡,而后者多用于评估全脑的氧耗及脑血流间平衡状态[14~15]。AVDO2可直接反映脑组织消耗、摄取能力,若指标降低可能预示着脑组织摄取量与脑氧代谢率降低[16]。本研究中,两组患者T1、T2时的SjvO2、rScO2、AVDO2比T0低,但研究组T1、T2时rScO2、SjvO2均比对照组高,AVDO2比对照组低,表明重型颅脑损伤患者可能存在脑血流低灌注、脑氧供需失衡现象,而麻醉诱导前泵注右美托咪定可改善重型颅脑损伤患者围术期脑氧代谢,增加氧供,降低大脑氧耗。推测原因可能在于右美托咪定可一定程度上抑制交感神经兴奋性,降低脑血流量与细胞耗氧量,进而缓解脑细胞氧化状态;同时,右美托咪定可通过促进抗炎因子释放、抑制炎症因子分泌等途径来降低炎症反应,减轻脑内过度炎症反应与脑损伤;此外,右美托咪定可高选择性作用于α2-AR受体,调节儿茶酚胺释放,抑制交感神经兴奋与中枢神经蓝斑核神经元放电,减轻脑氧消耗。综上所述,麻醉诱导前泵注右美托咪定可减少重型颅脑损伤患者围术期麻醉药物用量,提高苏醒质量,改善脑氧代谢,保护脑功能,且不会明显增加不良反应。

