扇贝加工副产物中蛋白质提取及其酶解物抗氧化活性分析
郭 宇 文诗雨 倪 策 欧晓晖 屈婷敏 吴 颖 贺舒雯 李虹辉 崔 波 程云辉, 文 李
(1. 长沙理工大学食品与生物工程学院,湖南 长沙 410000;2. 中国科学院大学生命科学学院,北京 101408;3. 齐鲁工业大学〔山东省科学院〕食品科学与工程学院,山东 济南 250353)
近年来,中国水产品产量激增,加工副产物亦增多,但因其组成成分多、处理困难等,只有少部分能用作养殖饲料,绝大部分被丢弃处理,造成大量优质资源浪费。海湾扇贝(Argopectenirradians)是一种高蛋白、低脂、食用价值高的海鲜产品[1],其加工副产物富含蛋白质,有研究[2]尝试将其加工副产物应用到食品、保健品等领域,这对扇贝加工副产物的深入研究具有重要的应用价值[3]。
氧化应激是指体内活性氧自由基快速积累,但清除防御系统不能及时清除而导致的机体受损[4]。生物活性肽是蛋白质中天然氨基酸以不同组成和排列方式构成的不同肽类的总称,是源于蛋白质的多功能活性因子[5]。其中抗氧化多肽可消除体内多余的氧自由基,减轻自由基对机体的损伤,因而可用于治疗由自由基积累引发的疾病[6]。由于人工合成抗氧化肽的安全性仍受到广泛质疑,因而食源性抗氧化肽备受青睐[7]。从天然食物中获得氧自由基清除剂或抗氧化剂,是未来预防氧化应激潜在的有效治疗策略。而利用天然植物或动物加工副产物蛋白来制备生物活性肽,既可以避免蛋白质资源的浪费,又可以开发出新型的天然抗氧化剂[8-9]。
研究拟利用碱提酸沉法、碱提硫酸铵沉法和低温乙醇变性沉淀法,从扇贝加工副产物中提取扇贝蛋白。采用胃蛋白酶、中性蛋白酶、碱性蛋白酶和风味蛋白酶对副产物中蛋白质进行酶解,并分析酶解产物的抗氧化活性,以期更好地为扇贝加工副产物的高值化利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
扇贝加工副产物:烟台东宇海珍品有限公司;
碱性蛋白酶、中性蛋白酶、胃蛋白酶、风味蛋白酶:生物试剂,北京索莱宝科技有限公司;
十二烷基硫酸钠(SDS)、N,N,N,N-四甲基乙二胺(TEMED):纯度99%,上海麦克林生化科技有限公司;
1,1-二苯基-2-苦肼基自由基(DPPH):纯度97%,上海麦克林生化科技有限公司;
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):纯度98%,嘉兴思诚化工有限公司;
谷胱甘肽(GSH):纯度≥98%,北京酷来搏科技有限公司;
其他化学试剂:分析纯,中国医药集团有限公司。
1.1.2 主要仪器设备
电热恒温鼓风干燥箱:DHG-9246A型,太仓精宏实验设备有限公司;
超级水浴:HH-601型,常州金坛良友仪器有限公司;
电子天平:AX224ZH型,奥豪斯仪器(常州)有限公司;
冷冻干燥机:LGJ-25C型,四环福瑞科仪科技发展有限公司;
电泳仪:DYY-6C型,北京市六一仪器厂;
磁力搅拌器:8S-1型,常州国字仪器制造有限公司;
快速混匀器:XH-C型,金坛市医疗仪器厂;
脱色摇床:TS-1000型,海门市其林贝尔仪器制造有限公司;
台式高速冷冻离心机:TGL-16M型,湘仪离心机有限公司;
分光光度计:岛津UV1800型,岛津国际贸易(上海)有限公司;
超微弱发光测量仪:BPCL-1-TGC型,广州微光科技有限公司;
高效液相色谱系统:Waters e2695型,泰灵佳科技有限公司;
重金属消解仪:SH230N型,济南海能仪器有限公司。
1.2 方法
1.2.1 扇贝加工副产物蛋白提取 采用低温乙醇变性沉淀法、碱提酸沉法和碱提硫酸铵沉淀法3种方法进行蛋白质的提取,并利用凯氏定氮法进行纯度对比。
(1) 低温乙醇变性沉淀法:在胡昂等[10]方法的基础上优化。将扇贝加工副产物洗净,冻干48 h后,用研钵研磨2 h磨成粉末。将扇贝副产物粉和95%乙醇分别置于4 ℃冰箱预冷4 h,按m扇贝副产物粉∶V乙醇=1∶10 (g/mL) 的物料比将95%乙醇加入扇贝副产物粉中,调节pH值至7.0,置于4 ℃冰箱反应24 h。将混合液于5 000 r/min下离心20 min,收集沉淀,并按1∶2 (g/mL)的物料比加入95%乙醇,再次置于4 ℃冰箱反应24 h。取出混合液在上述条件下离心,收集沉淀于-20 ℃冰箱冻存。
(2) 碱提酸沉法:在李丽等[11]方法的基础上优化。将扇贝副产物粉与0.1 mol/L NaOH按m扇贝副产物粉∶VNaOH=1∶30 (g/mL)的物料比混合,搅拌均匀,并调节pH值至12,超声处理30 min。将混合液置于40 ℃水浴锅中搅拌9 h,8 000 r/min离心15 min,收集上清。用1.0 mol/L HCl调节pH值至4.4,8 000 r/min离心15 min,收集沉淀于-20 ℃冰箱冻存。
(3) 碱提硫酸铵沉淀法:在刘泰标等[12]方法的基础上优化。将扇贝副产物粉与0.1 mol/L NaOH按m扇贝副产物粉∶VNaOH=1∶40 (g/mL)的物料比混合,搅拌均匀,并超声处理30 min,置于30 ℃水浴锅中反应11 h。于4 ℃,10 000 r/min离心10 min,收集上清。加入过饱和硫酸铵,置于4 ℃冰箱中过夜。于上述条件下离心,取沉淀,袋透析48 h后收集透析液,置于-20 ℃冰箱中冻存。
将以上3种方法提取的蛋白质置于提前预冻1 h的真空冷冻干燥机中-60 ℃冻干48 h,得到固体粉末,分别密封保存。
1.2.2 扇贝加工副产物蛋白含量分析 按GB/T 6432—2018执行。
1.2.3 SDS-PAGE凝胶电泳 根据O'Sullivan等[13]的方法,修改如下:浓缩胶和分离胶含量分别为5%和12%,上样体积为20 μL。20 mA恒流进样15 min,40 mA恒流电泳至溴酚蓝指示剂距离凝胶底部1 cm。
1.2.4 酶解物的制备 称取碱提硫酸铵沉淀法制备的扇贝蛋白1.500 0 g,按料液比m扇贝蛋白∶V去离子水=1∶50 (g/mL) 加入去离子水,水化2 h。按表1分别加入4种酶进行酶解,酶解时加入0.1 mol/L HCl或NaOH使pH值稳定在设定值,并记录所消耗的酸碱体积,计算水解度(DH)。酶解结束后,将酶解产物置于99 ℃灭活8 min。冷却后,10 000 r/min离心15 min,取上清液冻干(-60 ℃,48 h)。上述试验均设置3个平行试验。
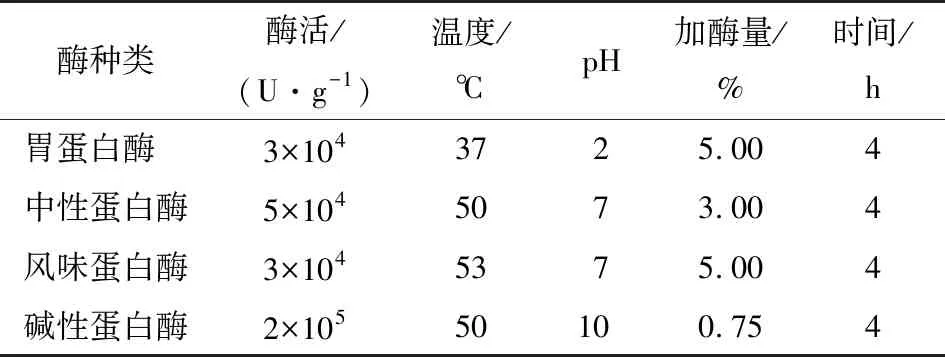
表1 不同蛋白酶的反应条件
1.2.5 酶解物的抗氧化活性检测
(1) DPPH自由基清除率:根据GB/T 39100—2020。取3支试管,按表2添加试剂。
1号管为试验组(As),2号管为对照组(Ac),3号管为空白组(Ab),混匀后避光反应30 min,517 nm下检测吸光值。其中,使用样品溶剂调零,谷胱甘肽作阳性对照,进行3次平行试验。按式(1)计算DPPH自由基清除率。
(1)
式中:
P——清除率,%;
As——待测溶液与DPPH溶液混合液的吸光度;
Ac——待测溶液与无水乙醇溶液混合液的吸光度;
Ab——DPPH溶液与样品溶剂溶液混合液的吸光度。
(2) ABTS自由基清除率:根据GB/T 39100—2020。取2支试管,按表3添加试剂。

表3 ABTS 试剂添加量
1号管为试验组(As),2号管为空白组(Ab),混匀后避光反应5 min,734 nm下检测吸光值。其中,使用样品溶剂调零,谷胱甘肽作阳性对照,进行3次平行试验。按式(2)计算ABTS自由基清除率。
(2)
式中:
P——清除率,%;
Ab——ABTS+溶液与样品溶剂溶液混合液的吸光度;
As——待测溶液与ABTS+溶液混合液的吸光度。
(3) 羟自由基清除率:利用紫外超微弱发光测量仪检测羟自由基清除能力[14]。用硼砂溶液润洗测量管,按表4 加入溶液。将混合液放入反应池,设置反应时间为900 s,每0.1 s测定一次发光强度,记录峰值,平行测定3次。以蒸馏水为空白对照,谷胱甘肽为阳性对照。
按式(3)计算羟自由基清除率。
(3)
式中:
P——清除率,%;
Lb——样品溶剂溶液混合液的发光强度;
Ls——待测溶液与样品溶剂溶液混合液的发光强度。

表4 羟自由基试剂添加量
(4) 还原能力:在Wang等[15]方法的基础上优化,将1 mL扇贝肽、2.5 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和2.5 mL 1.0 g/100 mL铁氰化钾溶液混合。50 ℃下反应25 min。混合物中加入0.5 mL 1.0 g/100 mL TCA,6 500 r/min 离心10 min。取2.5 mL上清液与2.5 mL 去离子水和0.5 mL 1.0 g/100 mL氯化铁溶液混合。反应10 min后,700 nm处测定吸光度。使用样品溶剂调零,谷胱甘肽做阳性对照。
1.2.6 中性酶解产物的分子量分布分析 采用高效凝胶过滤色谱法分析中性酶解产物的相对分子量分布[16]。以多孔性填料为固定相,依据酶解混合物中肽分子大小进行分离。在肽键的紫外吸收波长220 nm处检测吸光度,使用Empower软件对色谱图及其数据进行处理。通过计算肽的相对分子质量大小及分布范围,得出不同分子量大小的肽所占百分比。
1.2.7 中性酶解产物的氨基酸组分测定
(1) 氨基酸含量:利用盐酸将中性酶解产物彻底水解成游离氨基酸(色氨酸在酸水解过程中几乎完全被破坏,因此无法测定其含量),经过离子交换柱分离,分离产物与茚三酮溶液反应变色,通过可见光—分光光度检测器测定氨基酸含量[17]。
按式(4)计算样品测定液氨基酸含量。
(4)
式中:
Ci——扇贝肽液中氨基酸浓度,nmol/mL;
Ai——扇贝肽液中氨基酸的峰面积;
As——氨基酸标准液的峰面积;
Cs——氨基酸标准液浓度,nmol/mL。
按式(5)计算试样中各氨基酸含量。
(5)
式中:
Xi——扇贝肽氨基酸的含量,g/100 g;
F——稀释倍数;
V——定容体积, mL;
M——氨基酸摩尔质量,g/mol;
m——称样量,g。
(2) 羟脯氨酸含量:在105 ℃下用硫酸水解扇贝肽,水解结束后过滤并稀释。羟脯氨酸与氯胺T发生反应后,一定条件下可以与对二甲基氨基苯醛生成红色产物,在550 nm处有最大吸收值[18]。按式(6)计算羟脯氨酸含量。
(6)
式中:
X——扇贝肽中羟脯氨酸含量,%;
C——利用标准方程计算得出扇贝肽液中羟脯氨酸质量浓度,μg/mL;
m——扇贝肽的质量,g;
v——在250 mL容量瓶中吸取的滤液体积,mL。
1.2.8 统计分析 用SPSS 23.0软件进行统计分析,设置最小显著水平为0.05,进行分析及差异显著性检验。对不同处理数据进行Duncan多重比较,数据以平均值±标准差表示。
2 结果与分析
2.1 蛋白分析
2.1.1 蛋白质含量 如图1所示,3种方法所提蛋白含量均超过80%。李丽等[11]利用碱提酸沉法提取扇贝蛋白,蛋白含量为77.97%;在此法基础上进行优化,提取过程中增加超声波处理,并将酸沉的pH值由4.1提高到4.4,增加了蛋白质的沉淀量,因而所提取蛋白含量有所提高,达82.95%。刘泰标等[12]利用碱提硫酸铵沉法从牡蛎中提取含硒蛋白质,含硒蛋白量为44.90%;对该提取方法进行优化,增加超声波处理并将碱提的时间由9 h延长至11 h,获得扇贝蛋白含量达(91.16±1.36)%。经比较,优化后的碱提硫酸铵沉淀法最适合从扇贝副产物中提取蛋白质。

字母不同表示差异显(P<0.05)图1 3种提取方法所获蛋白含量
2.1.2 SDS-PAGE分析 如图2所示,乙醇变性法所提取的蛋白降解严重,而碱提酸沉法只能提取部分蛋白质,无法获得全蛋白。碱提硫酸铵沉法所提取的蛋白质分子量分布最广,电泳分离条带清晰,说明提取过程中蛋白质未被降解且杂质干扰少。
综合蛋白提取纯度和电泳条带效果,对碱提硫酸铵沉法所提蛋白进行酶解。

M. 分子量标记 1. 乙醇变性沉淀法 2. 碱提硫酸铵沉法3. 碱提酸沉法图2 不同提取方法所获蛋白质SDS-PAFGE电泳图谱
2.2 4种酶酶解物的抗氧化活性
2.2.1 DPPH自由基清除率 如图3所示,阳性对照谷胱甘肽对DPPH自由基的清除率为(95.67±0.09)%;4种扇贝肽中,中性蛋白酶酶解产物的DPPH自由基清除率最高,为(29.20±0.73)%。
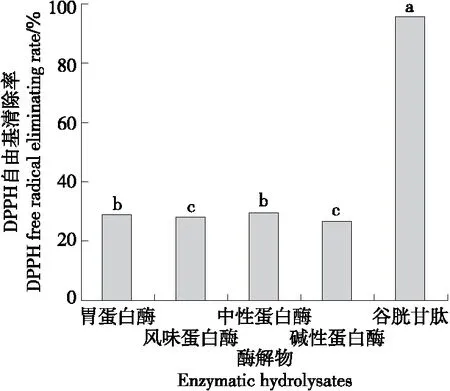
字母不同表示差异显著(P<0.05)图3 4种酶解产物的DPPH自由基清除率
2.2.2 ABTS自由基清除率 如图4所示,酶解物和谷胱甘肽浓度相同,谷胱甘肽的ABTS自由基清除率高达(99.80±0.01)%,而样品中清除力最强的是碱性蛋白酶酶解物,清除率为(69.75±0.79)%,其次是中性蛋白酶酶解物和风味蛋白酶酶解物;而胃蛋白酶对ABTS自由基清除率最低。Wang等[4]在分析不同酶解产物的抗氧化活性时也发现碱性蛋白酶酶解物的ABTS自由基清除率最高,不过清除率仅为40%。研究中,除胃蛋白酶酶解产物外,所获得的其他3种酶解产物的ABTS自由基清除率均高于50%,具有较强的抗氧化能力。
比较图3和图4,研究制备的4种扇贝蛋白酶酶解物对ABTS自由基的清除力整体高于对DPPH自由基的,说明从扇贝加工副产物中提取的蛋白质,经4种蛋白酶水解后,产生了更多有利于清除ABTS自由基的肽段。

字母不同表示差异显著(P<0.05)图4 4种酶解物的ABTS自由基清除率
2.2.3 羟自由基清除率 如图5所示,4种扇贝蛋白酶解物中,清除效果最佳的是中性蛋白酶酶解物和风味蛋白酶酶解物,二者无显著差异,清除率均超过80%,而碱性蛋白酶酶解物的清除率最低。

字母不同表示差异显著(P<0.05)图5 4种酶解物的羟自由基清除率
2.2.4 还原能力 如图6所示,4种酶解产物中,中性蛋白酶酶解物的还原能力最强。由于试验采用的扇贝蛋白酶解混合物,未对特定抗氧化肽进行纯化,产物中含有多个不同氨基酸序列的寡肽,因而其还原力低于纯肽——谷胱氨肽。

字母不同表示差异显著(P<0.05)图6 4种酶解物的还原能力Figure 6 Reduction capacity of four kinds of enzymatic hydrolysates (n=9)
中性蛋白酶酶解产物的抗氧化活性高于其他酶解物。为了解该酶解产物的营养特性,进一步对其氨基酸组分及羟脯氨酸含量进行分析。
2.3 中性蛋白酶水解产物分子量分布及氨基酸组分
2.3.1 分子量分布 如图7所示,根据出峰时间和峰面积,利用Empower软件处理中性蛋白酶水解物的分子量分布(表5)。扇贝肽相对分子量主要分布在200~5 000 Da,总占比达(95.17±1.49)%,说明中性蛋白酶对扇贝加工副产物的酶解较充分,可以获得大量的小分子肽产物。
2.3.2 氨基酸组分分析 如图8和表6所示,由中性蛋白酶制备的扇贝肽中含天冬氨酸等15种氨基酸,总量达84 g/100 g。研究制备的扇贝肽中含苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸6种必需氨基酸,含量为(10.61±0.30) g/100 g;且扇贝肽中潜在抗氧化氨基酸有Ala、Tyr、Pro 3种,含量达(14.78±0.32) g/100 g,具有很高的营养价值。

图7 中性蛋白酶水解产物分子量分布的HPLC图Figure 7 HPLC map of dispase hydrolysates

表5 中性蛋白酶水解产物分子量分布
2.3.3 羟脯氨酸含量 经测定,中性蛋白酶水解物的吸光度为0.41,羟脯氨酸含量为(11.82±0.09)%。Liu等[19]研究表明,胶原蛋白中含有较多羟脯氨酸,每天摄入胶原蛋白水解物可改变人体血液中肽的组成比例,并保持较高水平肽含量。羟脯氨酸是一种亚氨基酸,可使胶原肽衍生为低聚肽,对蛋白酶产生高抗性,防止被机体的蛋白酶水解。这类肽经口服至肠道吸收并进入血液过程中,能始终以肽形式存在。因此含羟脯氨酸的小分子肽能完整通过肠细胞中肽转运体系,进而吸收入血液,更稳定、高效地发挥肽的生物活性[20-21]。

图8 中性蛋白酶水解产物氨基酸分析色谱图Figure 8 Amino acid analysis chromatogram of dispase hydrolysates

表6 中性蛋白酶水解产物中氨基酸组分及其含量†
3 结论
利用优化的碱提硫酸铵沉法,在物料比(m扇贝副产物粉∶VNaOH)1∶40 (g/mL)、30 ℃沉淀11 h的条件下,从扇贝加工副产物中提取蛋白质,可获得纯度高达(91.16±1.36)%的蛋白质产物。不同酶解物对于不同自由基清除效果不同,但总体上利用中性蛋白酶制备的扇贝肽的DPPH自由基清除力、羟自由基清除力及还原能力更佳。对中性蛋白酶物的氨基酸组分分析结果表明,扇贝肽中富含多种氨基酸,包括6种人体必需氨基酸,且羟脯氨酸含量达(11.82±0.09)%,营养价值高。含羟脯氨酸的小分子肽在人体内可稳定高效地发挥其生物活性,这是今后将进一步探讨的课题。此外,借鉴Wen等[8]和Qu等[22]报道的生物信息学研究手段,有望筛选出潜在的特定氨基酸序列的扇贝源生物活性肽。

