凉粉草多糖提取、结构特征和生物活性研究
董 伟 马生健 郭俊先 罗 皓 陶美华
(1. 岭南师范学院生命科学与技术学院,广东 湛江 524048;2. 新疆农业大学机电工程学院,新疆 乌鲁木齐 830052)
凉粉草(MesonachinensisBenth.,MCB)又名仙草、仙人草、草馃、鲜草等[1],系唇形科凉粉草属一年生草本宿根型植物[2]。凉粉草具有清暑解渴、解毒利尿的功效,民间常用作夏天清凉饮料,富含多糖、酚类、黄酮等活性成分[3-7]。
凉粉草多糖(Mesonachinensispolysaccharide,MCP)具有抗氧化、抗糖尿病、免疫调节等功效,还有良好的热稳性和促凝性,在食品和制药工业中常被用作增稠剂、稳定剂、凝胶剂[8-9]。目前,提取多糖的方法主要有水提法、碱提法、微波提取和酶提取法等,但操作时间长、成本高、投入大。碱提醇沉法具有提取时间短、成本低、易操作等优点,常被用来提取植物多糖。研究拟以新鲜凉粉草为材料,采用响应面优化碱提醇沉法提取多糖,并探究多糖的结构特征及生物活性,为凉粉草多糖的开发应用提供依据。
1 材料与方法
1.1 材料与试剂
凉粉草:匍匐型,经岭南师范学院陈燕教授鉴定,其种苗繁殖技术由广东省热带植物工程技术开发中心建立,种植于岭南师范学院科研试验基地;
铁氰化钾、碳酸氢钠:分析纯,天津科密欧试剂有限公司;
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、牛血清蛋白:分析纯,福州飞净生物科技有限公司;
考马斯亮蓝G-250、苯酚、三氯化铁:分析纯,国药集团化学试剂有限公司;
抗坏血酸(VC):分析纯,西陇科学股份有限公司;
氯化钠、无水乙醇、浓硫酸、三氯乙酸等:分析纯,广州化学试剂厂。
1.2 仪器与设备
电磁炉:GLMS9300A型,广州红三角电器实业有限公司;
电子分析天平:FA2204型,宁波市鄞州华丰电子仪器厂;
多功能商用豆浆机:FY-1055,中山市巴博莎电器有限公司;
高速冷冻离心机:SORVALL RC6 plus型,德国赫默公司;
电热恒温干燥箱:DHG-9037A型,上海跃进医疗器械厂;
同步热分析仪:STA 6000型,美国PerkinElmer公司;
紫外可见分光光度计:UV-8453型,美国Agilent公司;
傅里叶变换红外光谱仪:Nicolet 6700型,美国Thermo Fisher Scientific公司;
扫描电子显微镜:VEGA3 SBH型;荷兰PHILIPS公司;
X射线衍射仪:X’pert Pro MPD型,荷兰PANalytical公司。
1.3 试验方法
1.3.1 凉粉草多糖提取流程
新鲜凉粉草样品→洗净备用→热水碱提→离心→醇沉→离心→干燥→凉粉草粗多糖
1.3.2 多糖提取率测定 采用苯酚—硫酸法,并按式(1)计算多糖提取率。
R=(c×V)/m×100%,
(1)
式中:
c——凉粉草多糖溶液质量浓度,mg/mL;
V——多糖溶液体积,mL;
m——凉粉草样品的质量,mg。
1.3.3 凉粉草多糖提取单因素试验
(1) 碳酸氢钠添加量:称取新鲜凉粉草100 g,热浸时间10 min,料液比1∶5 (g/mL),考察碳酸氢钠添加量(0.0%,0.4%,0.8%,1.2%,1.6%,2%,2.4%)对多糖提取率的影响。
(2) 热浸时间:称取新鲜凉粉草100 g,料液比1∶5 (g/mL),碳酸氢钠添加量1.6%,考察热浸时间(0,5,10,15,20 min)对多糖提取率的影响。
(3) 料液比:称取新鲜凉粉草100 g,热浸时间10 min,碳酸氢钠添加量1.6%,考察料液比[1∶3,1∶4,1∶5,1∶6,1∶7 (g/mL)]对多糖提取率的影响。
1.3.4 响应面试验 根据响应面中心复合设计原则,在单因素试验的基础上,采用Design-Expert 8.0.6软件进行数据分析。采用Box-Benhnken中心组合设计,进行三因素三水平试验,考察料液比、热浸时间和碳酸氢钠添加量对多糖提取的影响,优化提取工艺。
1.3.5 凉粉草多糖分离纯化 将最优条件获得的粗多糖溶液加入等体积三氯乙酸去除蛋白质,透析去除小分子杂质,蒸发浓缩,冷冻干燥备用。
1.3.6 指标测定
(1) 多糖含量:采用苯酚硫酸法[10],回归方程y=0.009 9x-0.021 4,R2=0.991 9。
(2) 蛋白质含量:采用考马斯亮蓝法[11],回归方程y=0.004x-0.006 7,R2=0.993 9。
(3) 糖醛酸含量:采用硫酸—咔唑法[12],回归方程y=0.051 9x+0.003 2,R2=0.992 7。
1.3.7 热特性测定 称取6 mg干燥的凉粉草多糖,利用热重分析仪对多糖样品进行分析,扫描温度30~600 ℃,加热速率10 ℃/min。
1.3.8 光谱测定
(1) 紫外光谱测定:将多糖溶液配制成质量浓度为1 mg/mL,采用紫外—分光光度计于200~600 nm进行测定。
(2) 红外光谱测定:称取干燥后的多糖样品1~2 mg,与30~60 mg溴化钾于研钵中磨碎,压成透明薄片,测定范围400~4 000 cm-1。
1.3.9 X射线衍射 电压40 kV,电流40 mA,2θ范围下8°~35°内进行扫描,以观察多糖颗粒的晶型结构。
1.3.10 体外抗氧化活性测定
(1) DPPH自由基清除率:根据文献[13]并修改,配制0.2 mmoL DPPH,以VC为阳性对照。取DPPH溶液2 mL 和不同质量浓度(0.025~0.175 mg/mL)多糖样品2 mL 为样品组,避光放置30 min,测定517 nm处吸光度,并按式(2)计算DPPH自由基清除率。
(2)
式中:
A——自由基清除率,%;
Ai——样品组吸光值;
Aj——样品干扰试验的液吸光值;
A0——对照组吸光值。
(2) ABTS自由基清除率:根据文献[14]并修改,配制ABTS溶液,避光反应8 h,以VC为阳性对照。取2 mL 不同质量浓度(0.025~0.200 mg/mL)多糖样品,加入4 mL ABTS溶液摇匀放置10 min,测定734 nm处吸光度,并按式(2)计算ABTS自由基清除率。
(3) 还原力:根据文献[15]并修改,配制不同质量浓度(0.25~4.00 mg/mL)多糖溶液,以VC为阳性对照,取1 mL 样品,加入磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 0.1%铁氰化钾溶液,摇匀,50 ℃水浴20 min,迅速冷却,加入2.5 mL 10%三氯乙酸溶液、2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁溶液,测定700 nm处吸光值,并按式(3)计算还原力。
R=Ai-Aj,
(3)
式中:
R——还原力;
Ai——样品吸光值;
Aj——多糖溶液吸光值。
1.3.11 凉粉草多糖抑菌活性
(1) 菌种活化及菌悬液的制备:将菌种接种至酵母膏蛋白胨(LB)培养基,37 ℃培养12 h,转接1~2次。用细牙签挑取少量菌种,37 ℃、200 r/min培养12 h。测定600 nm处各菌悬液的OD值,以无菌水作对照。
(2) 抑菌圈直径(inhibitory zone diameter,DIZ)的测定:参照Sun等[16]的方法。
(3) 提取液对菌生长变化的影响:参考范明智等[17]的方法。
1.4 数据分析
采用Origin Pro 2018软件进行数据分析和作图,Design-Expert 8.0.6软件对数据进行分析和处理。
2 结果与讨论
2.1 单因素试验
MCP为可溶性酸性多糖,易溶于碱性溶液。由图1(a) 可知,当碳酸氢钠添加量为0.0%~1.6%时,多糖提取率随碳酸氢钠添加量的增大而迅速增长,当碳酸氢钠添加量为1.6%时达最大(7.52%),随着碳酸氢钠添加量的加大,多糖提取率下降,是因为凉粉草多糖结构被破坏,且碱浓度过高会导致MCP在食品中应用时产生不良风味[18],因此选取1.6%为碳酸氢钠的最适提取添加量。
由图1(b)可知,当热浸时间为0~10 min时,多糖得率随热浸时间的延长而增大,10 min时达最大值。继续延长热浸时间,多糖得率反而下降,是因为前期凉粉草细胞受热破碎,多糖溶出、得率增大,随着热浸时间的延长,高温破坏了多糖结构导致多糖被降解[19]。因此选取10 min 为最适热浸时间。
由图1(c)可知,当料液比为1∶3~1∶4 (g/mL)时多糖含量较低,此时溶剂较小,多糖未能充分溶解。当料液比为1∶5 (g/mL)时,凉粉草与溶剂反应充分,多糖含量最高。当料液比>1∶5 (g/mL)时,其他水溶性组分与多糖展开竞争,致使多糖溶出率下降。
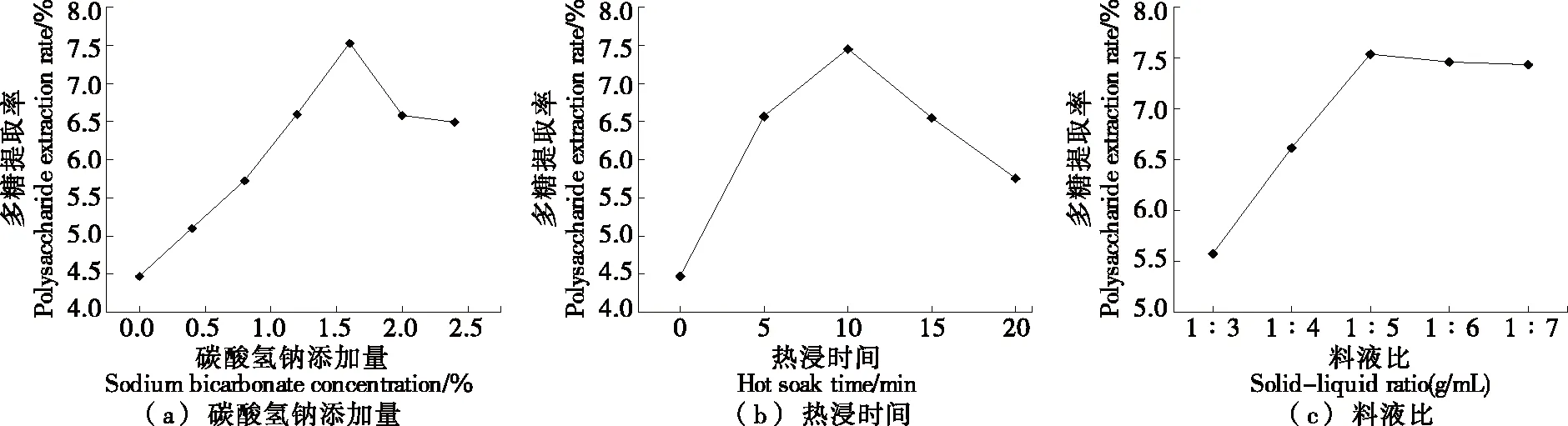
图1 各因素对凉粉草多糖提取率的影响Figure 1 Effect of various factors on the exlraction yield of MCP
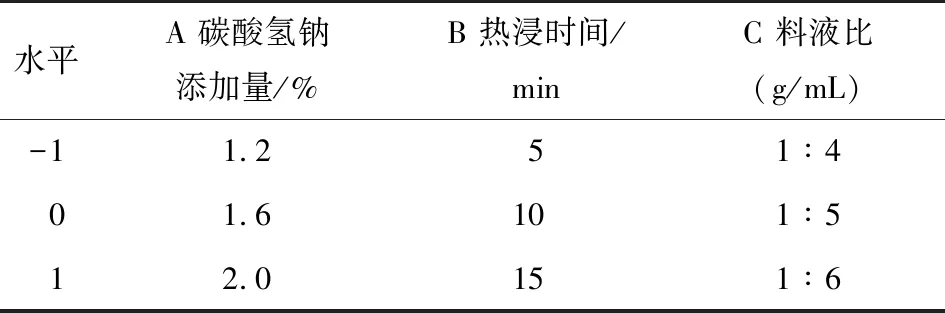
表1 响应面因素水平设计表
2.2 响应面法优化凉粉草多糖提取工艺
2.2.1 模型建立及显著性检验 采用Design-Expert 8.0.6软件对试验结果进行多元二次回归分析及方差分析,响应面试验因素水平见表1,响应面试验设计及结果见表2,方差分析见表3。多糖提取率的二次多项回归方程为:
Y=7.49+0.36A+0.31B+0.17C-0.13AB-0.23AC+0.10BC-1.06A2-1.22B2-0.17C2。
(4)
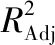
由F值可知,影响凉粉草多糖提取率的主次因素为A(碳酸氢钠添加量)>B(热浸时间)>C(料液比)。
2.2.2 各因素交互影响 由图2(a)和图2(b)可知,碳酸氢钠添加量方向曲面波动幅度较大,表明该因素对多糖提取率的影响较热浸时间影响显著。由图2(c)和图2(d)可知,料液比与热浸时间的交互作用对多糖提取率的影响呈马鞍状分布,当料液比一定时,随着热浸时间的增加多糖提取率先增加后小幅减小;当热浸时间不变时,随着料液比的增加,多糖提取率也先增加后小幅减小,但从等高线分布来看,BC的交互作用最弱。由图2(e)和图2(f)可知,多糖提取率随着碳酸氢钠添加量和料液比的增加先增加后减小,且在碳酸氢钠添加量方向影响较大,说明碳酸氢钠添加量是凉粉草多糖提取率的敏感影响因子。
2.2.3 提取工艺的验证 通过Design-Expert 8.0.6软件得出模型最优提取条件为碳酸氢钠添加量1.64%,热浸时间10.71 min,料液比1∶5.47 (g/mL),预测凉粉草多糖最大提取率为(7.57±0.63)%。为检验结果的可靠性,进行3次平行实验,实测凉粉草多糖提取率为(7.73±0.17)%,与预测值接近,说明采用响应面法优化多糖提取工艺具有一定的可行性。
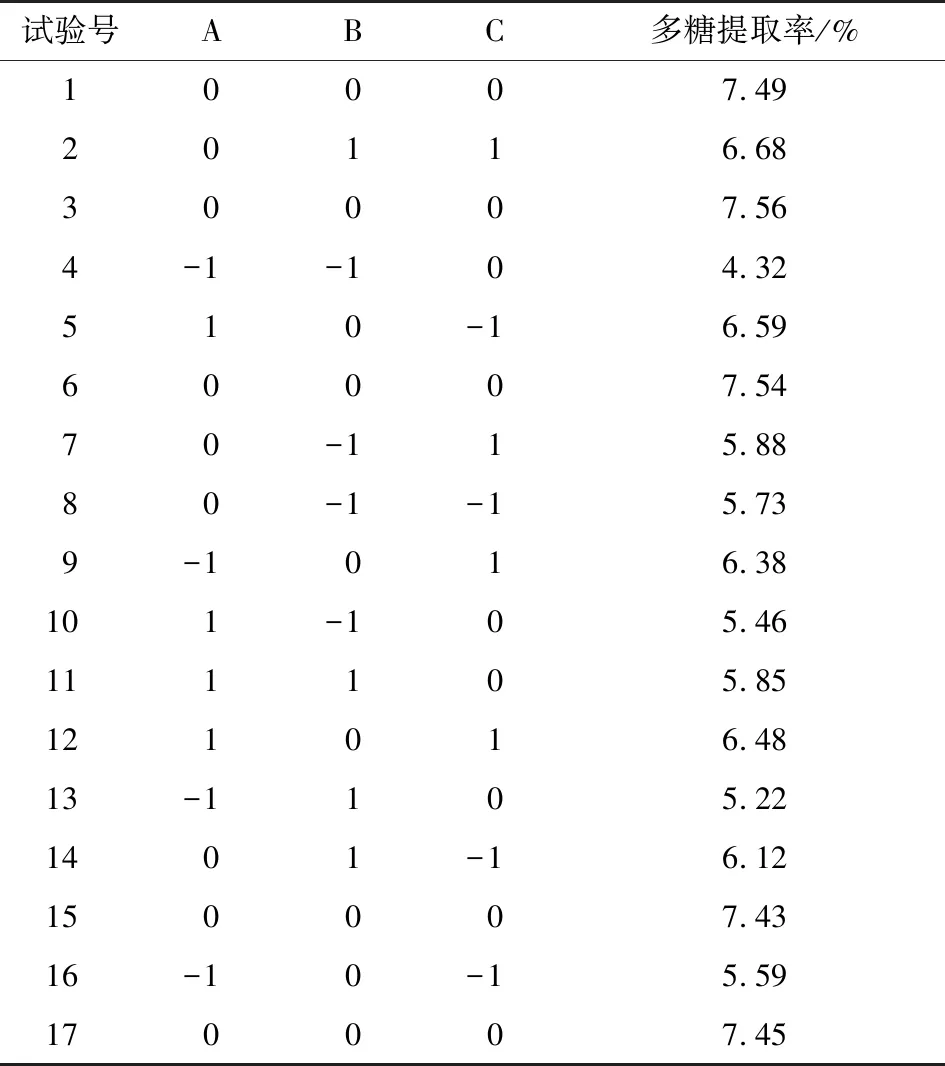
表2 响应面分析试验设计及结果
2.3 凉粉草多糖成分分析
经测定,凉粉草多糖总糖含量为109.51 μg/mL,蛋白质含量为85.521 μg/mL,糖醛酸含量为176.33 μg/mL。
2.4 热特性分析
由图3可知,MCP热分解的第一阶段主要集中在27~167 ℃,此阶段质量损失0.87 mg,是多糖中的游离水、结合水和受热易分解的化合物造成的。第二阶段集中在176~600 ℃,多糖在167 ℃处出现分解,该阶段的质量损失为2.87 mg,最终残留质量为1.26 mg,此阶段多糖因高温导致化学键被破坏而分解[20]。该结果与肖月欢[21]测得的两种MCP的试验结果一致。在所选温度范围内,MCP并未因高温被完全分解,其最终残留质量为1.26 mg,表明MCP具有较好的热稳定性。
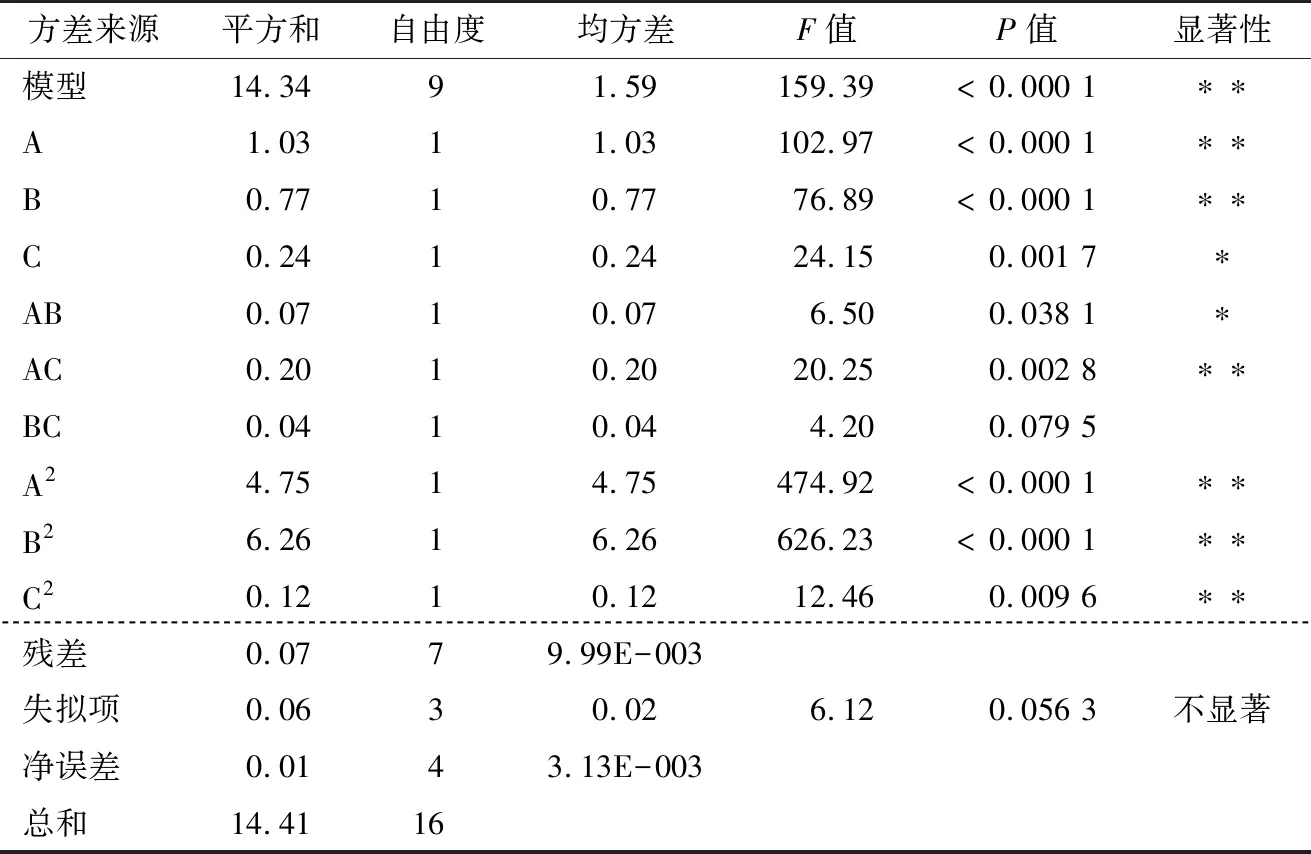
表3 响应面方差分析表†
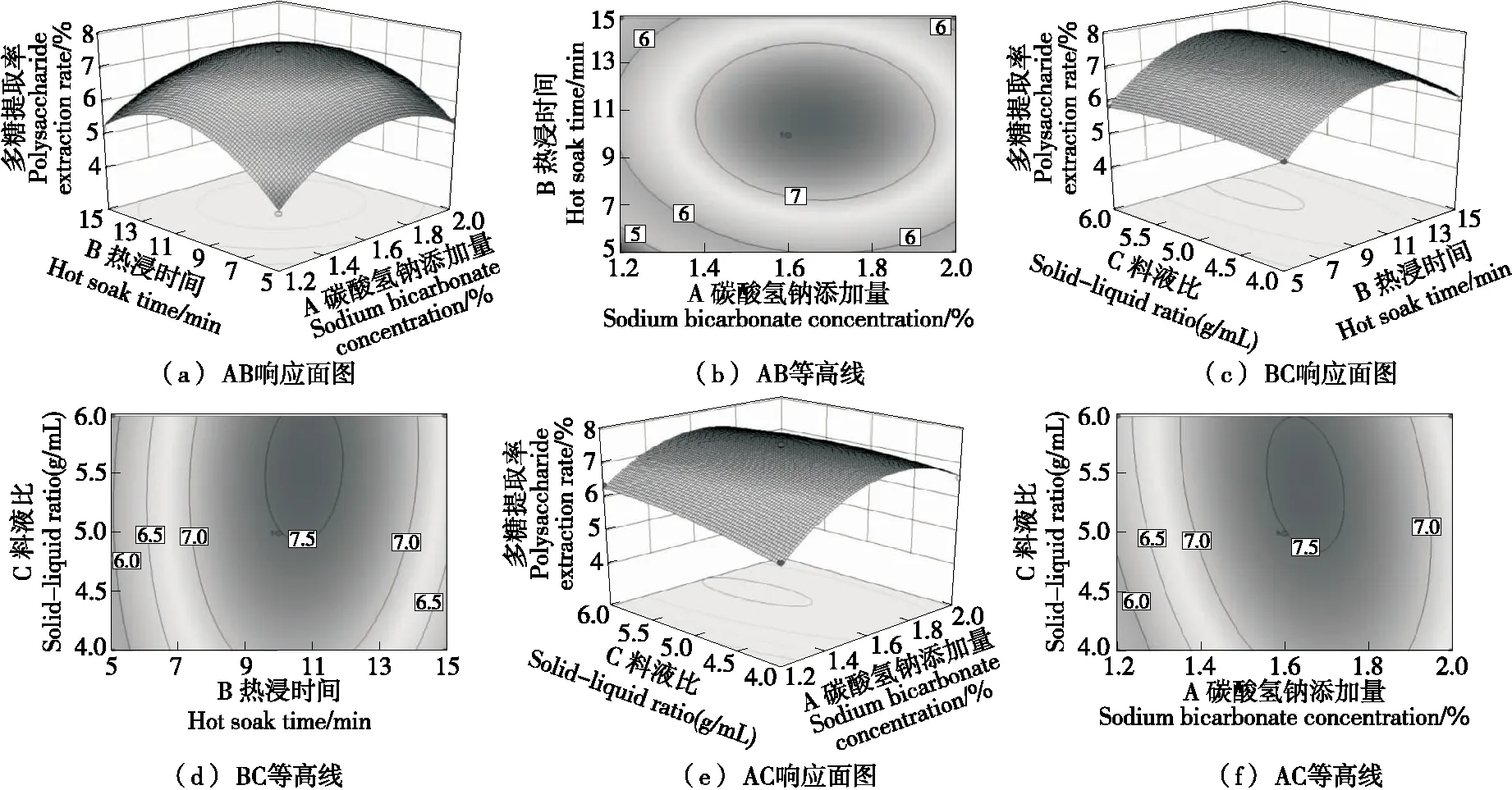
图2 各因素交互作用的响应面图和等高线图Figure 2 Response surface diagram and contour diagram of the interaction of various factors
2.5 光谱特性分析
2.5.1 紫外光谱分析 由图4可知,206~280 nm处有吸收峰,证明有多糖大分子存在,280 nm处出现最大吸收峰,说明得到的凉粉草多糖存在蛋白质、肽等化合物,可能为糖蛋白,与2.3测定的蛋白质结果吻合。
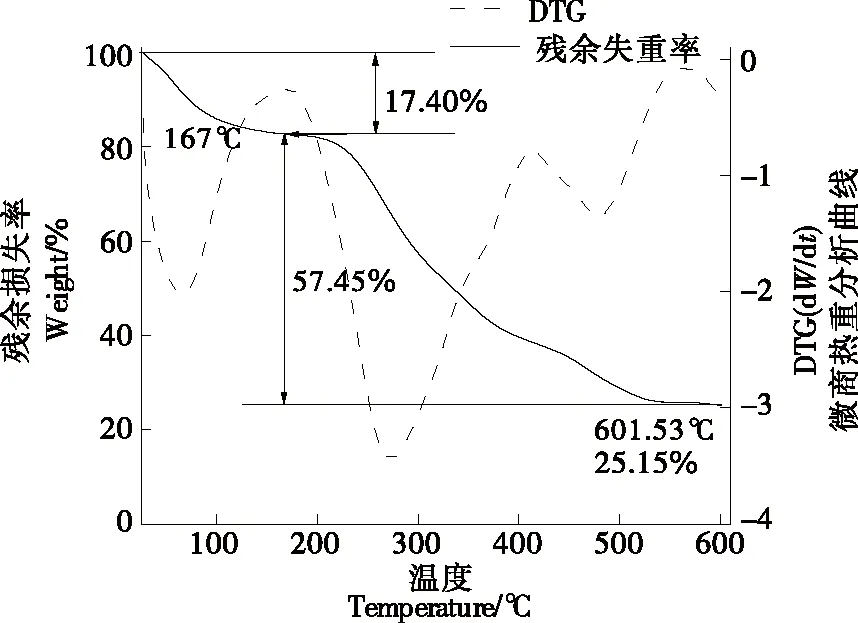
图3 多糖的残留质量变化曲线以及DTG曲线Figure 3 The residual mass change curves and DTG curves of MCP
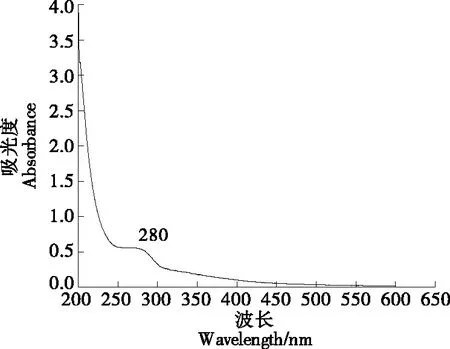
图4 凉粉草多糖的紫外扫描图谱Figure 4 Ultraviolet scanning spectrum of MCP
2.5.2 傅里叶红外变换光谱分析 由图5可知,多糖红外光谱共性特征明显,3 401.80 cm-1处出现O—H伸缩振动吸收峰,2 037.10 cm-1处有一个较弱的C—H伸缩振动峰,通过这两个特征吸收峰,可判断受试物为糖类化合物[22]。1 619.93 cm-1处出现一个吸收峰,对应为羧基的非对称伸缩振动引起的吸收峰,表明多糖含有糖醛酸[23]。1 508.15 cm-1处吸收峰归属多糖苯环骨架的伸缩振动,1 095.90~1 018.00 cm-1处特征吸收峰为C—O和C—O—C的伸缩振动,为吡喃糖的特征吸收峰[18]。1 415.51,1 268.74 cm-1处吸收峰由醇类物质引起,为C—H的变角振动。887.00 cm-1处吸收峰说明其可能含有β-糖苷键,632.29 cm-1处吸收峰应为醇类含羟基和苯环变形角振动与变形振动[24]。综上,凉粉草多糖是一种具有β-糖苷键的吡喃糖型结构的酸性多糖。
2.6 X射线衍射
由图6可知,在2θ为8°~35°时,该衍射峰无明显吸收峰,表明凉粉草多糖以非晶形式存在,且X衍射曲线呈光束状[21]。
图6 多糖X射线衍射图Figure 6 X-ray diffraction spectra of MCP
2.7 SEM分析
由图7可知,凉粉草多糖表面疏松且有很多密集气孔,呈雪花状,层层叠起,还有很多细小颗粒附在片状物质表面,使多糖呈现较为蓬松质轻的形态。

图7 多糖的SEM图Figure 7 SEM image of MCP
2.8 抗氧化试验
由图8(a)可知,凉粉草多糖对DPPH自由基清除率随质量浓度的升高而升高,当多糖质量浓度为0.175 mg/mL时,其对DPPH自由基清除率达66.35%。林丽华[18]研究发现,1.6 mg/mL的凉粉草多糖对DPPH自由基清除率为55.59%;宋晓娟等[25]发现凉粉草多糖对DPPH自由基清除率的IC50值为19.13 μg/mL。综上,新鲜凉粉草多糖具有良好的DPPH自由基清除能力。
由图8(b)可知,随着质量浓度的升高,凉粉草多糖对ABTS自由基的清除率升高,当多糖质量浓度为0.175 mg/mL 时,其对ABTS自由基的清除率高达79.63%。曹媛媛等[26]研究发现,添加4%凉粉草提取物时,其对ABTS自由基清除率为67%;宋晓娟等[25]研究发现,凉粉草提取物在所选浓度范围内,对ABTS自由基清除率的IC50值为18.20 μg/mL。因此,新鲜凉粉草多糖具有良好的ABTS自由基清除能力。
由图8(c)可知,在0~4 mg/mL质量浓度范围内,随着多糖质量浓度的增加,吸光度变大,还原能力增大,当多糖质量浓度为4 mg/mL时,其吸光度可达1.431,高于林大成等[27]的结果,说明凉粉草多糖的还原能力接近VC,具有一定的还原能力。
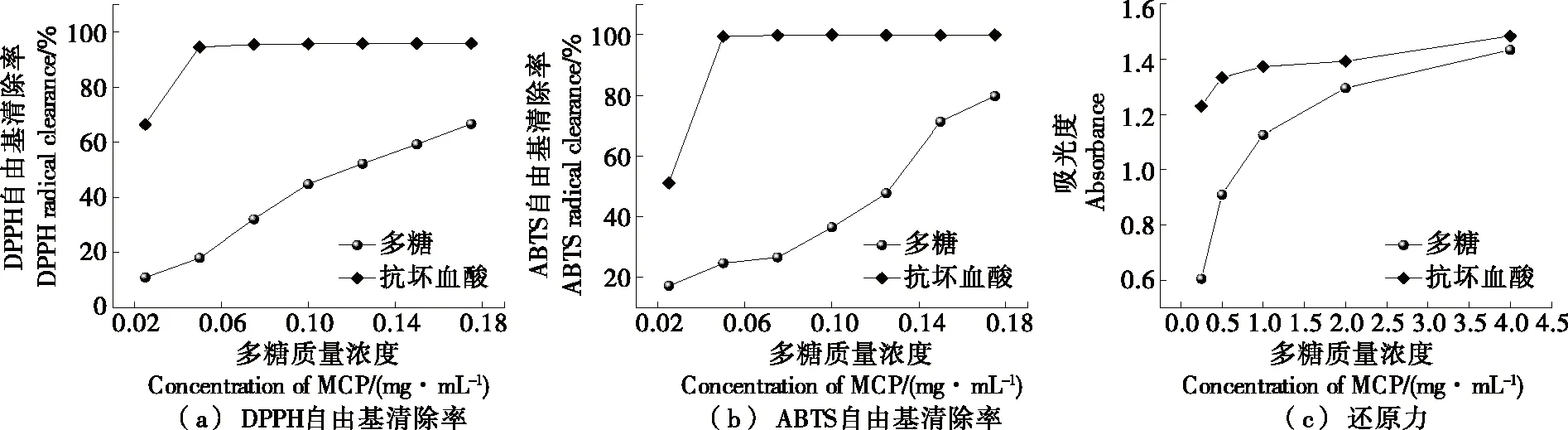
图8 凉粉草多糖的体外抗氧化活性Figure 8 In vitro antioxidant results of MCP
2.9 抑菌活性
2.9.1 凉粉草多糖提取液抑菌活性及DIZ分析 抑菌圈直径可以反映菌种对多糖的敏感性,直径>20 mm为高度敏感,14~20 mm为中度敏感,<8 mm为不敏感[28]。由图9可知,1,2 g/mL提取物对枯草芽孢杆菌的抑菌圈直径分别为(8.93±0.01),(10.24±0.02) mm,对大肠杆菌的抑菌圈直径为(7.84±0.02) mm,表明提取物对枯草芽孢杆菌的抑制作用最强。
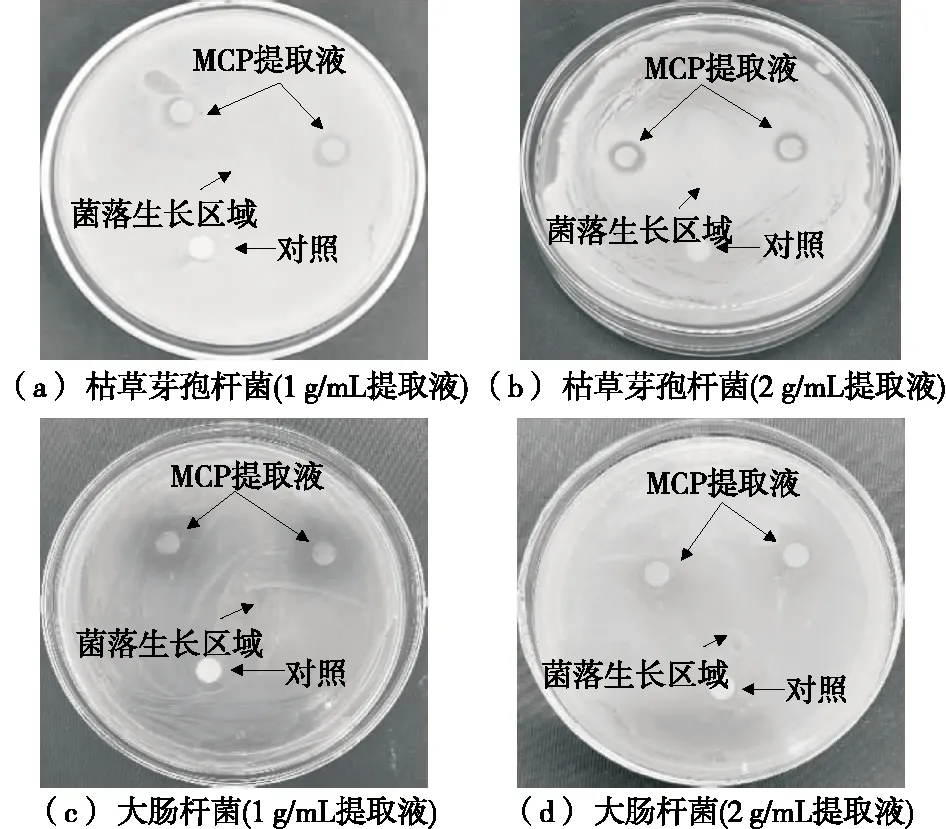
图9 凉粉草多糖的抗菌图谱Figure 9 Antibacterial spectrum of MCP
2.9.2 凉粉草多糖对枯草芽孢杆菌生长的影响 由图10可知,以蒸馏水为对照,枯草芽孢杆菌的生长速率在选定范围内呈线性增加,而添加MCP后,枯草芽孢杆菌生长速率明显被抑制,与多糖对枯草芽孢杆菌敏感性试验结果一致,说明MCP具有一定的抑菌作用。
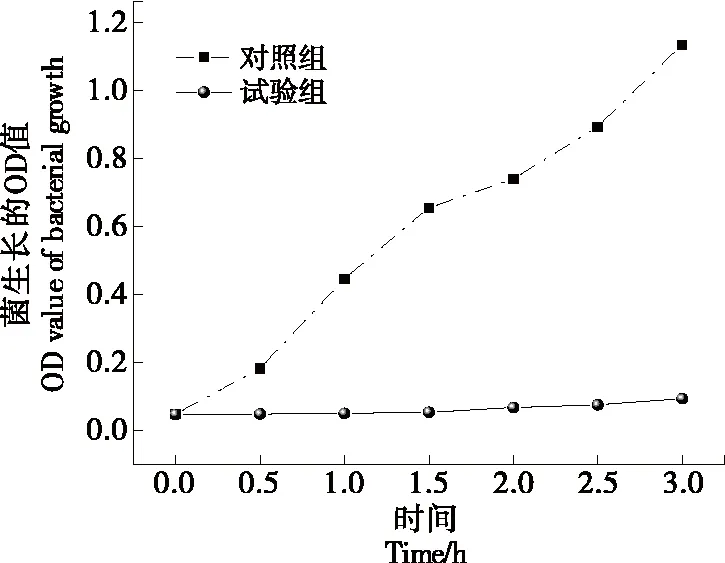
图10 凉粉草多糖对枯草芽孢杆菌生长的影响Figure 10 Effects of MCP on the growth of bacillus subtilis
3 结论
采用碱提醇沉法,结合响应面优化了新鲜凉粉草的提取工艺。结果表明,凉粉草多糖最优提取条件为碳酸氢钠添加量1.64%,热浸时间10.71 min,料液比1∶5.47 (g/mL),此时凉粉草多糖提取率为(7.73±0.17)%。光谱分析结果显示,凉粉草多糖为酸性多糖,且具有β-糖苷键的吡喃糖型结构;X衍射图谱显示多糖曲线呈光束状,以非晶体形式存在;SEM结果显示,多糖表面形貌为浅蓬松状。体外抗氧化活性结果表明,多糖对DPPH自由基、ABTS自由基清除率分别高达66.35%,79.63%,具有较强的抗氧化活性。抑菌试验表明,凉粉草多糖能有效抑制枯草芽孢杆菌的生长,但抑菌机理还有待探究。

