气相色谱法测定猪肉馅中鸭肉掺杂比例
费英敏 潘 雷 倪 雪 张根生,
(1. 黑龙江民族职业学院,黑龙江 哈尔滨 150066;2. 哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150028)
有关肉糜的掺杂鉴定,方法已有许多,其中基于不同肉样中所含的蛋白质、挥发性物质、DNA组成不同进行鉴定的方法较为普遍,通常借助光谱、色谱等化学仪器进行分析鉴定[1-3]。Vasso等[4]研究发现基于双链聚合酶链式反应(PCR)—酶联寡核苷酸测定法,在猪肉与牛肉或鸡肉混合时,可以轻易地检测到0.5%~1.5%的猪肉。Zheng等[5]通过近红外光谱仪分析肉制品中掺杂鸭肉的情况,研究建立的最优模型在一定的样本范围内具有一定的适用性。Bilge等[6]通过激光诱导击穿光谱法对掺杂肉样进行鉴定,依据不同肉种之间的特异性组成元素进行分析,通过主成分分析法对猪肉中掺杂的牛肉进行定性分析。Juan等[7]研究的聚合酶链式反应结合毛细管凝胶电泳(PCR-CGE-LIF)方法对于检测热处理肉混合物中的鸡肉、火鸡肉和猪肉具有可重复性和灵敏性。Wang等[8]通过电子鼻与气相色谱—质谱联用技术对羊肉中掺杂鸭肉进行定性和定量分析,该分析方法操作时间短、准确度高。Pavlidis等[9]运用液相微萃取与气相色谱—质谱联用技术,对掺入牛肉中的猪肉进行掺杂鉴定。PCR技术由于在肉类产品中的高灵敏度[10]、特异性和特殊用途而被广泛用于肉类样品的判别[11],而且检测成本较低,对加工肉制品中的物种识别更准确[12-15]。但是PCR技术在实际应用中也存在PCR条件优化困难、效率低等缺点。光谱学是一种快速、无损的肉样鉴定技术[16-17],其鉴定过程需要消耗大量时间且特异性低[18-19]。激光诱导击穿光谱(LIBS)是一种能够对食品样品进行快速多元分析的光学技术,但其在样品制备、矩阵效应、光谱预处理、模型校准和仪器开发等方面仍存在挑战[20-22]。肉类分析常用的色谱分析有气相色谱(GC)[23]和高效液相色谱(HPLC),色谱法能够识别几乎任何类型的分子,适合混合样品的分析,对于气相色谱来说,样品需要高度挥发性[24-25]。
有研究者[26-29]根据不同植物油脂含有的脂肪酸种类不同建立了不同植物油脂掺杂鉴定以及品质分析的方法,但目前根据脂肪酸的组成成分及含量来鉴定肉类掺杂还未见报道。猪前腿肉的肉质紧实且含有丰富的筋膜,常被用来制作肉馅,为达到利益最大化,一些价格相对低廉的鸭肉常被掺入到猪肉制品中[2]。研究拟以猪前腿肉为研究对象,参考植物油脂掺杂的鉴定方法,根据不同肉类所含脂肪酸种类以及含量不同,建立一种方便准确、高效快速的基于气相色谱法分析猪肉馅中掺杂鸭肉的定性、定量鉴定方法,为肉类掺杂鉴定提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
猪肉、鸭肉:猪前腿肉和鸭胸肉分5批次购买,市售;
氯化钠、氢氧化钾:分析纯,天津大陆化学试剂厂;
甲醇、正己烷、无水乙醇、无水硫酸钠:分析纯,天津富宇精细化工有限公司。
1.1.2 主要仪器设备
旋转蒸发仪:RE-52型,广州天河仪器设备厂;
海尔冰柜:TG350-BQ-1型,青岛海尔电器厂;
中药粉碎机:500A型,泰斯特仪器有限公司;
恒温水浴锅:HH511型,上海跃进医疗机械厂;
电热干燥箱:202型,余姚市东方电工仪器厂;
气相色谱仪:GC7900型,上海天美仪器有限公司;
数控超声波清洗器:KQ-500DE型,昆山市超声仪器有限公司;
电子分析天平:ALC-2100.2型,塞多利斯贸易有限公司;
台式高速离心机:TG16-WS型,上海卢湘仪仪器有限公司。
1.2 方法
1.2.1 样品制备 将5个批次猪前腿肉和鸭胸肉于-20 ℃ 冻藏。取不同批次猪前腿肉和鸭胸肉各100 g,分别切成薄片于60 ℃烘至恒重,粉碎,装入自封袋,冷藏备用。并取粉碎后的猪肉与鸭肉进行混合,制成掺杂肉样。
1.2.2 甲酯化处理 向经前处理后的猪肉样品中加入6.8 mL 浓度为0.4 mol/L的KOH-CH3OH作为酯化剂,69.5 ℃甲酯化处理19.6 min。
1.2.3 气相色谱条件 选用DB-FastFAM色谱柱(固定相为氰丙基),进样量1 μL,初始温度140 ℃,持续5 min,以5 ℃/min升至220 ℃,保持15 min。
1.2.4 精密性、稳定性试验 在1.2.2色谱条件下连续进样5次获得脂肪酸图谱,记录猪肉中棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)的保留时间以及峰面积。
1.2.5 重复性试验 按前处理条件在相同气相色谱条件下对5组样品进行气相色谱分析,计算油酸的保留时间以及峰面积的相对标准偏差值(RSD)。
1.2.6 指纹图谱的建立 依据气相色谱图的保留时间定性,对照37种脂肪酸标准图谱确定脂肪酸的种类,以面积归一化法定量每种肉样的脂肪酸含量。鉴于肉类脂肪酸指纹图谱匹配和共有峰确定的手动操作,采用手动建立标准指纹图谱时,直接采用峰面积和保留时间作为指标[30]。以每种样品中比较稳定且峰面积比较大的峰进行定位、匹配和确定共有峰,共有峰的选择依据各肉样的共有峰率来进行选择,以共有峰率≥70%为参考指标。
向1 g猪肉样品粉末中加入6.8 mL NaOH-CH3OH溶液(0.4 mol/L)和10 mL正己烷,69.5 ℃水浴回流19.6 min。冷却后加入15 mL蒸馏水进行超声波处理(250 W,5 min),3 000 r/min离心10 min。再通过人工匹配以及所有峰共有率的考察,确定猪肉脂肪酸组成以及各脂肪酸的含量,建立猪肉标准指纹图谱。并采取同样方法建立鸭肉脂肪酸标准指纹图谱。
1.2.7 猪肉、鸭肉脂肪酸组成显著性差异分析及特征脂肪酸的确定 应用SPSS 17.0软件分析两种肉样的脂肪酸含量。
1.2.8 猪肉样品掺杂后气相色谱图的变化及特征脂肪酸的选定 分别检测猪肉中各掺杂10%,30%,50%,70%的鸭肉,观察掺杂后的气相色谱图,分析掺杂样品的脂肪酸的含量变化及两种肉样的脂肪酸组成,结合SPSS 17.0软件分析猪肉区别于鸭肉的特征脂肪酸,根据得到的脂肪酸含量变化趋势,选定猪肉—鸭肉的特征脂肪酸。
1.2.9 掺杂模型的建立及验证 分别向猪肉中掺入0%,10%,30%,40%,50%,60%,70%,80%,90%,100%的鸭肉,建立掺杂试验模型,观察脂肪酸含量变化,绘制特征脂肪酸含量的变化趋势图,根据掺杂量与特征脂肪酸含量的变化建立回归预测模型,根据气相色谱仪的响应值及信噪比计算检测限。
制备猪肉—鸭肉掺杂肉样验证组,掺杂肉样比例分别为4%,8%,16%,32%,64%,按照超声波辅助提取结合优化的碱法甲酯化方法,在同一气相色谱条件下分别测定不同比例的掺杂肉样,根据气相色谱图得到特征脂肪酸的含量,并与回归方程中的结果进行比较,计算RSD值以及回收率,验证预测模型的准确度以及精密度。
2 结果与分析
2.1 精密性及稳定性试验结果
由表1和表2可知,猪肉样品中棕榈酸(C16:0)、硬脂酸(C18:0)及油酸(C18:1)保留时间的RSD分别为0.158%,0.124%,0.119%,符合指纹图谱保留时间的要求(RSD<1%);其峰面积的RSD分别为1.446%,1.944%,3.021%,符合指纹图谱峰面积的要求(RSD<5%),表明气相色谱仪的精密性及稳定性均符合试验要求。

表1 精密性及稳定性试验结果(脂肪酸的保留时间)

表2 精密性及稳定性试验结果(脂肪酸的峰面积)
2.2 重复性试验结果
由表3、表4可知,猪肉样品中棕榈酸(C16:0)、硬脂酸(C18:0)及油酸(C18:1)保留时间的RSD分别为0.062%,0.090%,0.079%,符合指纹图谱保留时间的要求(RSD<1%);其峰面积的RSD分别为2.983%,2.670%,1.522%,符合指纹图谱峰面积的要求(RSD<5%),表明试验重复性符合要求。

表3 重复性试验结果(脂肪酸的保留时间)

表4 重复性试验结果(峰面积)
2.3 猪肉脂肪酸标准指纹图谱的建立
猪肉气相色谱标准指纹图见图1,脂肪酸种类及相对含量见表5。
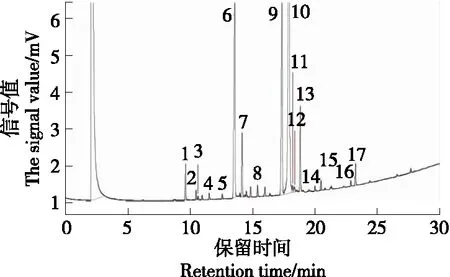
图1 猪肉脂肪酸气相色谱图Figure 1 GC chromatograms of pork fatty acid
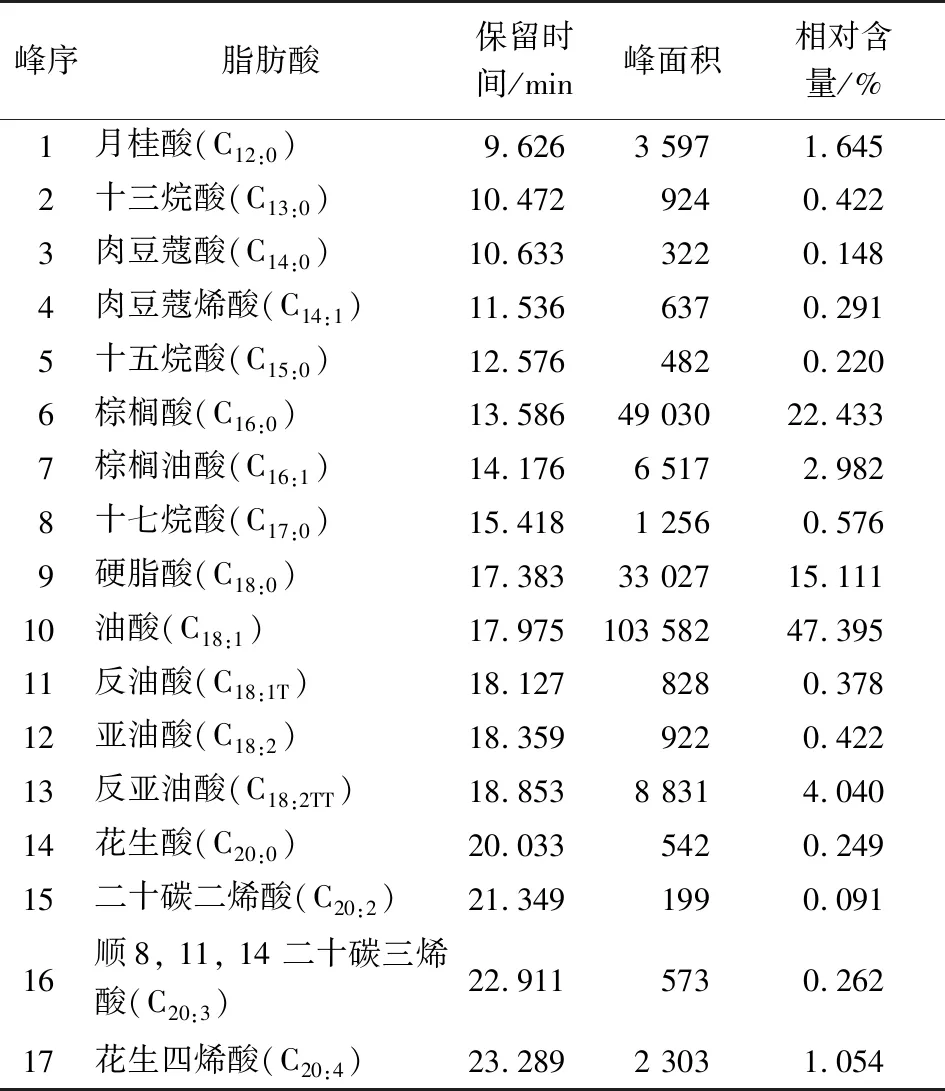
表5 猪肉脂肪酸种类及相对含量
2.4 鸭肉脂肪酸标准指纹图谱的建立
鸭肉气相色谱标准指纹图见图2,脂肪酸种类及相对含量见表6。

图2 鸭肉脂肪酸GC色谱图Figure 2 GC chromatograms of fatty acids in duck meat

表6 鸭肉脂肪酸种类以及相对含量
2.5 猪肉、鸭肉脂肪酸组成的显著性差异分析
猪肉、鸭肉脂肪酸组成显著性差异分析见表7。

表7 猪肉、鸭肉脂肪酸组成显著性差异分析†
2.6 猪肉掺杂后各脂肪酸的变化及特征脂肪酸的确定
由图1、图2及表8可知,猪肉中掺入鸭肉后,脂肪酸的种类及含量均发生了很大变化。猪肉样品中的主要脂肪酸为C18:1、C18:0、C16:0、C16:1、C18:2TT和C12:0,其中油酸含量最高。鸭肉中的主要脂肪酸为C18:1、C16:0、C18:0、C18:2TT,与任志伟[31]的研究结果相似。猪肉中的多数脂肪酸含量均高于鸭肉,而鸭肉中的C18:2TT含量明显高于猪肉,C16:0含量略高于猪肉。当猪肉中掺入鸭肉时,C12:0和C18:0含量随掺杂量的增加逐渐减少,C18:2TT含量随掺杂量的增加而增加,C22:0为鸭肉中特有的脂肪酸,而猪肉中不含有。为确保试验结论的可靠性,在猪肉中掺杂鸡肉后发现, C22:1为鸡肉中特有的脂肪酸,且鸡肉特征脂肪酸中不含有C22:0。此外,牛肉[32]和羊肉[33]的特征脂肪酸中也不含有C22:0,因此可以根据猪肉馅掺杂样品中是否含有C22:0来判定是否掺杂了鸭肉。综上,选定C12:0、C18:0、C18:2TT和C22:0作为猪肉—鸭肉的特征脂肪酸进行后续研究。

表8 掺入不同比例鸭肉后猪肉脂肪酸种类及其相对含量
2.7 掺杂猪肉馅脂肪酸组成的变化趋势及回归预测模型建立
由图3可知,随着鸭肉掺入量的增加,掺杂肉样中月桂酸、硬脂酸含量逐渐下降,反亚油酸、山嵛酸酸含量逐渐上升。由表7可知,猪肉中月桂酸、硬脂酸含量分别为1.648%,15.13%,鸭肉中月桂酸、硬脂酸含量分别为0.841%,12.959%,猪肉中两种脂肪酸含量均高于鸭肉中的,随着鸭肉掺入量的增加,猪肉在掺杂肉样中的比例逐渐减少,月桂酸、硬脂酸含量逐渐下降,猪肉中反亚油酸含量为4.041%,鸭肉中反亚油酸含量为12.525%,鸭肉中的反亚油酸含量明显高于猪肉中的。随着鸭肉掺入量的增加,样品中反亚油酸含量逐渐升高,山嵛酸作为鸭肉中特有的脂肪酸,未在猪肉中检测到,因此可以根据掺杂肉样中是否含有山嵛酸来判断猪肉中是否掺入了鸭肉,且随着鸭肉掺入量的增加,山嵛酸含量逐渐增加。

图3 掺杂肉样中脂肪酸组成随鸭肉掺入量的变化
根据鸭肉掺入量对猪肉脂肪酸组成影响趋势不同,以及是否可以检测出山嵛酸,选定月桂酸、硬脂酸、反亚油酸、山嵛酸作为特征脂肪酸用于鉴定猪肉中掺杂鸭肉。经回归分析,建立如表9所示的回归预测模型,定量分析猪肉中鸭肉的掺入量。
由表9可知,4个回归方程的R2值均>0.99,表明掺杂肉样中所选定的4种特征脂肪酸含量与鸭肉掺入量具有良好的线性关系,与应美蓉等[34]的研究结果类似。根据气相色谱仪的响应值及信噪比,猪肉中掺杂鸭肉检出限为0.5%,具有较高的灵敏度。

表9 鸭肉掺入量与掺杂肉样脂肪酸含量的回归预测模型
2.8 模拟掺杂肉样的结果验证
猪肉中掺杂鸭肉的预测值以及回收率见表10。
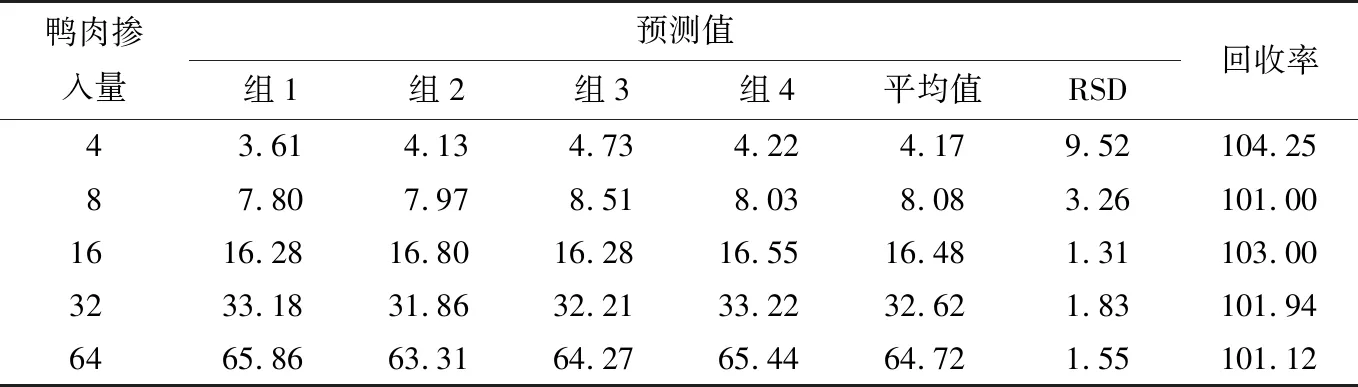
表10 鸭肉掺入量预测值以及回收率
由表10可知,当鸭肉掺入量为4%,8%,16%,32%,64%时,鸭肉掺入量预测值的相对标准偏差(RSD)为1.31%~9.52%,RSD值均<10%,回收率为101.00%~104.25%,表明鸭肉掺入量≥4%时,根据选定的月桂酸、硬脂酸、反亚油酸、山嵛酸4种特征脂肪酸所建立的回归预测模型有很好的准确度和精密度。
3 结论
对基于气相色谱法检测在猪肉馅中掺杂鸭肉的鉴定方法进行了研究。结果发现月桂酸、硬脂酸、反亚油酸和山嵛酸可作为猪肉—鸭肉混合掺杂肉馅的特征脂肪酸,不同掺入量的掺杂肉馅的特征脂肪酸的预测回归模型的R2值均>0.99,掺杂肉样的最低检出限为0.5%,说明通过此方法建立的掺杂预测模型有很好的准确度和精密度。后续可对其他种类的掺杂肉样进行研究,并对试验方法进一步优化,以期降低掺杂肉样的最低检出限。

