苦参碱对H9N2 AIV感染小鼠NLRP3炎性体信号通路的影响
魏婧洁,蒋宁波,梁燕,张倩,孙英健,胡格
苦参碱对H9N2 AIV感染小鼠NLRP3炎性体信号通路的影响
魏婧洁,蒋宁波,梁燕,张倩,孙英健,胡格
北京农学院动物科学技术学院,北京 102206
【目的】流感病毒感染引发机体的炎症反应及免疫稳态失衡,由此产生的细胞因子风暴(CS)是引起感染宿主死亡的主要原因。通过探究苦参碱对H9N2 AIV感染小鼠的保护作用及其调节NLRP3炎性体信号通路的特点及作用机制,可进一步完善中药抗病毒的理论依据,为新型抗病毒药物的研发奠定基础。【方法】72只8周龄BALB/c小鼠随机分为空白组(0.1 ml无菌鸡胚尿囊液)、病毒组(0.1 ml 4×105PFU/mlH9N2 AIV)、金刚烷胺组(0.1 ml 4×105PFU/mlH9N2 AIV+100×10-699%金刚烷胺)、苦参碱高浓度治疗组(0.1 mL 4×105PFU/mLH9N2 AIV+40 mL·kg-1苦参碱)、中浓度治疗组(0.1 mL 4×105PFU/mLH9N2 AIV+20 mL·kg-1苦参碱)和低浓度治疗组(0.1 mL 4×105PFU/mLH9N2 AIV+10 mL·kg-1苦参碱),每组12只,含病毒鸡胚尿囊液滴鼻构建小鼠病毒性肺炎模型,灌服或饮水给药治疗连续5 d,试验共进行7 d,观察不同组小鼠的体重变化。在第1、3、5、7天分别取3只小鼠无菌采血并处死,取小鼠肺组织进行病理组织学观察,RT-PCR检测小鼠肺组织中H9N2 NA、NLRP3 NLR基因表达情况,WesternBlot检测苦参碱治疗后H9N2感染小鼠肺组织NLRP3炎性体信号通路相关蛋白表达量的变化,小鼠血清用ELISA法测定细胞因子TNF-α、IL-1β和IL-10表达量的变化。【结果】与病毒组相比,苦参碱高浓度治疗组病理组织学观察中H9N2 AIV感染小鼠肺部水肿的区域明显减少,红细胞渗出减少,炎性细胞数量减少,效果接近金刚烷胺组。7 d时苦参碱高浓度治疗组小鼠肺泡壁完好,肺泡之间分界清楚,肺组织内炎性细胞、浆细胞数量大量减少,与空白组无异;苦参碱中浓度治疗组肺组织少量出血,肺泡内无渗出液,肺泡间隔完好;苦参碱低浓度治疗组可见肺泡内红细胞渗出,大量浆细胞募集,肺泡之间出现融合现象。经过苦参碱和金刚烷胺治疗的各组小鼠肺组织中H9N2病毒基因表达量在3、5和7 d极显著降低(<0.01)。经治疗3、5 d时,苦参碱高浓度治疗组和金刚烷胺组的NLRP3基因和蛋白表达量、TNF-α、IL-1β蛋白表达量极显著降低(<0.01);7 d时,苦参碱高、中、低治疗组小鼠肺组织中NLRP3基因表达量极显著降低(<0.01);5 d时苦参碱低浓度治疗组NLRP3蛋白、Caspase-1蛋白和中浓度组Caspase-1蛋白表达量显著降低(<0.05);3 d、5 d时苦参碱中、低浓度治疗组TNF-α和IL-1β蛋白表达量极显著降低(<0.01),苦参碱中浓度治疗组IL-10表达量极显著降低。【结论】苦参碱可在体内抑制H9N2 AIV的表达,通过下调NLRP3炎性体信号通路相关蛋白,下调TNF-α、IL-1β和IL-10的表达,减轻炎症反应,有良好的抗病毒、抗炎作用。
苦参碱;H9N2 AIV;NLRP3炎性体信号通路
0 引言
【研究意义】H9N2 AIV作为单股负链RNA病毒有着快速变异及易发生基因重组的特性,现如今我国家禽中存在的H9N2 AIV出现了疫苗免疫逃逸的现象,并且普遍拥有哺乳动物的高适应基因型[1]。病毒性肺炎是轻重型流感病毒感染者的典型症状,也是流感病毒感染期间最容易出现的症状,严重者可出现急性肺损伤(ALI)。近几年流行的COVID-19就是以冠状病毒感染引起的典型病毒性肺炎症状为主要临床特征[2]。探究中药抗病毒作用及其对信号通路调节的机制及特点,可以为研发新型抗病毒药物奠定理论基础。【前人研究进展】H9N2 AIV作为低致病性禽流感病毒(LPAIV),主要通过感染呼吸道上皮细胞的方式入侵宿主肺部[3],感染和损伤后引发机体过激的炎症反应以及免疫稳态失衡,由此产生的难以逆转的细胞因子风暴(CS)是流感病毒引起感染宿主死亡的主要原因[4]。NLRP3炎性体是由NLRP3蛋白、凋亡相关微粒蛋白(ASC)、Caspase-1蛋白组成的蛋白复合体[5],是NOD样受体家族的一员,也是天然免疫系统的重要组成部分。Caspase-1蛋白是NLRP3炎性体发挥作用的功能蛋白,它控制着细胞因子IL-1β和IL-18的成熟[6-7]。而NF-κB蛋白是NLRP3炎性体信号通路的上游蛋白,也是激活NLRP3炎性体的蛋白[8]。苦参碱作为苦参发挥药效的主要生物活性成分之一,在安全浓度范围内抗病毒能力显著,然而大剂量可引起痉挛和呼吸中枢麻痹[9-10]。【本研究切入点】研究发现,苦参碱可以通过调控MyD88/NF-κB信号通路和NLRP3炎性体信号通路,达到抑制病毒复制的效果。由此推测,苦参碱还可以通过下调NF-κB蛋白、NLRP3蛋白和Caspase-1蛋白的表达水平来调控NLRP3炎性体信号通路,从而达到治疗H9N2 AIV感染小鼠肺部炎症的效果。【拟解决的关键问题】本研究构建6组小鼠病毒性肺炎模型,运用病理组织切片技术、RT-PCR检测法、Western Blot法和ELISA法探究苦参碱对H9N2 AIV感染小鼠的保护作用及其调节NLRP3炎性体信号通路的特点和初步的作用机制,以期为完善中药抗病毒机理提供理论依据。
1 材料与方法
该试验于2020年10—12月在北京农学院生物安全实验室进行,试验过程符合生物安全规范要求。
1.1 试验材料和仪器
H9N2亚型禽流感病毒(GenBank登录号为FJ499463-FJ499470),由北京农学院生物安全实验室通过鸡胚传3代培养后冻存,病毒的空斑形成单位为 1×107PFU/mL。72只6周龄的BALB/c小鼠,体重22—26 g,购于北京勃林格殷格翰维通生物技术有限公司;98%苦参碱提取物购于西安赛邦生物科技有限公司;99%金刚烷胺购于北京爱普锐晟科技有限公司;逆转录试剂盒购于北京擎科新业生物技术有限公司(OEB20901);小鼠肿瘤坏死因子(TNF-α)、小鼠白细胞介素IL-1β(IL-1β)及小鼠白细胞介素IL-10(IL-10)试剂盒购于上海江莱生物科技有限公司(JL202010);SDS-PAGE凝胶快速配制试剂盒购于碧云天生物技术有限公司;荧光素标记山羊抗兔二抗、NK-κB、NLRP3、Caspase-1P20一抗购于Cell Signaling Technology生物公司。
荧光定量PCR仪购于美国Biorad公司;低温超速离心机购于BECKMAN公司;隔水恒温培养箱购于上海智城分析仪器制造有限公司;石蜡切片机、生物组织包埋机购于LEICA公司。
1.2 动物分组及处理
72只6周龄的BALB/c小鼠,试验开始前饲养一周适应环境,定期观察小鼠的生长状况,记录小鼠体重变化情况(饲养于独立动物房,保持温度、湿度、光照恒定,使用实验鼠专用饲料喂养)。小鼠随机分为空白组(0.1 ml无菌鸡胚尿囊液)、病毒组(0.1 mL 4×105PFU/mL H9N2 AIV)、金刚烷胺组(0.1 mL H9N2 AIV+100×10-699%金刚烷胺)、苦参碱高浓度治疗组(0.1 mL H9N2 AIV+40 mL·kg-1苦参碱)、中浓度治疗组(0.1 mL H9N2 AIV+20 mL·kg-1苦参碱)和低浓度治疗组(0.1 mL H9N2 AIV+10 mL·kg-1苦参碱)共6组,每组12只。病毒液滴鼻构建小鼠病毒性肺炎模型,病毒接种4 h后,对小鼠进行灌服或饮水给药治疗连续5 d,试验共进行7 d。
病毒感染后分别在1、3、5和7 d每组随机挑选3只小鼠,即组内平行对照,无菌采集静脉血,放2—8℃冰箱中静置2 h,4℃、3 000 r/min离心10 min,吸取上层的血清,-80℃条件保存,备用。按实验动物伦理要求处死小鼠,完整摘取肺脏。取一半肺组织放在10%中性福尔马林溶液中固定,另一部分置于-80℃冰箱冷冻保存。
1.3 小鼠肺部病理组织学研究
将在10%中性福尔马林溶液固定的小鼠肺组织取出,流水冲洗过夜,然后脱水、透明、浸蜡、包埋,将组织切片(5 µm)固定在载玻片上,37℃恒温箱烘干,用苏木精和伊红(HE)染色、中性树脂封片,光学显微镜观察组织病理学变化。
1.4 荧光定量PCR检测小鼠肺组织中H9N2 NA、NLRP3NLR基因表达量
将保存在-80℃冰箱中的肺组织取出,液氮中速冻后放入玻璃研磨器中研磨,每50 mg组织匀浆中加入1 mL Trizol,转移到EP管中静置,加入氯仿200 μL(Trizol﹕氯仿=5﹕1)盖紧EP管,上下缓慢震荡15 s,冰上静置3 min。4℃12 000 r/min离心15 min,吸出上清液转移到新的EP管中,加入500 μL异丙醇,混匀,冰上静置10 min,4℃离心14 000 r/min离心10 min。弃上清液,加500 μL 85%的冰乙醇溶液(-20℃保存)洗涤,重复两次,洗涤完毕后剩余样品放置在超净台干燥5—10 min。干燥后在EP管中加入15 μL无菌水吹打混匀。测定提取的mRNA的纯度和含量,用逆转录试剂盒进行cDNA逆转录,Real-Time pcr检测肺组织中H9N2 AIV mRNA、NLRP3 mRNA。以Gapdh为内参基因,神经氨酸酶(NA)和NLR引物见表1。Real time pcr反应体系:2×T5 Fast qPCR Mix 10 µL,10 μmol·L-1正、反向引物各0.8 µL,50×ROX Reference Dye I/II*(optional)0.4 µL,相应的cDNA 2 µL,加水补至20 µL。反应程序:95℃预变性;95℃变性30 s,60℃退火30 s,72℃延伸30 s,40个循环。采集荧光信号,数据采用CT法进行分析。
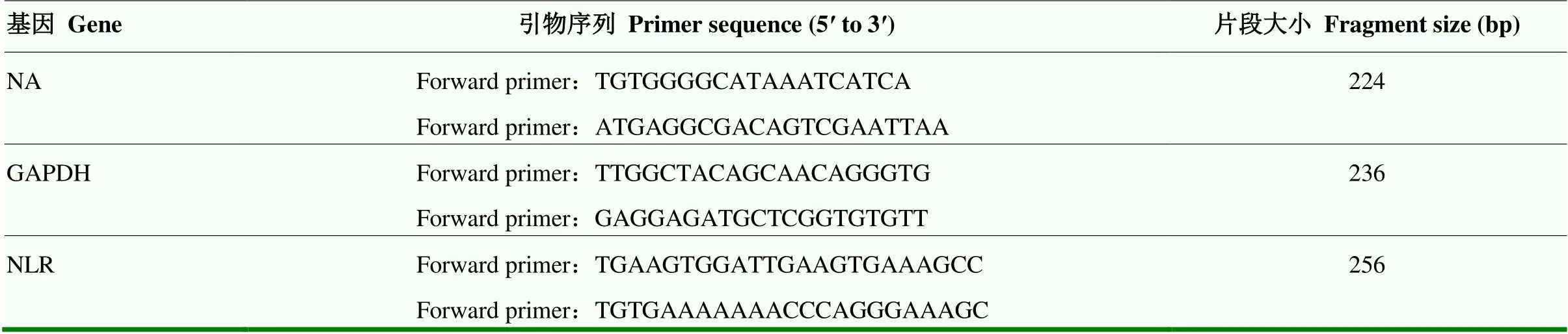
表1 NA、NLR和内参GAPDH基因引物序列和片段大小
1.5 Western Blotting法检测小鼠肺组织中NF-κB 、NLRP3、Caspase-1蛋白表达量
以Gapdh作为内参,每组称取20 mg左右小鼠肺组织样品,加入500 µL的RIPA裂解液,匀浆后4℃12 000 r/min离心15 min,取上清,按照BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit,BCA)测定蛋白浓度,根据标准曲线计算样品蛋白浓度。调整样品浓度,煮沸后于-80℃保存。按SDS-PAGE凝胶快速配制试剂盒说明书配制12%分离胶和5%浓缩胶,将提取的蛋白样在垂直电泳仪上电泳分离后,转移到PVDF膜上。50 g·L-1的脱脂奶粉室温封闭1.5 h。一抗4℃摇床过夜后用TBST洗涤3次,二抗室温孵育2 h后用PBST充分洗涤,使用ECL发光液显影,拍照并分析。
1.6 ELISA法检测小鼠肺组织内炎性因子的表达
用ELISA试剂盒检测BALB/c小鼠致炎因子TNF-α、IL-1β及抗炎因子IL-10的表达。取-80℃保存的小鼠血清,经样本稀释液稀释后,转移到已经做好标记的无菌EP管中。按照小鼠TNF-α、IL-1β、IL-18、IL-6试剂盒说明检测细胞因子,根据标准品的吸光度值,绘制标准曲线,记录并分析试验结果。
1.7 统计分析
试验数据先用EXCEL初步处理,试验数据以均数±标准差表示。用SPSS统计分析软件进行差异显著性检验,GraphPadPrism7.0进行分析并作图,<0.05被认为具有统计学意义。
2 结果
2.1 小鼠肺部病理组织学研究
小鼠肺组织病理学变化结果如图1—3所示:在病毒感染后3—7 d,与病毒组相比,经苦参碱高浓度组和金刚烷胺组治疗的小鼠,肺组织内没有大面积红细胞渗出,肺泡壁完好,肺泡之间分界清楚,肺泡内无渗出液,肺组织内炎性细胞、浆细胞数量明显减少;苦参碱中浓度组肺组织血管周围有散乱红细胞逸出,肺泡内无渗出液,肺泡间隔完好;苦参碱低浓度治疗组可见肺泡壁增厚,肺泡周围出现出血,肺泡内有红细胞存在,与病毒阳性组差异不显著。
2.2 小鼠肺组织中H9N2 NAmRNA、NLRP3 NLRmRNA表达量的变化
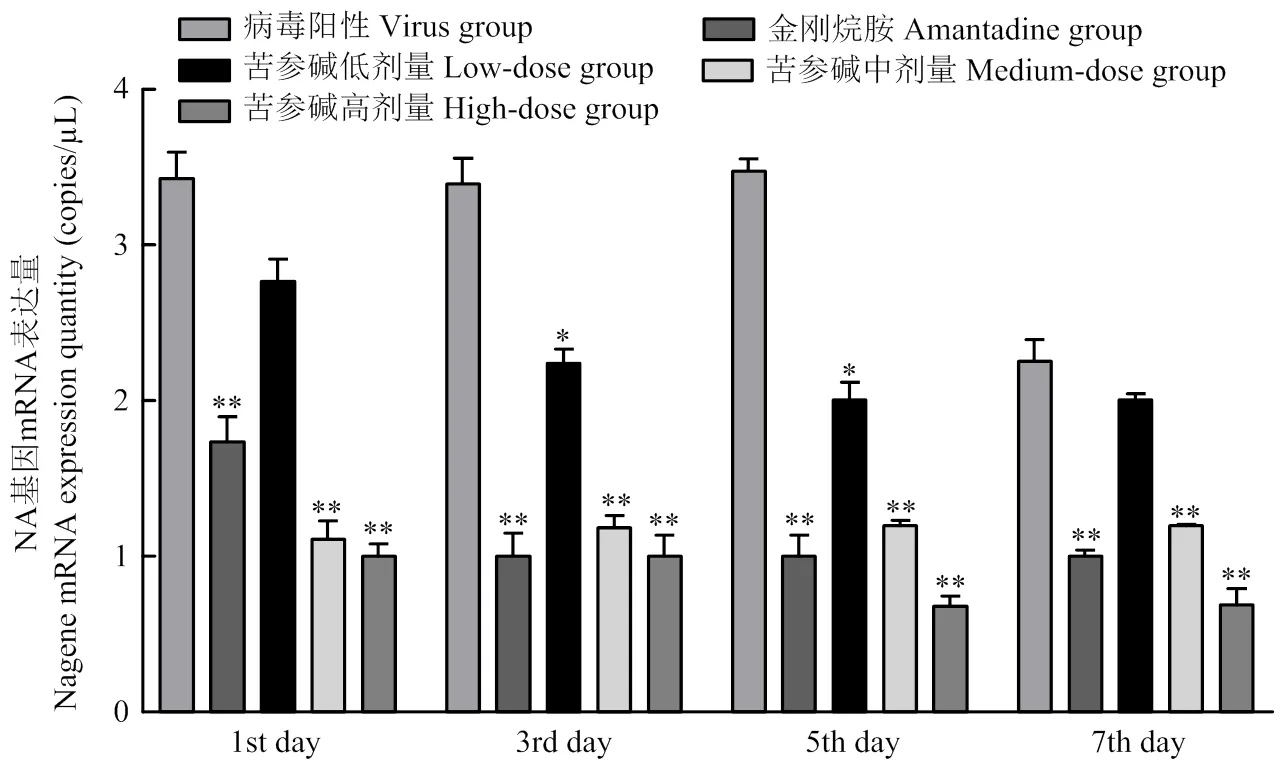
荧光定量PCR法检测结果如图4所示:病毒感染小鼠经药物灌胃治疗后,与病毒组相比,苦参碱高、中浓度组和金刚烷胺组的BALB/c小鼠肺组织中的H9N2 AIVNA的mRNA含量明显降低,差异极显著(<0.01)。低浓度组的小鼠肺组织中的H9N2 AIV NA的mRNA含量有所降低,差异不显著。
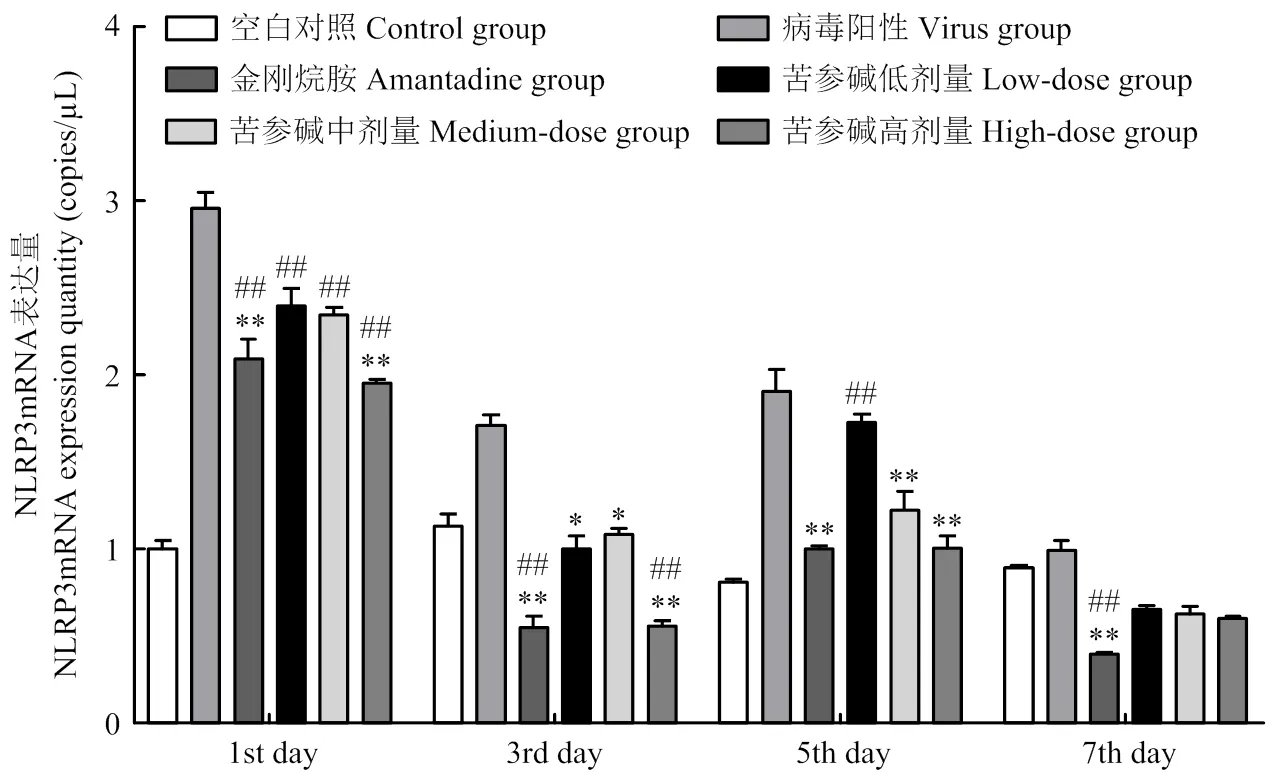
试验组小鼠肺组织中NLRP3 mRNA的表达情况结果如图5所示:病毒感染经药物灌胃治疗后,苦参碱高浓度组和金刚烷胺组小鼠肺组织中NLRP3 mRNA表达量比病毒组低,差异极显著(<0.01);中、低浓度组NLRP 3 mRNA表达量同样降低,差异不显著。初期高、中、低浓度组和金刚烷胺组NLRP3 mRNA表达量比空白组高,差异极显著(<0.01)。中期高浓度组和金刚烷胺组NLRP3 mRNA表达量比空白组极显著降低(<0.01);中、低浓度组NLRP3 mRNA表达量接近,差异不显著。后期高、中、低浓度组NLRP3 mRNA表达量比空白组显著降低(<0.05);金刚烷胺组NLRP3 mRNA表达量极显著降低(<0.01)。
2.3 NLRP3炎性体信号通路蛋白NF-κB、NLRP3、Caspase-1 表达的变化
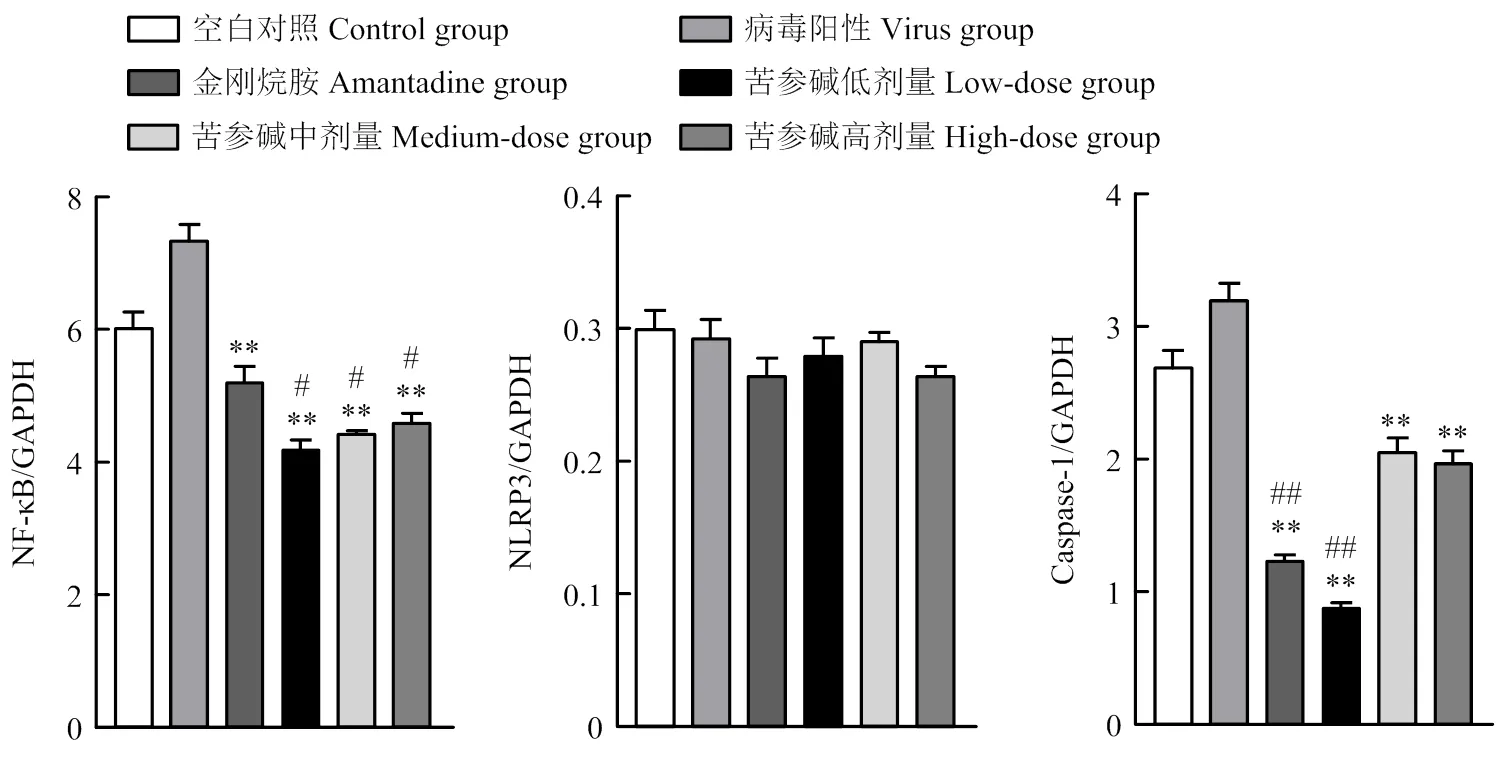
Western Blotting检测结果显示:病毒感染后的第7天,与病毒组相比,苦参碱高、中、低浓度组和金刚烷胺组的NF-κB蛋白的相对表达量都有很大程度的降低,差异极显著(<0.01)。苦参碱高、中、低浓度组NF-κB蛋白表达量比空白组显著降低(<0.05);金刚烷胺组NF-κB蛋白表达量降低,差异不显著(图6)。
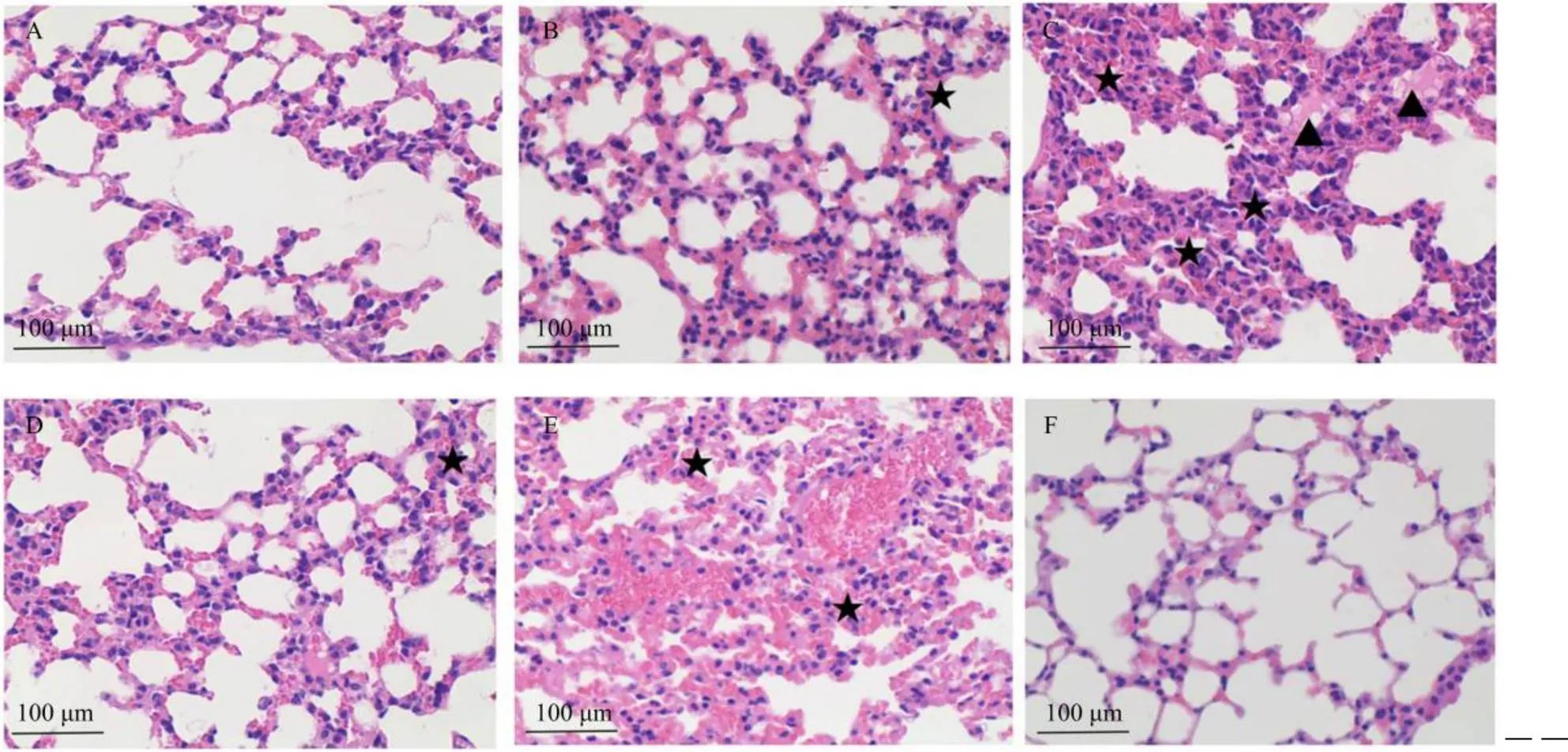
A. 苦参碱高浓度组;B. 苦参碱中浓度组;C. 苦参碱低浓度组;D. 金刚烷胺组;E. 病毒组;F. 空白组;★:炎性细胞募集;▲:肺水肿
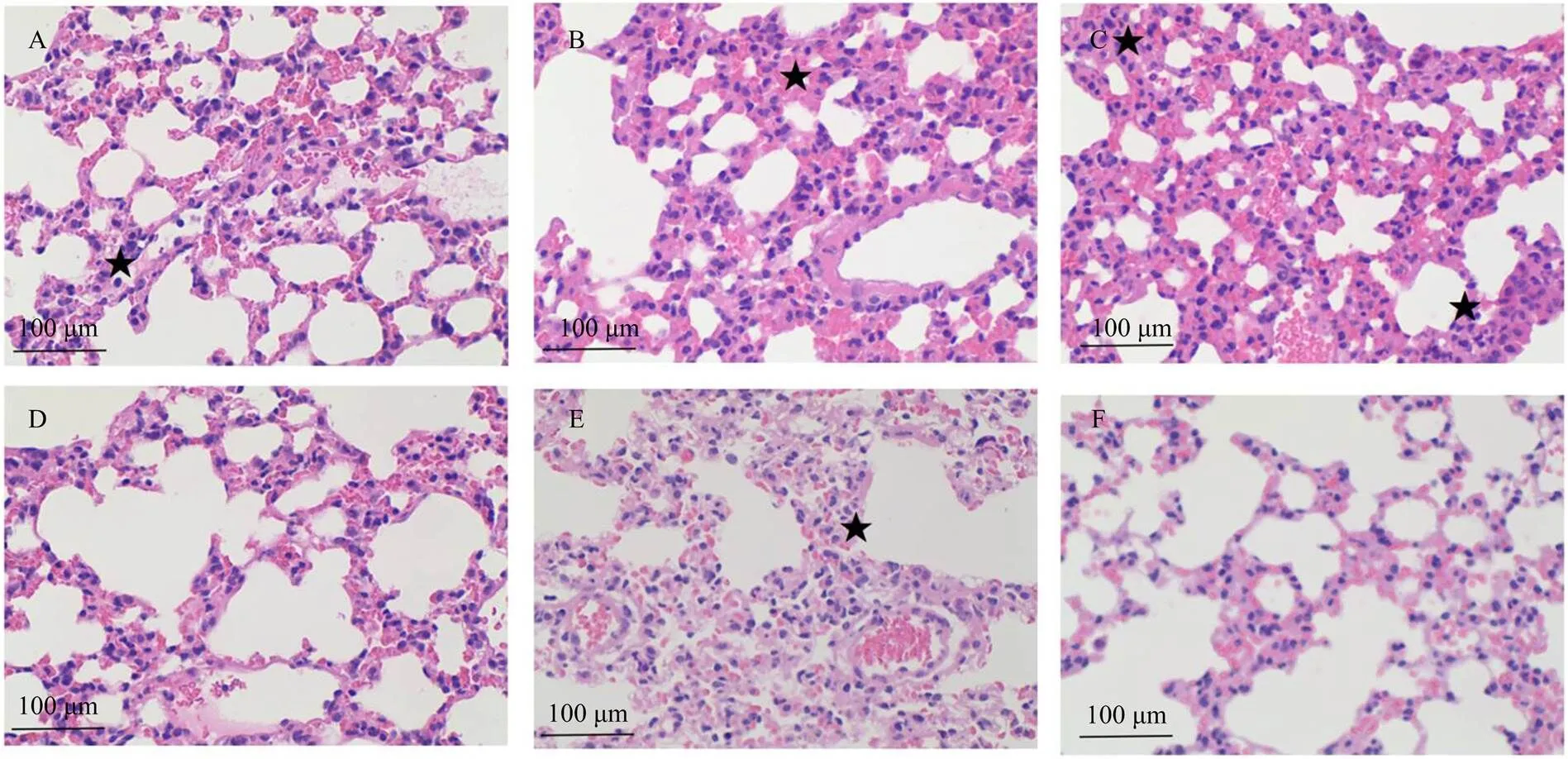
A. 苦参碱高浓度组;B. 苦参碱中浓度组;C. 苦参碱低浓度组;D. 金刚烷胺组;E. 病毒组;F. 空白组;★:炎性细胞募集
NLRP3炎性体蛋白的检测结果显示:病毒感染后的第7天,与病毒组相比,苦参碱高、中、低浓度组和金刚烷胺组的NLRP3蛋白表达量降低差异不显著。与空白组相比,高浓度组和金刚烷胺组的NLRP3蛋白表达量都降低,差异不显著;中、低浓度组NLRP3蛋白表达量接近,与空白组相比差异不显著。
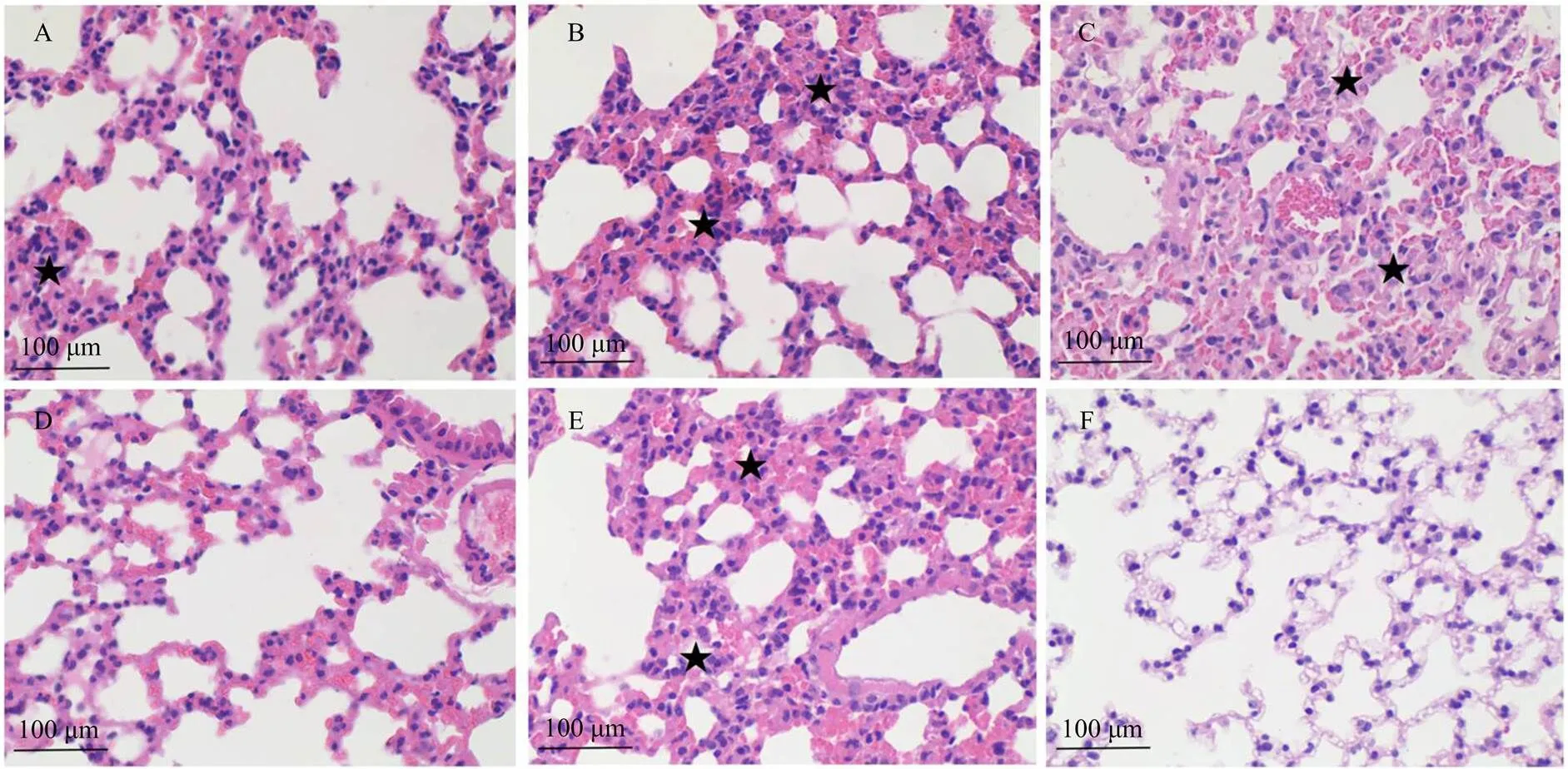
A. 苦参碱高浓度组;B. 苦参碱中浓度组;C. 苦参碱低浓度组;D. 金刚烷胺组;E. 病毒组;F. 空白组;★:炎性细胞募集
与病毒组比较*P<0.05;**P<0.01 Compared with virus group *P<0.05; **P<0.01
Caspase-1蛋白的检测结果显示:病毒感染后的第7天,与病毒组相比,苦参碱高、中、低浓度组和金刚烷胺组Caspase-1蛋白表达量极显著降低(<0.01)。苦参碱低浓度组和金刚烷胺组的Caspase-1蛋白表达量比空白组相极显著降低(<0.01);苦参碱高、中浓度组Caspase-1蛋白表达量降低,差异不显著(图7)。
2.4 BALB/c小鼠体内炎症因子的表达情况
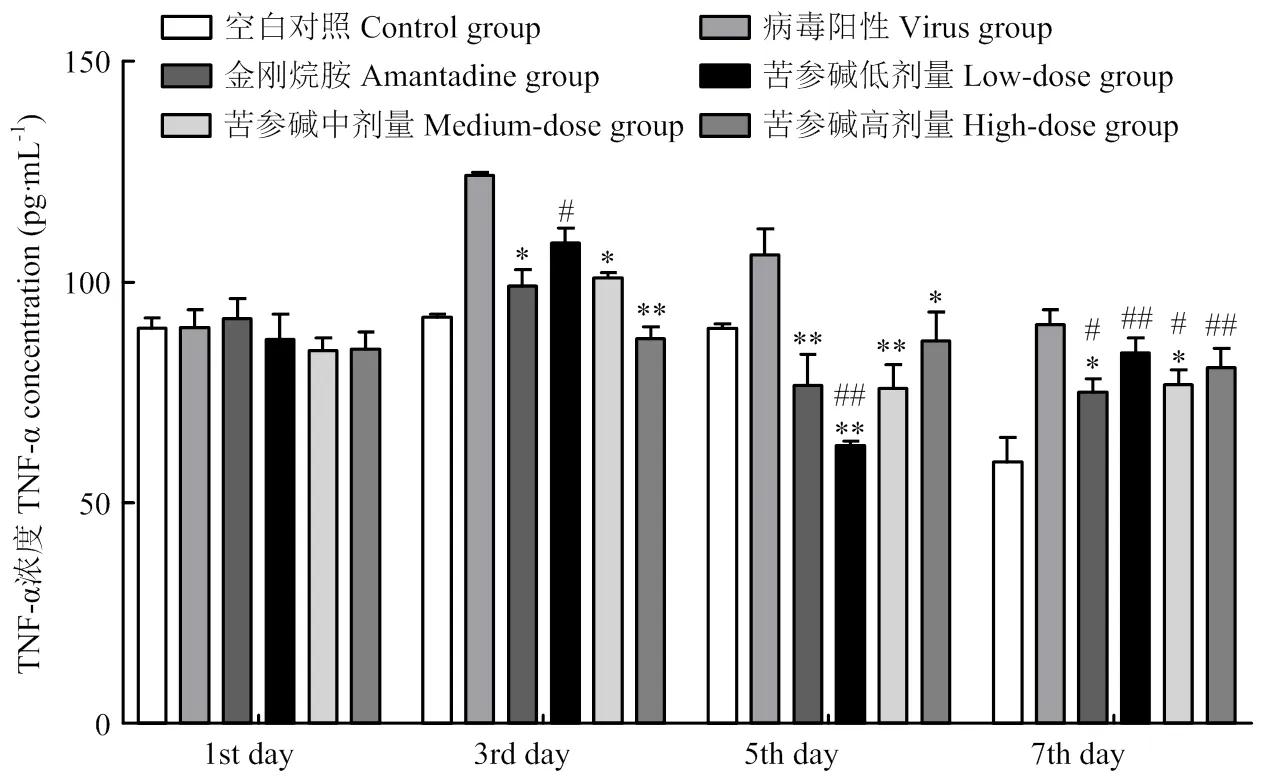
肿瘤坏死因子(TNF-α)结果如图8所示:初期,6组小鼠体内TNF-α的表达量接近;中期,与病毒组相比,苦参碱中、低浓度组和金刚烷胺组TNF-α的表达量都极显著降低(<0.01);高浓度TNF-α表达量较低,差异不显著。苦参碱低浓度组TNF-α表达量比空白组低,差异极显著(<0.01)。后期,各组小鼠体内TNF-α的表达量逐渐恢复正常。
与病毒组比较*P<0.05;**P<0.01 Compared with virus group *P<0.05; **P<0.01
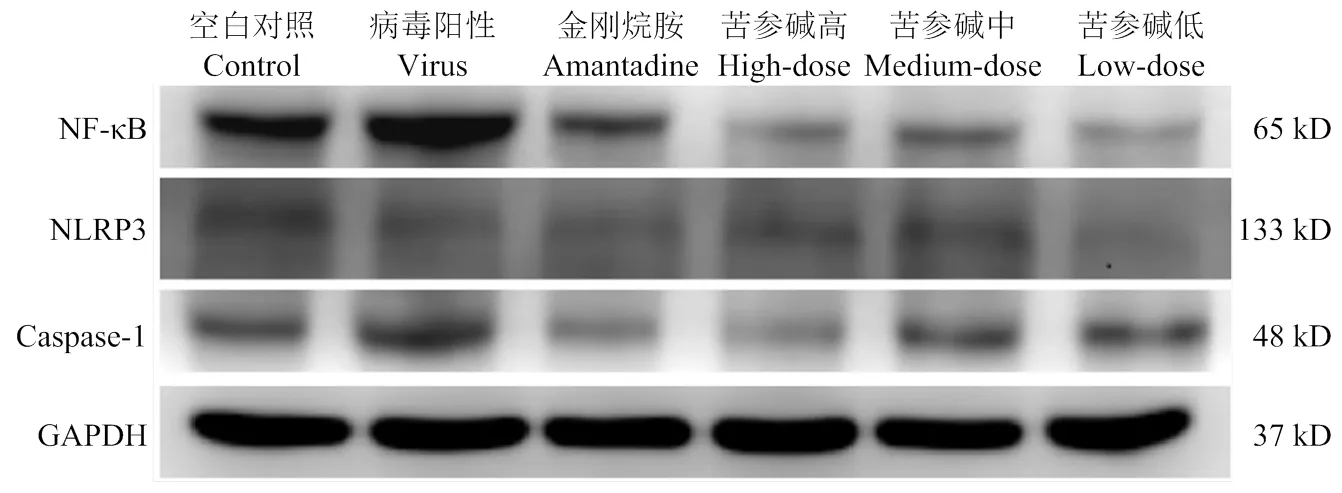
图6 病毒感染第7天,药物治疗五次NF-κB、NLRP3、Caspase-1蛋白的相对表达量
与病毒组比较*P<0.05;**P<0.01;与对照组比较#P<0.05;##P<0.01
IL-1β检测结果如图9所示:初期,与病毒组相比,苦参碱高、中浓度组和金刚烷胺组IL-1β表达量降低,差异极显著(<0.01);低浓度组IL-1β表达量差异不显著。中期,与病毒组相比,高、中、低浓度组和金刚烷胺组IL-1β表达量极显著降低(<0.01)。高、中、低浓度组和金刚烷胺组IL-1β表达量与空白组无显著差异。后期,各组小鼠体内TNF-α的表达量逐渐恢复正常。
IL-10检测结果如图10所示:初期,与病毒组相比,苦参碱高、中、低浓度组抑炎因子IL-10表达量极显著降低(<0.01);金刚烷胺组IL-10表达量降低,差异不显著。中期,与病毒组相比,苦参碱中浓度组IL-10表达量极显著降低(<0.01);高、低浓度组和金刚烷胺组IL-10表达量降低,差异不显著。后期,苦参碱高、中、低浓度组和金刚烷胺组IL-10表达量相近。
与病毒组比较*P<0.05;**P<0.01;与对照组比较#P<0.05;##P<0.01。下同
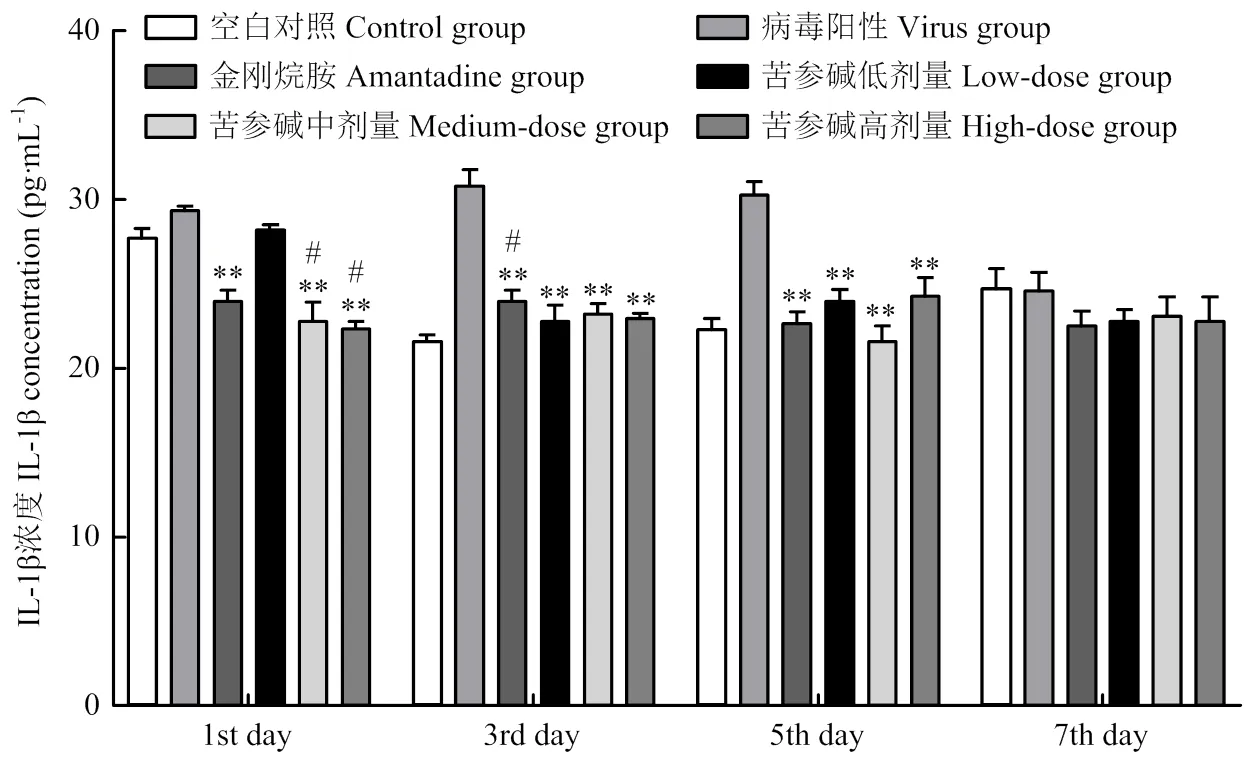
与病毒组比较*P<0.05。**P<0.01;与对照组比较#P<0.05。##P<0.01
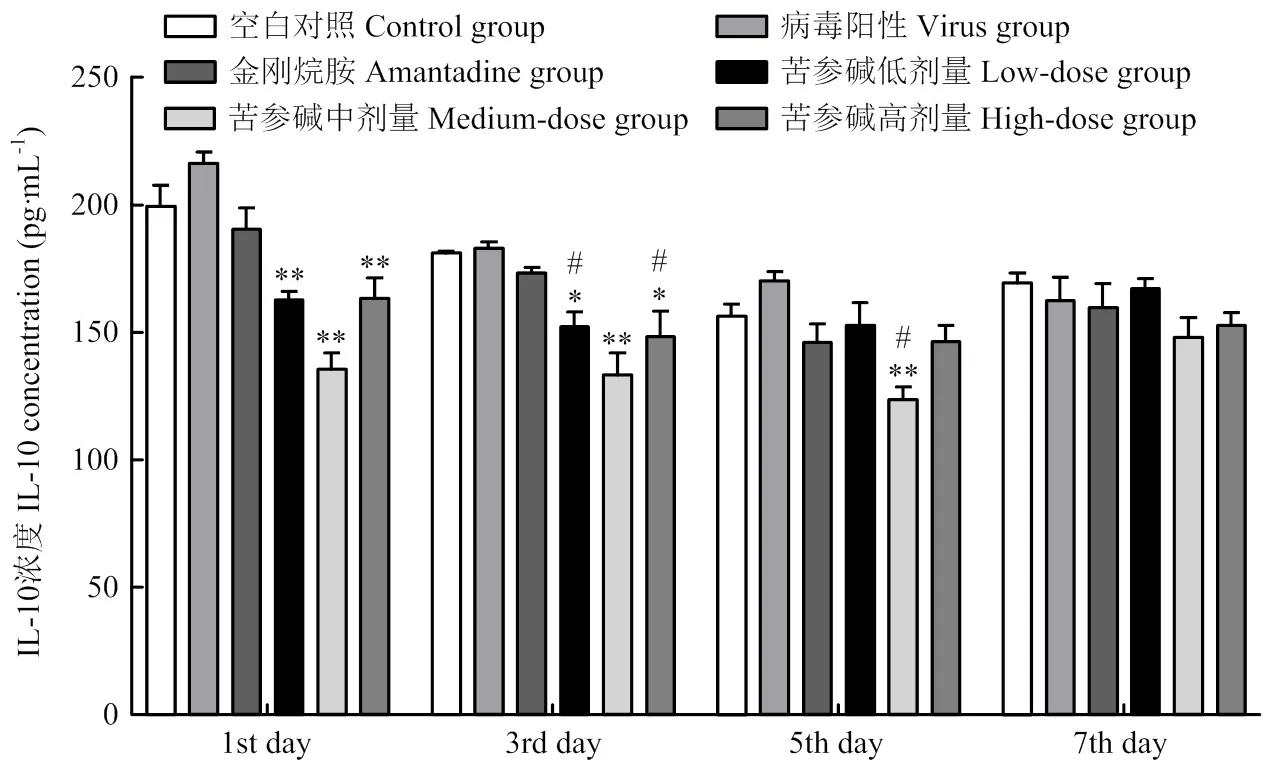
与病毒组比较*P<0.05;**P<0.01;与对照组比较#P<0.05;##P<0.01
3 讨论
研究证实,一些中药有独特的抗病毒作用,从中医学角度,这些中药可以清除体内里热炽盛瘟疫之邪,祛邪兼扶正(机体免疫力)。禽流感病毒侵入机体后,并不直接造成细胞损伤,更基于机体炎症反应所致的免疫病理损伤[11]。苦参碱是从中药苦参的果实或根茎中提取出来的一种生物碱,其药理作用包括抗炎[12-13]、促凋亡[14]、抗氧化[15]、免疫调节[16]、抗病毒[17]、抗肿瘤[18]、抗增殖[19]、抗过敏、抗纤维化和心血管保护作用[20],其中抗病毒作用尤为明显。本研究用H9N2 AIV攻毒小鼠建立急性肺损伤模型,探讨苦参碱对于H9N2 AIV感染的治疗机制,可以进一步完善中药抗病毒的理论基础,对于研发新型抗病毒药物具有重要的意义。
3.1 苦参碱可以减轻H9N2 AIV造成的小鼠肺损伤
病理组织学检测结果显示,苦参碱可以减轻H9N2 AIV感染导致的肺水肿和肺出血,减少肺部炎性细胞的浸润,从而缓解病毒性肺炎的症状。其中高浓度组和中浓度组的治疗效果尤为显著,经高浓度苦参碱治疗的小鼠肺组织与空白组和金刚烷胺组相近。
3.2 苦参碱可以直接抑制H9N2 AIV
荧光定量PCR检测结果显示,苦参碱对于H9N2 AIV的直接抑制作用也较为显著,苦参碱高浓度和中浓度的连续治疗使感染H9N2 AIV的小鼠肺部H9N2病毒基因的表达量大幅度降低,其抑制效果与金刚烷胺十分接近。但低浓度的苦参碱治疗效果并不理想,我们推测苦参碱的治疗效果与药物浓度有关。
3.3 苦参碱抑制H9N2 AIV感染小鼠肺组织中NLRP3基因的表达
NLRP3炎性体是由NLRP3蛋白、凋亡相关微粒蛋白(ASC)、Caspase-1蛋白组成的蛋白复合体,是NOD样受体家族的一员,天然免疫系统的重要组成部分。流感病毒的入侵会激活NLRP3炎性体,使其过表达[21],而NLRP3炎性体信号通路调控细胞因子IL-1β、IL-18成熟的机制具有双面性,过度表达的NLRP3炎性体会导致细胞因子IL-1β、IL-18过量释放,出现剧烈的炎症反应,造成过度的炎性细胞募集、浸润,形成过度组织损伤的病理情况[22]。本研究显示,苦参碱可以抑制H9N2 AIV感染小鼠肺组织内NLRP3基因的表达,经过连续治疗之后,苦参碱高浓度组和金刚烷胺组的小鼠NLRP3基因表达量明显降低,且在药物的安全浓度范围内,苦参碱的浓度越高,抑制H9N2 AIV感染小鼠肺组织中NLRP3基因的表达的效果越好。
3.4 苦参碱抑制H9N2 AIV感染小鼠肺组织内NLRP3炎性体信号通路
NF-κB蛋白是NLRP3炎性体信号通路的上游蛋白,也是激活NLRP3炎性体的蛋白,NLRP3蛋白是NLRP3炎性体的组成蛋白之一[23-26],而Caspase-1蛋白是NLRP3炎性体发挥作用的功能蛋白,它控制着细胞因子IL-1β和IL-18的成熟[6-7]。结果显示,H9N2 AIV感染的小鼠肺部NLRP3炎性体相关的NF-κB、NLRP3、Caspase-1蛋白的表达量比空白组都出现过高的表达,这表明H9N2 AIV感染小鼠会激活NLRP3炎性体信号通路,使信号通路相关蛋白出现过表达的情况。而经过苦参碱治疗后,H9N2 AIV感染小鼠肺部NF-κB、NLRP3、Caspase-1三个NLRP3炎性体信号通路相关蛋白的表达都出现了大幅度下降。表明苦参碱可以抑制H9N2 AIV感染小鼠肺组织内NLRP3炎性体信号通路,在药物的安全浓度范围内,抑制效果跟苦参碱的浓度有关,苦参碱浓度越高抑制效果越好。
3.5 苦参碱抑制TNF-α、IL-1β和IL-10的表达
TNF-α、IL-1β和IL-10的过表达引发难以逆转的细胞因子风暴(CS),形成病毒性肺炎和急性肺损伤(ALI)[27-30]。所以控制TNF-α、IL-1β和IL-10等细胞因子过表达是治疗病毒性肺炎的关键。小鼠血清的ELISA检测显示,苦参碱通过抑制TNF-α、IL-1β和IL-10的表达从而减轻小鼠肺部炎症反应,减少小鼠肺部炎性细胞募集,达到治疗H9N2引起的BALB/c小鼠病毒性肺炎的目的。
4 结论
揭示了中药苦参碱可以减轻炎症造成的机体损伤,抑制TNF-α、IL-1β和IL-10的表达,且在药物的安全浓度范围内,对H9N2 AIV感染小鼠肺组织内NLRP3炎性体信号通路的抑制效果跟苦参碱的浓度有关,苦参碱浓度越高抑制效果越好。
[1] 陈超, 池晓娟, 白庆玲, 陈吉龙. 甲型流感病毒感染过程中干扰素介导的天然免疫应答机制. 生物工程学报, 2015, 31(12): 1671-1681. doi:10.13345/j.cjb.150296.
CHEN C, CHI X J, BAI Q L, CHEN J L. Mechanisms underlying interferon-mediated host innate immunity during influenza A virus infection. Chinese Journal of Biotechnology, 2015, 31(12): 1671-1681. doi:10.13345/j.cjb.150296. (in Chinese)
[2] 张雨婷, 韩旭. 流感病毒性肺炎与细菌性肺炎的临床特点分析. 中国基层医药, 2020, 27(8): 932-935. doi:10.3760/cma.j.issn.1008- 6706.2020.08.009.
ZHANG Y T, HAN X. Analysis of the different clinical characteristics between influenza virus pneumonia and bacterial pneumonia. Chinese Journal of Primary Medicine and Pharmacy, 2020, 27(8): 932-935. doi:10.3760/cma.j.issn.1008-6706.2020.08.009. (in Chinese)
[3] 秦颖, 赵伟. NLRP3炎症小体的负向调控机制. 中国科学: 生命科学, 2018, 48(11): 1187-1196.
QIN Y, ZHAO W. Negative regulatory mechanisms of NLRP3 inflammasome. Scientia Sinica (Vitae), 2018, 48(11): 1187-1196. (in Chinese)
[4] TATE M D, ONG J D H, DOWLING J K, MCAULEY J L, ROBERTSON A B, LATZ E, DRUMMOND G R, COOPER M A, HERTZOG P J, MANSELL A. Reassessing the role of the NLRP3 inflammasome during pathogenic influenza A virus infection via temporal inhibition. Scientific Reports, 2016, 6: 27912. doi:10.1038/ srep27912.
[5] 李卫东, 颜源均, 赵世桥, 冯尧, 蒲志强, 冯飞. NLRP3对病毒感染心肌细胞凋亡及炎症反应的作用. 西部医学, 2021, 33(7): 963-969. doi:10.3969/j.issn.1672-3511.2021.07.006.
LI W D, YAN Y J, ZHAO S Q, FENG Y, PU Z Q, FENG F. Effect of NLRP3 on inflammatory response and apoptosis of cardiomyocytes with virus infection. Northwest Pharmaceutical Journal, 2021, 33(7): 963-969. doi:10.3969/j.issn.1672-3511.2021.07.006. (in Chinese)
[6] 宋祯彦, 夏小芳, 王玉珂, 郑雨珊, 陈佩莹, 罗德勇, 贺春香, 于文静, 李平, 成绍武. 当归芍药散通过调控NLRP3/Caspase-1信号通路抑制AD大鼠神经炎症的作用. 中国实验方剂学杂志, 2021, 27(19): 1-8. doi:10.13422/j.cnki.syfjx.20211802.
SONG Z Y, XIA X F, WANG Y K, ZHENG Y S, CHEN P Y, LUO D Y, HE C X, YU W J, LI P, CHENG S W. Danggui Shaoyaosan inhibits neuroinflammation in AD rats by regulating NLRP3/caspase-1 pathway. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(19): 1-8. doi:10.13422/j.cnki.syfjx.20211802. (in Chinese)
[7] 董婉茹, 李寒, 李云凤, 王宁, 马伯艳, 陆阁玲, 辛相如, 陈冰冰. 基于骨骼肌NLRP3/caspase-1/IL-1β、IL-18通路的黄连温胆汤改善IGT机制研究. 中国中药杂志, 2021, 46(17): 4480-4487. doi:10. 19540/j.cnki.cjcmm.20210621.401.
DONG W R, LI H, LI Y F, WANG N, MA B Y, LU G L, XIN X R, CHEN B B. Mechanism of Huanglian Wendan Decoction in improving impaired glucose tolerance based on skeletal muscle NLRP3/caspase-1/IL-1β, IL-18 pathway. China Journal of Chinese Materia Medica, 2021, 46(17): 4480-4487. doi:10.19540/j.cnki.cjcmm. 20210621.401. (in Chinese)
[8] 魏小林, 谢敏. NALP3炎性复合体与MAPK、NF-κB及ROS信号通路之间的关系. 国际呼吸杂志, 2015, 35(6): 476-480. doi:10. 3760/cma.j.issn.1673-436X.2015.06.017.
WEI X L, XIE M. Relationship between NALP3 inflammasome and MAPK, NF-κB, ROS signal pathway. International Journal of Respiration, 2015, 35(6): 476-480. doi:10.3760/cma.j.issn.1673-436X. 2015.06.017. (in Chinese)
[9] SUN P P, SUN N, YIN W, SUN Y G, FAN K H, GUO J H, KHAN A, HE Y M, LI H Q. Matrine inhibits IL-1β secretion in primary porcine alveolar macrophages through the MyD88/NF-κB pathway and NLRP3 inflammasome. Veterinary Research, 2019, 50(1): 53. doi:10. 1186/s13567-019-0671-x.
[10] 庞博, 董军杰, 庞国勋. 清热解毒类中药的药理作用及临床应用探讨. 临床合理用药杂志, 2013, 6(31): 180-181. doi:10.15887/j.cnki. 13-1389/ r.2013.31.017.
PANG B, DONG J J, PANG G X. Pharmacological action and clinical application of traditional Chinese medicine for clearing heat and detoxification. Chinese Journal of Clinical Rational Drug Use, 2013, 6(31): 180-181. doi:10.15887/j.cnki.13-1389/r.2013.31.017. (in Chinese)
[11] COOK D N, BECK M A, COFFMAN T M, KIRBY S L, SHERIDAN J F, PRAGNELL I B, SMITHIES O. Requirement of MIP-1 alpha for an inflammatory response to viral infection. Journal of Medicinal Chemistry, 1995, 269(5230): 1583-1585. doi:10.1126/ science.7667639.
[12] GUZMAN J R, KOO J S, GOLDSMITH J R ", MÜHLBAUER M, NARULA A, JOBIN C. Oxymatrine prevents NF-κB nuclear translocation and ameliorates acute intestinal inflammation. Scientific Reports, 2013, 3: 1629. doi:10.1038/srep01629.
[13] LIANG J, CHANG B Y, HUANG M C, HUANG W C, MA W K, LIU Y, TAI W, LONG Y, LU Y. Oxymatrine prevents synovial inflammation and migration via blocking NF-κB activation in rheumatoid fibroblast- like synoviocytes. International Immunopharmacology, 2018, 55: 105-111. doi:10.1016/j.intimp.2017.12.006.
[14] ZHANG Y, SUN S G, CHEN J, REN P C, HU Y S, CAO Z, SUN H H, DING Y. Oxymatrine induces mitochondria dependent apoptosis in human osteosarcoma MNNG/HOS cells through inhibition of PI3K/Akt pathway. Tumor Biology, 2014, 35(2): 1619-1625. doi:10. 1007/s13277-013-1223-z.
[15] JIANG G J, LIU X H, WANG M, CHEN H, CHEN Z Y, QIU T. Oxymatrine ameliorates renal ischemia-reperfusion injury from oxidative stress through Nrf2/HO-1 pathway. Acta Cirurgica Brasileira, 2015, 30(6): 422-429. doi:10.1590/S0102-865020150060000008.
[16] YAO N, WANG X.immunomodulatory activity of oxymatrine on Toll-like receptor 9 signal pathway in chronic hepatitis B. The American Journal of Chinese Medicine, 2014, 42(6): 1399-1410. doi:10.1142/s0192415x14500888.
[17] SHI L J, SHI L, SONG G Y, ZHANG H F, HU Z J, WANG C, ZHANG D H. Oxymatrine attenuates hepatic steatosis in non- alcoholic fatty liver disease rats fed with high fructose diet through inhibition of sterol regulatory element binding transcription factor 1 (Srebf1) and activation of peroxisome proliferator activated receptor alpha (Pparα). European Journal of Pharmacology, 2013, 714(1/2/3): 89-95. doi:10.1016/j.ejphar.2013.06.013.
[18] LIU Y, XU Y, JI W D, LI X Y, SUN B, GAO Q G, SU C Q. Anti-tumor activities of matrine and oxymatrine: Literature review. Tumor Biology, 2014, 35(6): 5111-5119. doi:10.1007/s13277-014-1680-z.
[19] FEI Z W, QIU M K, QI X Q, DAI Y X, WANG S Q, QUAN Z W, LIU Y B, OU J M. Oxymatrine suppresses proliferation and induces apoptosis of hemangioma cells through inhibition of HIF-1a signaling. International Journal of Immunopathology and Pharmacology, 2015, 28(2): 201-208. doi:10.1177/0394632015578342.
[20] WEN J B, ZHU F Q, CHEN W G, JIANG L P, CHEN J, HU Z P, HUANG Y J, ZHOU Z W, WANG G L, LIN H, ZHOU S F. Oxymatrine improves intestinal epithelial barrier function involving NF-κB-mediated signaling pathway in CCl4-induced cirrhotic rats. PLoS One, 2014, 9(8): e106082. doi:10.1371/journal.pone.0106082.
[21] 孙娜. 苦参碱抗PRRSV/PCV2共感染及其作用机制[D]. 太谷: 山西农业大学, 2016.
SUN N. Matrine inhibited co-infection of PRRSV/PCV2and its mechanism[D]. Taigu: Shanxi Agricultural University, 2016. (in Chinese)
[22] 王伟, 丁萌楠, 张敏, 张艺凡, 孟凡飞, 徐欢, 张冲冲, 卢春凤, 宋伦. 热应激通过激活NLRP3/IL-1β/IL-6途径介导肝脏炎症损伤效应. 军事医学, 2021, 45(7): 481-484. doi:10.7644/j.issn.1674-9960. 2021.07.001.
WANG W, DING M N, ZHANG M, ZHANG Y F, MENG F F, XU H, ZHANG C C, LU C F, SONG L. Heat stress mediates hepatic inflammatory injury by activating the NLRP3/IL-1β/IL-6 pathway. Military Medical Sciences, 2021, 45(7): 481-484. doi:10.7644/j.issn. 1674-9960.2021.07.001. (in Chinese)
[23] YANG Y, WANG H N, KOUADIR M, SONG H H, SHI F S. Recent advances in the mechanisms of NLRP3 inflammasome activation and its inhibitors. Cell Death & Disease, 2019, 10(2): 128. doi:10.1038/ s41419-019-1413-8.
[24] LUO M, YAN D, SUN Q, TAO J, XU L, SUN H, ZHAO H. Ginsenoside Rg1 attenuates cardiomyocyte apoptosis and inflammation via the TLR4/NF-kB/NLRP3 pathway. Journal of Cellular Biochemistry, 2020, 121(4): 2994-3004. doi:10.1002/jcb.29556.
[25] 顾晓凌, 宋勇. NALP3炎性体在急性肺损伤中的研究进展. 中国呼吸与危重监护杂志, 2012, 11(6): 607-609.
GU X L, SONG Y. Research progress of nalp3 inflammatory body in acute lung injury. Chinese Journal of Respiratory and Critical Care Medicine, 2012, 11(6): 607-609. (in Chinese)
[26] ZHANG R H, AI X, DUAN Y J, XUE M, HE W X, WANG C L, XU T, XU M J, LIU B J, LI C H, WANG Z J, ZHANG R H, WANG G H, TIAN S F, LIU H F. Kaempferol ameliorates H9N2 swine influenza virus-induced acute lung injury by inactivation of TLR4/MyD88- mediated NF-κB and MAPK signaling pathways. Biomedicine & Pharmacotherapy, 2017, 89: 660-672. doi:10.1016/j.biopha.2017.02. 081.
[27] WANG Q, LIN B F, LI Z F, SU J, FENG Y L. Cichoric acid ameliorates monosodium urate-induced inflammatory response by reducing NLRP3 inflammasome activation via inhibition of NF-B signaling pathway. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 8868527. doi:10.1155/2021/ 8868527.
[28] 陈娇, 钱晓明, 聂时南. 急性肺损伤动物模型的研究现状. 医学研究生学报, 2013, 26(8): 851-854. doi:10.16571/j.cnki.1008-8199.2013. 08.008.
CHEN J, QIAN X M, NIE S N. Current situation of the research about the animal models of acute lung injury. Journal of Medical Postgraduates, 2013, 26(8): 851-854. doi:10.16571/j.cnki.1008-8199. 2013.08.008. (in Chinese)
[29] 李俏琦, 杨茜, 高玲, 易成, 黄英. 细胞因子风暴与病毒性肺炎. 中国呼吸与危重监护杂志, 2021, 20(1): 70-75.
LI Q Q, YANG X, GAO L, YI C, HUANG Y. Cytokine storm and viral pneumonia: a review. Chinese Journal of Respiratory and Critical Care Medicine, 2021, 20(1): 70-75. (in Chinese)
[30] 魏东, 刘英, 贾宁, 徐彤, 刘贵河. H9N2亚型猪流感病毒诱导小鼠急性肺损伤中TNF-α、IL-1β、IL-6和IL-10的变化和作用. 中国实验动物学报, 2013, 21(2): 72-74. doi:10.3969/j.issn.1005-4847. 2013.02.015.
WEI D, LIU Y, JIA N, XU T, LIU G H. Changes and roles of TNF-α, IL-1β, IL-6 and IL-10 in acute lung injury induced by H9N2 subtype swine influenza virus in mice. Acta Laboratorium Animalis Scientia Sinica, 2013, 21(2): 72-74. doi:10.3969/j.issn.1005-4847.2013.02.015. (in Chinese)
Effect of Matrine on NLRP3 Inflammasome Signaling Pathway in H9N2 AIV Infected Mice
WEI JingJie, JIANG NingBo, LIANG Yan, ZHANG Qian, SUN YingJian, HU Ge
College of Animal Science and Technology, Beijing University of Agriculture, Beijing 102206
【Objective】Influenza virus infection causes inflammatory response and imbalance of immune homeostasis. The resulting cytokine storm (CS) is the main cause of death of infected hosts. The aim of this study was to explore the protective effect of Matrine on H9N2 AIV infected mice as well as the characteristics and preliminary mechanism of regulating NLRP3 inflammatory body signal pathway, so as to further improve the theoretical basis of antiviral of traditional Chinese medicine and lay a foundation for the development of new antiviral drugs.【Method】72 8-week-old BALB/c mice were randomly divided into blank control group (0.1 ml sterile chicken embryo allantoic fluid) and virus group (0.1 ml 4×105PFU/ml H9N2 AIV), amantadine group (0.1 ml 4×105PFU/ml H9N2 AIV + 100×10-699% amantadine), matrine high concentration treatment group (0.1 ml 4×105PFU/ml H9N2 AIV + 40 ml·kg-1matrine), medium concentration treatment group (0.1 ml 4×105PFU/mlH9N2 AIV + 20 ml·kg-1matrine), and low concentration treatment group (0.1 ml 4×105PFU/ml H9N2 AIV + 10 ml·kg-1matrine), and allantoic fluid nasal drops were used to construct the mouse model of viral pneumonia. The matrine was administered by gavage or drinking water for 5 consecutive days, and the test was conducted for 7 days. The weight changes of mice in different groups were observed. On the 1st, 3rd, 5th and 7th days, three mice were aseptically collected and killed, and the lung tissue was taken for histopathological observation, the expression of H9N2 and NLRP3 gene in mouse lung tissues was detected by RT-PCR, the expression of NLRP3 inflammatory body signal pathway related protein in lung tissue of H9N2 infected mice after matrine treatment was detected by Western blot, and the cytokine TNF in mouse serum was measured by ELISA- α and IL-1 βchanges in the expression of IL-18 and IL-10.【Result】Compared with the virus group, the area of pulmonary edema and the number of inflammatory cells in the pathological section of H9N2 AIV infected mice in the high concentration matrine treatment group were significantly reduced, and the exudation of red blood cells decreased, while the effect was close to that in the amantadine group. At day 7, the alveolar wall of mice in the high concentration matrine treatment group was intact, the boundary between alveoli was clear, and the number of inflammatory cells and plasma cells in lung tissue decreased significantly, which was almost the same as that in the blank group; in the treatment group with medium concentration of matrine, there was a small amount of bleeding in the lung tissue, there was no swollen fluid in the alveoli, and the alveolar septum was intact; in the low concentration matrine treatment group, the red blood cells exuded from the alveoli, a large number of plasma cells were recruited, and there was fusion between the alveoli. The expression of H9N2 virus gene in lung tissue of mice treated with Matrine and amantadine decreased significantly on day 3, 5 and 7 (<0.01). After 3 and 5 days of treatment, the expression of NLRP3 gene, protein and TNF- α, IL-1 β in matrine high concentration treatment group and amantadine group decreased significantly (<0.01); on day 7, the expression of NLRP3 gene in lung tissue of mice in matrine high, medium and low treatment groups decreased significantly (<0.01); the expression of NLRP3 protein, caspase-1 protein in low concentration group and caspase-1 protein in medium concentration group decreased significantly on day 5 (<0.05); the expression of TNF- α and IL-1 β in matrine medium and low concentration groups on days 3 and 5 decreased significantly (<0.01).The expression of IL-10 in Shegan medium concentration treatment group decreased significantly.【Conclusion】Matrine could inhibit the expression of H9N2 AIV in vivo, reduce the expression of TNF-α, IL-1β and IL-10 by down regulating NLRP3 inflammatory body signal pathway related proteins, and reduce the inflammatory response, which had good antiviral and anti-inflammatory effects.
matrine; H9N2 AIV; NLRP3 inflammasome signaling pathway

10.3864/j.issn.0578-1752.2022.21.017
2021-08-17;
2022-02-18
北京市自然科学基金B类重点项目(KZ201510020020)
魏婧洁,E-mail:329974543@qq.com。蒋宁波,E-mail:1176693232@qq.com。魏婧洁和蒋宁波为同等贡献作者。通信作者胡格,E-mail:bnhuge@126.com
(责任编辑 林鉴非)

