现场快速评估技术在乳腺癌前哨淋巴活检术中的应用价值研究*
汤琦 李惠 晋萍 张祥武 唐一吟 周绍强 陈德滇
随着乳腺癌诊疗水平提高,越来越多的早期乳腺癌患者可通过行前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)免于不必要的腋窝淋巴结清扫术(axillary lymph node dissection,ALND),减少上肢水肿的的发生,提高生存质量[1-3]。前哨淋巴结(sentinel lymph node biopsy,SLN)病理检查常用的方法包括术中快速病理法(冷冻法)、印片细胞学法(imprint cytology,IC),术后石蜡切片法、RT-PCR 检测CK19 及术后免疫组织化学法等[4]。根据《中国抗癌协会乳腺癌诊治指南与规范(2021 年版)》,冷冻法和(或)IC 均作为SLN 术中诊断的常规检测方法[5]。现场快速评估(rapid on-site evaluation,ROSE)是一种可在手术现场利用Diff-Quick(DQ)细胞染色液对IC 进行快速染色及对标本快速评估的诊断技术。目前,ROSE 技术主要应用于超声支气管镜的辅助检查[6-7],而应用于乳腺癌SLNB 国内外尚鲜见。本研究旨在通过ROSE技术对乳腺癌SLNB 进行评估,并联合冰冻检查,对SLN 是否转移进行术中快速诊断,探讨该技术在乳腺癌SLNB 中的临床应用及推广价值。
1 材料与方法
1.1 临床资料
纳入2019 年12 月至2021 年12 月于云南省肿瘤医院确诊的早期乳腺癌患者共375 例,均为女性,分为行SLNB 组195 例(A 组)、新辅助化疗后行SLNB 组180 例(B 组),中位年龄A 组为55 岁、B 组为56 岁。纳入标准:1)A、B 组患者均为经病理证实为原发性乳腺癌可行手术的患者;2)A 组患者临床体格检查和影像学检查均提示腋窝淋巴结阴性,B 组患者符合新辅助化疗条件[5]且病理证实腋窝淋巴结转移。排除标准:1)既往有过患侧腋窝、内乳或胸部手术史;2)处于妊娠期或哺乳期女性;3)曾行放疗、化疗;4)合并其他肿瘤病史。本研究获得本院伦理委员会批准和患者的知情同意。
1.2 方法
1.2.1 研究方案 A 组患者均为临床腋窝淋巴结阴性,所有检出SLN 均术中行ROSE 评估,并联合冰冻检查,95% 乙醇固定后,IC 行细胞学巴氏染色及H&E 染色比较,术后常规行石蜡切片病理检查;B 组患者均行新辅助化疗,化疗前均行腋窝淋巴结穿刺,临床分期(c)T1~3N1~2M0 患者参照 Judy 等[8]研究行SLNB 及ALND,检出的SLN 处理同A 组患者。
1.2.2 SLN 获取 术中常规消毒铺巾,SLN 示踪剂1~2 mL 注射于乳晕区或肿瘤表面皮内或皮下,适当按压,10~15 min 后手术切取SLN[9]。所有患者均获取 SLN 枚数>2 枚。
1.2.3 制片 将所取SLN 沿长轴以2 mm 间隔分切,每一个切面均在黏附玻片上印1 个印迹,每个淋巴结印3 个玻片。玻片1 进行ROSE 染色,玻片2、3 以95%乙醇固定,行细胞学巴氏染色及H&E 染色(作为ROSE 技术准确性验证),组织切块按照顺序标记后依次送术中冷冻检查,术后石蜡切片病理检查。
1.2.4 染色 1)将标记的IC 玻片1 于DQ 的A 溶液中染色(玻片在染液中上下6~8 次或浸泡10~20 s);2)将玻片置于磷酸盐缓冲溶液中洗净,可稍甩干;3)再将玻片浸泡于DQ 的 B 溶液中,方法同DQ的A 溶液;4)干燥玻片,及时镜检。所需试剂:DQ 的A 溶液(主要成分为曙红、甲醇),DQ 的 B 溶液(主要成分为亚甲蓝)及磷酸盐缓冲液。
1.2.5 检测 以淋巴结为单位,ROSE 染色在IC 任何一个切面中可见癌细胞判为转移,未见癌细胞判为未转移,可疑癌细胞等待冰冻进一步确认。SLNB 可见转移者,根据《中国抗癌协会乳腺癌诊治指南与规范(2021 年版)》[5],即刻对有必要的患者实施ALND。
1.2.6 ROSE 技术质量控制 SLN 取材后立即由术者在病理医师协助下,于手术室进行现场制片、染色,现场通过倒置显微镜观察,病理医师进行诊断,确保过程严格规范。IC 后SLN 送术中冰冻、细胞学巴氏染色、H&E 染色及术后石蜡切片病理检查。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析ROSE 诊断效能,计算 ROC 曲线下面积(area under curve,AUC)的 95%CI 并分别进行比较,采用 Medcalc V19.0.4 软件进行Z检验。敏感度=真阳性例数/(真阳性+假阴性)例数×100%,特异度=真阴性例数/(真阴性+假阳性)例数×100%,诊断准确率=(真阳性+真阴性)例数/总例数×100%。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者基本特征
375 例患者的基本特征见表1。

表1 375 例乳腺癌患者基本特征
2.2 SLNB 后镜下所见
每例患者术中常规取2~6 枚SLN,A 组和B 组患者分别共取SLN 为444 枚和479 枚。术中IC 行ROSE 染色,诊断平均时间为6.53 min/例(术中冰冻平均时间为36.42 min/例),A、B 组操作流程见图1。如SLN 未见转移,镜下可清晰见到背景干净无沉渣、紫兰色大小一致的淋巴结细胞(图2);如SLN 可见转移,镜下可明确见到癌细胞深染,聚集呈“桑椹样”团块(图3),癌细胞呈异型性,较正常淋巴结细胞增大,形态不一,细胞核及细胞质比例增高,细胞核可见多形性、深染、染色质粗颗粒状、分布不均、核仁明显、体积大,核分裂像增多。术中使用示踪剂患者分别为亚甲蓝63%(236/375),纳米碳17%(64/375),核素联合蓝染料14%(52/375),吲哚菁绿(ICG)荧光法6%(23/375),采用不同示踪剂获取的SLN 对ROSE 评估诊断无影响。

图1 研究方案操作流程

图2 行SLNB 未见转移的正常SLN 细胞

图3 行SLNB 可见转移的SLN 细胞
2.3 两组的比较
A 组患者共取SLN 为 444 枚,经ROSE 诊断转移SLN 为30 枚,术后石蜡病理检查确认转移ALN为 34 枚;B 组患者共取SLN 为479 枚,经ROSE 诊断转移SLN 为 91 枚,术后石蜡病理检查确认转移ALN 为 97 枚(表2)。以术后石蜡病理检查作为金标准,绘制ROC 曲线,计算两组4 种诊断方法的AUC、敏感度、特异度,与术后石蜡病理检查诊断进行比较差异均无统计学意义。ROSE 技术的诊断效能与其他诊断方法一致(表3)。本研究发现,B 组0.8%(4/479)转移淋巴结新辅助化疗后可见退化坏死(图4)。新辅助化疗后未对SLN 经IC 行ROSE 诊断造成不良影响。
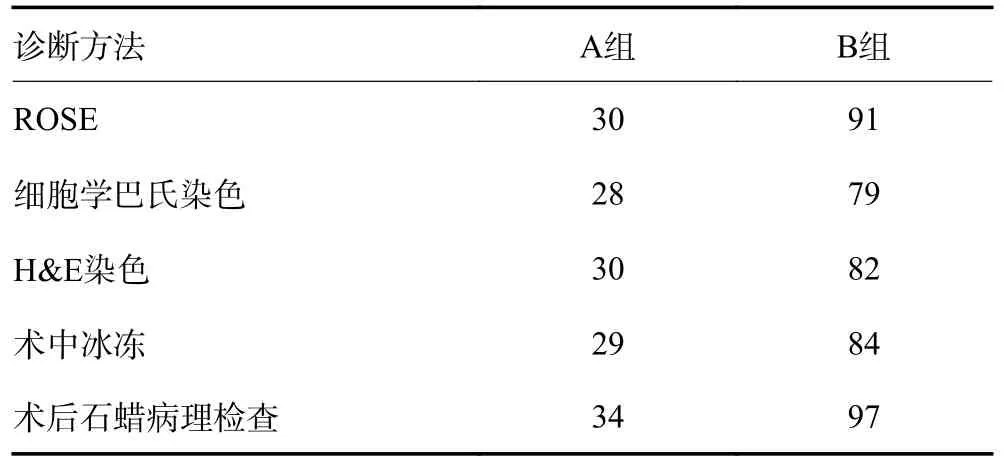
表2 各诊断技术可见转移SLN 数目(枚)
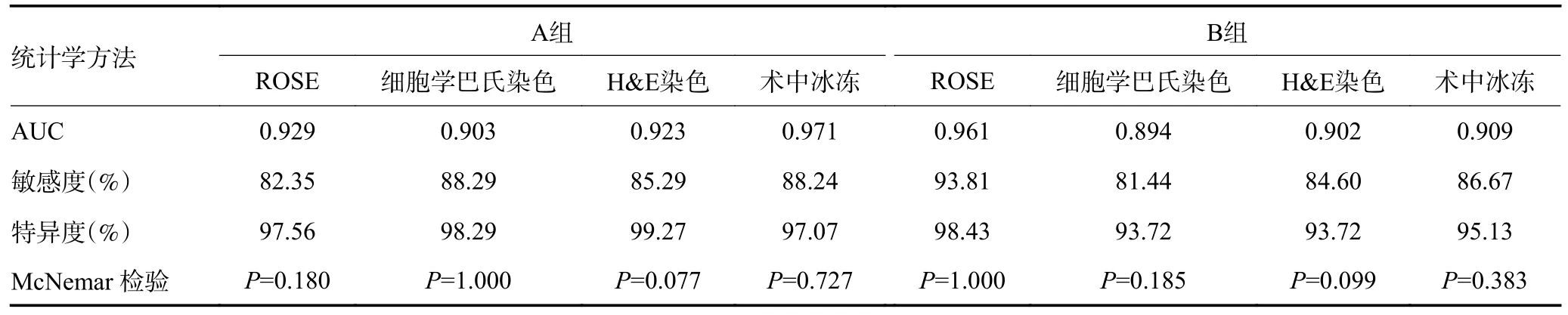
表3 各诊断技术Z 检验及McNemar 检验比较

图4 新辅助化疗后ROSE 染色的SLN 转移可见部分退化坏死(ROSE×40)
3 讨论
IC 与冰冻均是术中评估乳腺癌SLN 的可靠方法,可作为SLN 转移而行ALND 的依据[9]。ROSE 可作为一种IC 快速染色的新技术联合冰冻应用于乳腺癌SLNB 诊断[10]。与其他诊断技术相比,IC 对SLN 转移具有高度特异度,本研究采用ROSE 技术的A、B 组特异度分别为97.56%、98.43%,与Petropoulou 等[11]研究发现行IC 的特异度高达 98.75%相一致。以术后石蜡病理检查作为金标准,ROSE 技术显示出等同于冰冻、细胞学巴氏染色及H&E 染色的诊断效能,且不同示踪剂对于ROSE 染色均无不良影响。
研究显示,术中冰冻联合其他诊断技术评估SLN 可提高诊断敏感度[12]。本研究ROSE 技术与冰冻检查相结合,在提高准确性同时,提高了诊断效率。ROSE 平均用时6.53 min/例即可诊断,若ROSE 结果为阴性,患者可转至复苏室等待冰冻结果,二者均为阴性则手术结束,加快了手术室的周转利用;若ROSE明确1~2 枚及以上SLN 转移,且术前评估不能行术后放疗的患者,则可即刻实施ALND[9],减少不必要麻醉等待时间(平均29.89 min/例)。
ROSE 所需设备仅一台倒置显微镜,试剂价格低廉易获取、储存要求低,试剂及显微镜均可常备置于手术室。其染色方法步骤简单,学习曲线短,不同示踪剂不影响染色效果,染色制片后便可于手术室现场由病理科医师对SLN 是否转移进行诊断。
目前,ROSE 技术存的局限性主要因孤立肿瘤细胞蔟(isolated tumor cells,ITCs)以及肿瘤大小≤2.0 mm微转移病灶的癌细胞簇的体积极小,难以在玻片上留下印迹,可能影响IC 导致术中ROSE 的假阴性(false negative,FN)。但跟据《中国抗癌协会乳腺癌诊治指南与规范(2021 年版)》,仅有ITCs 的淋巴结不判定为SLN 转移,无需行ALND,因此对术中术式的抉择不会造成不良影响;对于肿瘤大小≤2.0 mm 微转移病灶,因术中ROSE 与冰冻检查相结合,亦可确保术中进一步的策略选择[13]。
本研究发现,新辅助化疗后 0.8%(4/479)极低比例的转移SLN 经新辅助化疗后呈退化坏死,但未对ROSE 诊断的准确性造成不良影响。本研究对于初诊确认腋窝淋巴结阳性患者行新辅助化疗后,对腋窝淋巴结处理较为谨慎,均给予ALND。ROSE 技术的开展,且与冰冻检查相结合,可为后续提高术前cN1、经新辅助化疗病理分期(yp)N0 患者的豁免ALND 提供更为准确及可靠的依据。
综上所述,ROSE 作为一种新的评估方法联合冰冻用于乳腺癌SLNB,具有良好的临床应用前景及推广价值。

