SMI 和CDFI 检测联合GI-RADS 对卵巢肿瘤良恶性评估的研究*
陈兰 闫磊 张慧颖 张晓亮 王君
卵巢癌是女性生殖系统三大恶性肿瘤之一,占女性死亡第5 位,5 年生存率仅50%左右[1]。卵巢癌的早期症状较为隐匿,患者因不适就诊时已发展为晚期,治疗难度大、预后差、复发率高[2]。早期筛查并准确评估肿瘤良恶性是临床治疗的关键,而卵巢肿瘤类型复杂、诊断难度较高,如何提高诊断结果的准确性是医学领域的重点和难点[3]。近年来,妇科影像报告和数据系统(gynecologic imaging reporting and data system,GI-RADS)分类方法,可有效鉴别肿瘤良恶性。超微血管成像(super micro-vascular imaging,SMI)是在彩色多普勒超声血流显像(color Doppler flow imaging,CDFI)基础上发展的一种新型彩色血流成像技术,能及时发现低速血流,实时监测病变组织微细血液循环灌注情况,多切面观察病灶,为临床鉴别卵巢肿瘤良恶性提供参考[4]。目前,SMI 已用于乳腺肿瘤良恶性[5]、宫颈癌分期[6]评估中,具有较高的敏感度,但其对卵巢肿瘤良恶性的鉴别价值较少。本研究旨在通过SMI和CDFI 检测联合GI-RADS 进行比较,探讨SMI 联合GI-RADS 对鉴别卵巢肿瘤良恶性的应用价值。
1 材料与方法
1.1 临床资料
选取2019 年9 月至2021 年3 月于河北省廊坊市人民医院诊治的168 例卵巢肿瘤患者的临床资料,根据术后病理分为恶性组56 例和良性组112 例。恶性组中浆液性腺癌17 例、黏液性癌4 例、浆液性囊腺癌7 例、黏液性囊腺癌17 例、转移性肿瘤2 例、非良性Brenner 瘤4 例、内膜样癌5 例。良性组中浆液性囊腺瘤44 例、畸胎瘤23 例、纤维瘤22 例、卵泡膜细胞瘤8 例、子宫内膜异位10 例、甲状腺肿3 例、结核2 例。纳入标准:1)年龄<70 岁有过性生活史;2)超声检查发现卵巢占位,病灶为实性或囊实性肿瘤,或表现为分隔、壁厚及壁上可见乳头状突起的囊性肿瘤;3)所有患者均获得病理组织诊断结果。排除标准:1)妊娠及哺乳期患者;2)患严重心脏病者。
1.2 方法
1.2.1 超声检查 采用东芝Aplio500 彩色多普勒超声诊断仪,配置SMI 软件和腔内探头(频率为5~9 MHz)。每例患者的肿瘤均由本科2 名至少有7 年妇科超声工作经验的医师分别进行二维灰阶超声、CDFI、SMI 检查,当结果出现分歧时,由2 名医师进行商议,确定最终结果。
1.2.2 保存图像标准 启动CDFI 模式观察病变组织血流情况,避免挤压肿瘤,调整取样框大小,使其包含肿瘤及周边组织1 cm。彩色壁滤波为40~45 Hz,彩色血流速度为15~20 cm/s,采样线和血管之间的角度为0~30°,彩色增益为小血管恰好被检出。观察肿瘤病变内部血管分布,寻找肿瘤内部或边缘血管最丰富的切面,冻结并保存图像。双幅对比模式下启动SMI 模式,参数均与CDFI 相同,冻结保存图像。
1.2.3 血流评估 使用SMI 和CDFI 检测观察同一卵巢肿瘤的血流情况,并采用Adler 血流信号分级标准[7]评估血流的丰富程度。0 级:肿瘤中未发现血流信号;1 级:少量血流,可见1、2 个点状或细短棒状血管;2 级:中量血流,可见3、4 个点状或1 条较长血管(长度接近或超过肿瘤半径为条状血管);3 级:丰富血流,可见5 个及以上点状或2 条及以上较长血管。
1.2.4 GI-RADS 分类 参照陈秋月等[8]研究对GIRADS 进行分类。1~3 类:肿瘤声像图特异、良性征象明显;4~5 类:肿瘤征象存在一定恶性风险,其中4a 类存在1 个、4b 类存在2 个、5 类存在3 个及以上恶性声像图表现。1~4a 类为良性肿瘤,4b~5 类为恶性肿瘤。恶性声像图表现为有分隔、壁厚3 mm 及以上,大乳头状突起物7 mm 及以上,合并腹腔积液,血流阻力的指数在0.5 以下,中心性血流,实性病变(囊性成分在50%以下)。
1.3 统计学分析
采用SPSS 21.0 软件进行统计学分析。计量资料以()表示,采用独立样本t检验;计数资料进行χ2检验,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)进行分析,计算敏感度、特异度和准确率。采用Kappa 检验分析,Kappa 值0~0.40 定义为一致性很差,0.41~0.75 定义为一致性中等,0.76~1.00 定义为一致性较好。以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组年龄及月经情况比较
恶性组和良性组患者的年龄分别为30~70 岁和29~70 岁,绝经患者分别为16 例和35 例,未绝经患者分别为40 例和77 例,两组年龄、绝经情况比较差异均无统计学意义(均P>0.05)。
2.2 两组GI-RADS 分类比较
恶性组和良性组患者的GI-RADS 分类中的1~4a 类分别为7 例和100 例、4b~5 类分别为49 例和12 例,两组比较差异具有统计学意义(χ2=95.184,P<0.001)。在良性卵巢肿瘤超声图像中GI-RADS 分类为4a 类(图1A);CDFI 图显示肿瘤内部及周围血流信号,可见6 个点状血流,Adler 分级为3 级(图1B);SMI 图显示同一肿瘤内部及周围血流信号,可见8 个点状血流信号,Adler 分级为3 级(图1C),与CDFI 显示血流的数量无明显区别。在恶性卵巢肿瘤超声图像中GI-RADS 分类为4c 类(图2A);CDFI 图显示肿瘤内部及边缘血流,可见2 个点状血流,1 个条状血流,Adler 分级为2 级(图2B);SMI 图显示同一肿瘤内可见多发穿支血流,可见6 个点状血流,1 个条状血流,Adler 分级为3 级(图2C),与CDFI 比较显示穿支血管的数目增多。
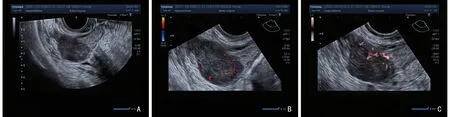
图1 42 岁右侧卵巢纤维瘤患者的超声二维图像及血流图像
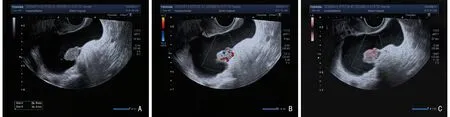
图2 57 岁左侧卵巢高级别浆液性囊腺癌患者的超声二维图像及血流图像
2.3 SMI 和CDFI 检测卵巢良恶性肿瘤的Adler 分级和血管条数比较
采用SMI 和CDFI 检测恶性组患者的肿瘤血流丰富程度显著高于良性组(P<0.05)。恶性组的SMI检测血流的丰富程度显著高于CDFI 检测(P<0.05),良性组的SMI 和CDFI 检测血流的丰富程度进行比较差异无统计学意义(P>0.05)。SMI 和CDFI 检测卵巢良性组和恶性组肿瘤的Adler 分级进行比较差异均具有统计学意义(χ2=82.858、51.198,均P<0.01),SMI 较CDFI 更易检测出恶性肿瘤中Adler 分级为3级的血流(表1)。恶性组的SMI 和CDFI 检测的血管条数均显著高于良性组(P<0.05,表2)。
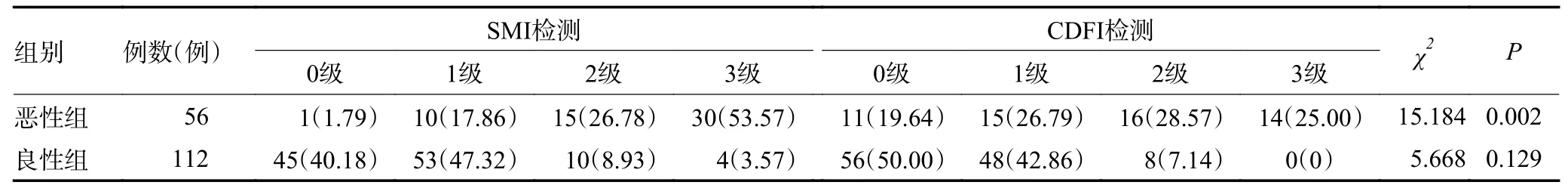
表1 SMI 和CDFI 检测卵巢良恶性肿瘤的Adler 分级比较
表2 SMI 和CDFI 检测两组的血管条数比较()

表2 SMI 和CDFI 检测两组的血管条数比较()
2.4 SMI 联合GI-RADS 和CDFI 联合GI-RADS 预测卵巢恶性肿瘤的ROC 分析
经ROC 分析,SMI 联合GI-RADS 和CDFI 联合GI-RADS 预测卵巢恶性肿瘤的曲线下面积(area under curve,AUC)分别为0.968 和0.890(均P<0.05,表3)。SMI 联合GI-RADS 和CDFI 联合GI-RADS预测卵巢恶性肿瘤的ROC 曲线见图3。
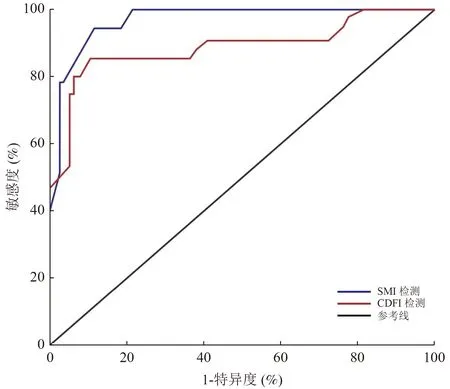
图3 SMI 联合GI-RADS 和CDFI 联合GI-RADS 预测卵巢肿瘤恶性的ROC 曲线

表3 SMI 联合GI-RADS 和CDFI 联合GI-RADS 预测卵巢恶性肿瘤的ROC 分析
2.5 CDFI 联合GI-RADS 和SMI 联合GI-RADS 预测卵巢恶性肿瘤的价值分析
168 例卵巢肿瘤患者中,CDFI 联合GI-RADS 诊断恶性的为53 例,敏感度为94.6%、特异度为93.8%、准确率为94.0%,与病理结果的一致性较好(κ=0.868)。
SMI 联合GI-RADS 诊断恶性的为55 例,敏感度为98.2%、特异度为95.5%、准确率为96.4%,与病理结果的一致性较好(κ=0.921)。2 名医师对于CDFI 联合GI-RADS 和SMI 联合GI-RADS 的诊断一致性均较好(κ=0.803 和κ=0.795)。
3 讨论
卵巢恶性肿瘤多为散发性肿瘤,卵巢癌早期发病隐匿,当患者出现症状时病情已发展为中晚期,患者死亡风险大、预后差。超声检查作为临床筛查技术,在提高超声筛选和鉴别卵巢肿瘤良恶性的敏感度、特异度和准确率上具有重要的临床意义[9-10]。
在GI-RADS 分类的6 个恶性声像图表现中,肿瘤内部血流诊断效能最高,壁厚最低,肿瘤发展过程中会伴随大量新生血管形成,且形成时间早于肿瘤细胞增生,因此内部血流为卵巢肿瘤良恶性的有效预测因素[11-12]。本研究显示,在恶性组中SMI 和CDFI 检测血流的丰富程度显著高于良性组,恶性组的SMI 检测血流的丰富程度显著高于CDFI 检测,恶性组的SMI和CDFI 检测的血管条数均显著高于良性组,提示SMI 可作为鉴别卵巢肿瘤良恶性的有效方法。其原因分析如下:1)新生血管对肿瘤的生长和转移均具有重要作用,卵巢恶性肿瘤中血管丰富程度高[13]。2)CDFI是一项反应肿瘤新生血管丰富程度的检测技术,检测原理是利用红细胞与超声探头相对运动产生的频移来显示血流,并采用壁滤器消除运动伪象和杂波,其血流分级可有效反应血流的丰富程度,以鉴别肿瘤良恶性,但CDFI 无法从真实的血流信号中区分运动伪象,易出现低速血流信息丢失的情况[14]。3)SMI 可分析杂波运动特性,在血流混杂区域对微细血流和组织微小运动产生的频谱信号进行滤波处理,并采用自适应算法消除和识别组织本身运动轨迹,有效减少组织运动杂波影响,呈现出更真实的血流信号,其对卵巢恶性肿瘤组织中血管丰富程度的检测明显优于CDFI,对卵巢肿瘤中Adler 分级为3 级的病变组织检出率更高[15]。4)在良性肿瘤中,血流不丰富,良性组中的SMI 和CDFI 检测血流的丰富程度进行比较差异无统计学意义,SMI 和CDFI 对良性肿瘤的检测能力基本相当。
目前,有关SMI 联合GI-RADS 在良性和恶性卵巢肿瘤评估中的研究较少。本研究显示,SMI 联合GIRADS 和CDFI 联合GI-RADS 鉴别卵巢良恶肿瘤的AUC 分别为0.968 和0.890。在168 例卵巢肿瘤患者中,CDFI 联合GI-RADS 和SMI 联合GI-RADS 诊断恶性分别为53 例和55 例,敏感度分别为94.6%和98.2%、特异度分别为93.8% 和95.5%、准确率分别为94.0% 和96.4%,与病理结果的一致性均较好(κ=0.868 和κ=0.921),表明SMI 联合GI-RADS 预测卵巢恶性肿瘤可获得更高的敏感度、特异度。
综上所述,SMI 联合GI-RADS 对卵巢肿瘤良恶性的鉴别价值高于CDFI 联合GI-RADS,具有临床推广价值。

