提升上清液Wnt3a蛋白含量的L-Wnt3a细胞培养体系及其促进多能干细胞诱导黑素细胞分化的效应研究
曲勃维, 刘莉萍, 鲁浩, 李遇梅
(1. 江苏大学附属医院皮肤科,江苏 镇江 212001; 2. 内蒙古医科大学附属医院皮肤科,内蒙古 呼和浩特 010107)
功能性黑素细胞的缺乏与破坏会导致色素脱失性疾病,其中最常见的疾病是白癜风[1]。以白癜风为代表的色素脱失性疾病尚无治愈方法,其治疗结果通常不能令人满意。黑素细胞移植是治疗稳定期白癜风的方法之一,治疗面积大、复色效果好、不良反应的发生率较低,但自体黑素细胞难以在体外进行大量培养和扩增,因此难以满足具有广泛病变患者的治疗需要[2]。通过再生医学手段得到大量再生的黑素细胞并将其应用于临床研究将会极大地造福色素脱失性疾病的患者[3-4]。多能干细胞能够无限增殖并可以向三个胚层分化,是细胞疗法治疗各种疾病与损伤的潜在来源[5]。多能干细胞也可经诱导得到黑素细胞,Fang等[6]于2006年将人胚胎干细胞成功分化为黑素细胞,后续有研究报道使用人诱导多能干细胞生成拟胚体也能够成功诱导黑素细胞[7-8]。
Wnt3a蛋白在多能干细胞向黑素细胞诱导分化的过程中起重要作用,它可以直接诱导黑素细胞重要转录因子(MITF)的表达[9],调节黑素细胞特异性酶酪氨酸相关蛋白1 (TRP1)和酪氨酸酶(TYR) 的表达量[10]。此外,Wnt信号能够调节黑色素生成[11],通过抑制或刺激个体迁移前神经嵴细胞中的Wnt信号通路,可观察到缺乏 Wnt1和Wnt3a的小鼠几乎完全没有色素细胞[12]。基于Wnt3a在黑素细胞发育中的重要作用,且纯化的Wnt3a蛋白获取成本非常高[13],L-Wnt3a条件培养基作为Wnt3a蛋白的来源被应用于黑素细胞分化实验[13-16]。L-Wnt3a条件培养基的传统收集方案中对L-Wnt3a细胞的接种密度、收集的条件与时机以及其中含有的Wnt3a蛋白水平并不明确[13]。不同批次间细胞接种的密度如不相同,将会导致收集的L-Wnt3a条件培养基所含Wnt3a蛋白含量存在差异,会造成黑素细胞分化体系的不稳定。
为了建立稳定的分化体系,本研究利用ELISA法对不同细胞接种密度和不同采集时点的L-Wnt3a细胞培养上清液中Wnt3a蛋白浓度进行定量,优化L-Wnt3a条件培养基的收集方案。使用含有明确Wnt3a浓度的L-Wnt3a条件培养基和Wnt3a重组蛋白作为多能干细胞向黑素细胞诱导体系中Wnt3a来源进行相关验证。
1 材料与方法
1.1 细胞系、主要试剂和仪器
L-Wnt3a细胞购于美国ATCC公司(CRL-2647TM),胚胎干细胞株WA09细胞购于美国WiCell公司(WAe009-A),多能干细胞株WTC-11细胞购于美国Coriell公司(GM25256),依照江苏大学附属医院伦理许可(AWYXLL20191119-2)分离人表皮黑素细胞。
低糖DMEM、胰酶、TrypLETM消化酶、胎牛血清、2-巯基乙醇、G-418及GlutaMAXTM(美国Gibco公司),高糖DMEM、PBS、青霉素及链霉素(美国Hyclone公司),黑素细胞培养基(美国Science Cell公司),佛波醇 12-十四酸酯 13-乙酸酯(PMA)、霍乱毒素、地塞米松、二甲基亚砜、明胶、胰岛素-转铁蛋白-硒、维生素C、亚油酸-牛血清白蛋白及MCDB培养基(德国Sigma公司),基质胶(美国Corning公司),纤维连接蛋白(美国BD Biosciences公司),AccutaseTM消化酶(美国Innovative Cell Technologies公司),拟胚体形成培养基、mTeSRTM培养基及ReLeSRTM消化酶(加拿大Stemcell Technologies公司),干细胞因子、Wnt3a重组蛋白(美国RD公司),碱性成纤维生长因子及Y-27632(日本Wako公司),内皮素-3(美国ENZO公司),PCR引物由生工生物工程(上海)股份有限公司合成。
移液器吸头、PCR管(美国Axygen公司),离心管、培养皿及培养板(美国Corning公司),ElplasiaTM细胞培养板(日本Kuraray公司),0.22 μm滤器(美国Millipore公司),加样槽(中国Biosharp公司)。CCK-8检测试剂(中国Vazyme公司),ELISA检测试剂盒(美国RD公司),Hoechst染色试剂(中国Biosharp公司),Masson-Fontana染色试剂盒(中国Solarbio公司),TrizolTM(美国Invitrogen公司),逆转录试剂盒及SYBR试剂盒(日本Takara公司)。37 ℃恒温细胞培养箱、高速低温离心机、多功能酶标仪、生物安全柜及荧光定量 PCR 仪(美国Thermo Fisher Scientific公司),PCR扩增仪(美国Bio-Rad公司),光学显微镜及荧光显微镜(日本Nikon公司)。
1.2 培养基的配制
1.2.1 L-Wnt3a条件培养基的传统收集方案 使用含0.4 mg/mL G-418 的10% 胎牛血清的高糖 DMEM 维持培养L-Wnt3a细胞,当细胞达到70%~80%融合时,使用 0.05%胰酶-EDTA消化细胞传代,在显微镜下观察到大多数细胞变圆时,加入含 10% 胎牛血清的高糖 DMEM中和胰酶终止消化;按照 1 ∶10 的比例接种细胞,培养4 d 在细胞接近100%融合时,收集第1批次上清液后使用0.22 μm 过滤器过滤,然后在各培养皿中加入高糖 DMEM,继续培养4 d,收集第2批次上清液后使用0.22 μm 过滤器过滤;将上述2批上清液等体积混合后保存待用。
1.2.2 明确Wnt3a浓度的条件培养基收集方案 当L-Wnt3a细胞密度达到70%~80%融合时,使用0.05%胰酶-EDTA消化细胞进行传代,将细胞消化后得到的细胞悬液进行细胞计数,按照预先设置好的接种密度接种细胞,当细胞生长到达平台期后,弃去培养上清液并加入新鲜的10 mL含1%胎牛血清的高糖DMEM;继续培养48 h后收集上清液,使用0.22 μm过滤器过滤,间隔48 h继续重复收集上清液3次;用ELISA法测定上清液中Wnt3a蛋白的浓度;以上收集到的3份上清液即为明确Wnt3a浓度的L-Wnt3a条件培养基,保存待用。
1.2.3 黑素细胞分化培养基(明确Wnt3a浓度) 明确Wnt3a浓度的分化培养基,将第1混合溶液中的各试剂充分混合后使用0.22 μm 过滤器过滤,注意避光操作;后添加第2混合溶液中的各个组分。第1混合溶液:10 mL MCDB 201培养基;1 μL 2.5 mmol/L 地塞米松;2.8 μL 3 mg/mL 霍乱霉素;2.5 μL 1 mmol/L PMA;100 μL 10 mg/mL 维生素C。第2混合溶液:一定量的明确Wnt3a浓度的条件培养基 (根据所需分化培养基浓度进行计算);一定量的低糖DMEM(根据添加明确Wnt3a浓度的条件培养基的量计算,两者总体积确定为40 mL);250 μL 10 μg/mL干细胞因子;50 μL 100 μmol/L内皮素-3;50 μL 4 μg/mL碱性成纤维生长因子;500 μL 亚油酸-牛血清白蛋白;500 μL胰岛素-转铁蛋白-硒;500 μL GlutaMAXTM。分化3周后,在不含PMA并补充有0.5%胎牛血清的黑素细胞特异性分化培养基中培养。
1.3 L-Wnt3a细胞分泌Wnt3a蛋白相关检测
1.3.1 CCK-8法测定细胞活力 使用CCK-8检测试剂测定细胞活力:① 以96孔板为例,将待测细胞样本进行预培养;② 加入相应不同处理方式的试剂到培养板的各孔中;③ 置于细胞培养箱中培养;④ 吸弃原有培养液,使用PBS或相应培养基漂洗样本;⑤ 于避光条件下在每孔中加入含CCK-8溶液体积分数为10%的新培养基,注意设置空白对照;⑥ 在培养箱中避光孵育2 h;⑦ 使用酶标仪检测各样本450 nm处光密度值。
1.3.2 Hoechst活细胞荧光染色 使用Hoechst 33342试剂进行染色:① 准备待测活细胞样本,吸弃原有培养基;② 以35 mm培养皿为例,加入1 mL Hoechst 33342 染色液,充分覆盖待测细胞;③ 在细胞培养箱中避光培养20~30 min;④ 弃去染色液,使用常温的PBS或培养液洗涤2~3次;⑤ 于荧光显微镜下观察待测样本。
1.3.3 ELISA法测定Wnt3a浓度 在室温下按照Wnt3a ELISA试剂盒说明书操作:① 在微孔板中孵育捕获抗体并封板过夜;② 吸弃各孔液体并用洗板液清洗,然后垂直拍干孔中水分,重复洗涤2次,循环3次;③ 加入封闭液封闭平板1 h;④ 重复步骤②;⑤ 以倍比稀释的方法加入标准品及待测样品封板孵育2 h;⑥ 重复步骤②。⑦ 加入检测抗体封板孵育2 h;⑧ 重复步骤②;⑨ 加入Streptavidin-HRP B封板孵育20 min,避光;⑩ 重复步骤②,避光;配制底物溶液并加入孔内孵育20 min,避光;加入终止溶液,并立即上机检测,避光。
1.3.4 定量化分析 使用Image J软件进行细胞图像数字化处理,通过ELISACalc软件进行标准曲线拟合及数据计算。
1.4 多能干细胞向黑素细胞分化实验
1.4.1 多能干细胞的培养 接种多能干细胞至基质胶包被的培养皿中,添加终浓度为 10 μmol/L的Y-27632并十字摇匀,在细胞培养箱中培养。当多能干细胞克隆足够大时进行传代;使用ReLeSRTM消化酶,显微镜下观察待克隆中央出现明显裂隙时中止消化;加入 mTeSRTM培养基,轻轻吹打克隆使其变为小团块,避免形成单细胞,将细胞接种于mTeSRTM培养基中,十字混匀后放置细胞培养箱中培养,每天更换细胞培养基。
1.4.2 单细胞制作拟胚体 无饲养层上培养的多能干细胞生长到足够大时,使用AccutaseTM消化酶消化细胞,在显微镜下观察到大多数细胞变圆时,中和消化酶后加入1 mL AggreWellTM拟胚体形成培养基重悬细胞后进行活细胞计数;以24孔ElplasiaTM板为例,每孔接种(2.5~5.0)×105个细胞,加入培养基2 mL;添加终浓度为 10 μmol/L的Y-27632后十字摇匀,置于细胞培养箱中培养;24 h后可形成拟胚体,将其转移至超低黏附培养板中继续培养。
1.4.3 黑素细胞悬浮分化方案 当拟胚体的直径达300~400 μm时,可以开始黑素细胞的诱导分化:收集拟胚体,转移至离心管中,等待其自然沉降后小心吸弃上清液;加入明确Wnt3a浓度的黑素细胞分化培养基重悬,转移至超低黏附培养板中进行悬浮诱导分化;每2~3 d进行半量换液;在分化第14天时将拟胚体转移至纤维连接蛋白包被的培养皿中,继续使用明确Wnt3a浓度的黑素细胞分化培养基;在分化第21天时进行单细胞传代,使用 TrypLETMExpress消化酶,收集细胞悬液离心后弃去上清液,使用明确Wnt3a浓度的黑素细胞分化培养基重悬细胞,进行细胞计数后接种于纤维连接蛋白包被的培养皿中,每隔2~3 d更换培养基。
1.4.4 诱导黑素细胞的培养 在细胞达到80%~90%融合时,用纤维连接蛋白包被的培养皿进行传代;使用TrypLETMExpress消化酶,收集细胞悬液后离心,使用黑素细胞分化培养基重悬细胞,进行细胞计数后接种于纤维连接蛋白包被的培养皿中,每隔2~3 d更换培养基。
1.5 RT-PCR基因检测
使用TRIzolTM提取 RNA,逆转录试剂盒进行逆转录,SYBR试剂盒进行RT-PCR。热循环反应:95 ℃持续30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。PCR反应结束后,检查确认融解曲线及扩增曲线,检查运行结果;以GAPDH作为对照,计算各目的基因的ΔCt值,计算相对基因表达量。
1.6 Masson-Fontana染色
使用Masson-Fontana染色试剂盒:① 4%多聚甲醛固定样本15 min;② 加入氨银溶液,在56 ℃孵育40 min,避光;③ 用纯水清洗样本,海波溶液处理5 min后用超纯水清洗样本;④ 使用95%乙醇-无水乙醇脱水,二甲苯处理后封片。
1.7 统计学分析
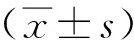
2 结果
2.1 不同接种密度获取的培养上清液中Wnt3a蛋白浓度的比较
以6.25×103个/cm2(低)、1.25×104个/cm2(中)、2.50×104个/cm2(高)3个密度组分别接种L-Wnt3a细胞,接种48 h的细胞密度差异明显,其中高接种密度组的细胞已完全融合(图1)。以传统方案收集细胞培养上清液,对收集到的上清液中Wnt3a蛋白总量定量分析结果表明,各组Wnt3a的分泌总量比较,差异有统计学意义(P均<0.05),提示以不同密度接种L-Wnt3a细胞获取的培养上清液中Wnt3a蛋白的浓度差异很大(图2)。
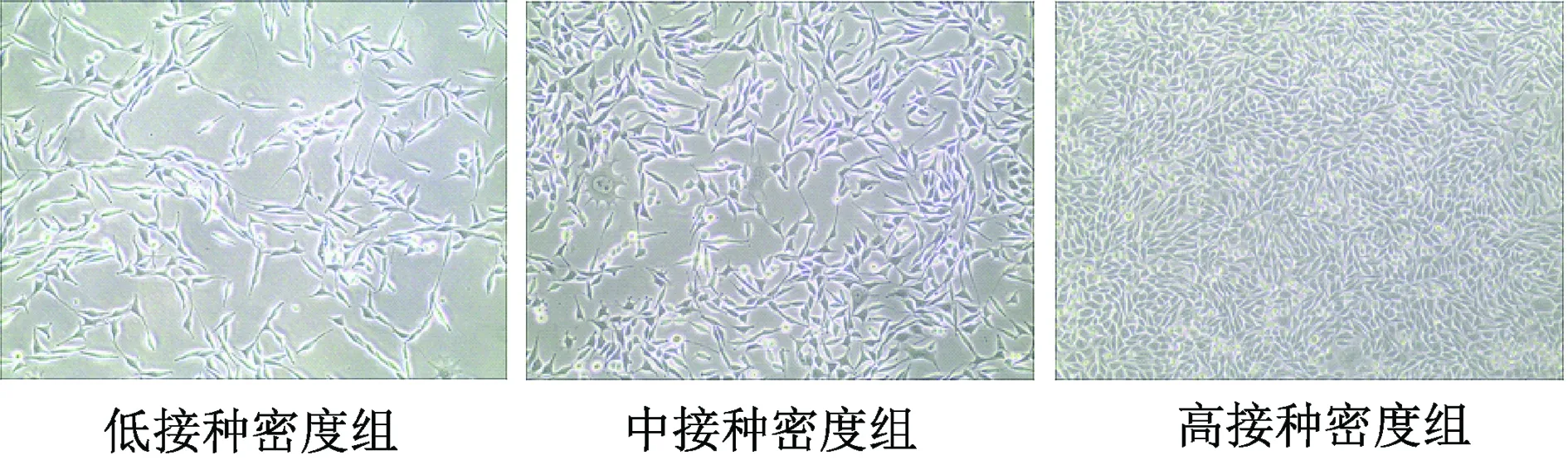
图1 显微镜下观察不同接种密度的L-Wnt3a细胞在接种48 h的细胞状态(×100)
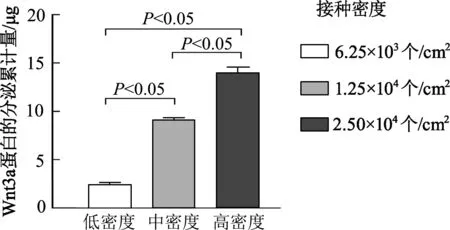
图2 不同接种密度的传统法收集培养上清液中所含Wnt3a蛋白总量
2.2 L-Wnt3a 条件培养基收集参数的定量比较及方案优化
中接种密度组的L-Wnt3a细胞生长曲线显示,培养1~4 d的L-Wnt3a细胞处于增殖状态,培养4 d后细胞生长进入平台期,且细胞的维持培养时间至少可达22 d。测定每24 h收集的培养上清液中Wnt3a蛋白浓度并计算分泌累计量,结果显示培养1~4 d的细胞处于增殖期,Wnt3a蛋白分泌水平也逐渐升高;培养5~10 d的细胞处于平台期,Wnt3a蛋白分泌量可维持在高水平;培养10 d后分泌量逐渐下降,但仍高于1~4 d的水平。说明在细胞到达生长平台期后的6 d内,Wnt3a蛋白在培养上清液中的分泌量较高且处于高效率分泌的水平,由此提示此时段可作为高效率收集L-Wnt3a细胞培养上清液的关键点位,按照“1.2.2”收集培养上清液的方案,于细胞到达平台期后每隔2 d收集上清液,共收集3批。生长曲线显示高、中、低接种密度组分别在培养2、4、6 d进入平台期。Wnt3a蛋白的分泌情况显示,3种接种密度收集得到的上清液在细胞到达平台期后的6 d内收集到的蛋白总量较高,远高于平台期前收集到的蛋白总量,3种接种密度在其相对应收集批次的Wnt3a蛋白分泌累计量比较,差异无统计学意义,高接种密度组的收集方式用时最短。见图3。
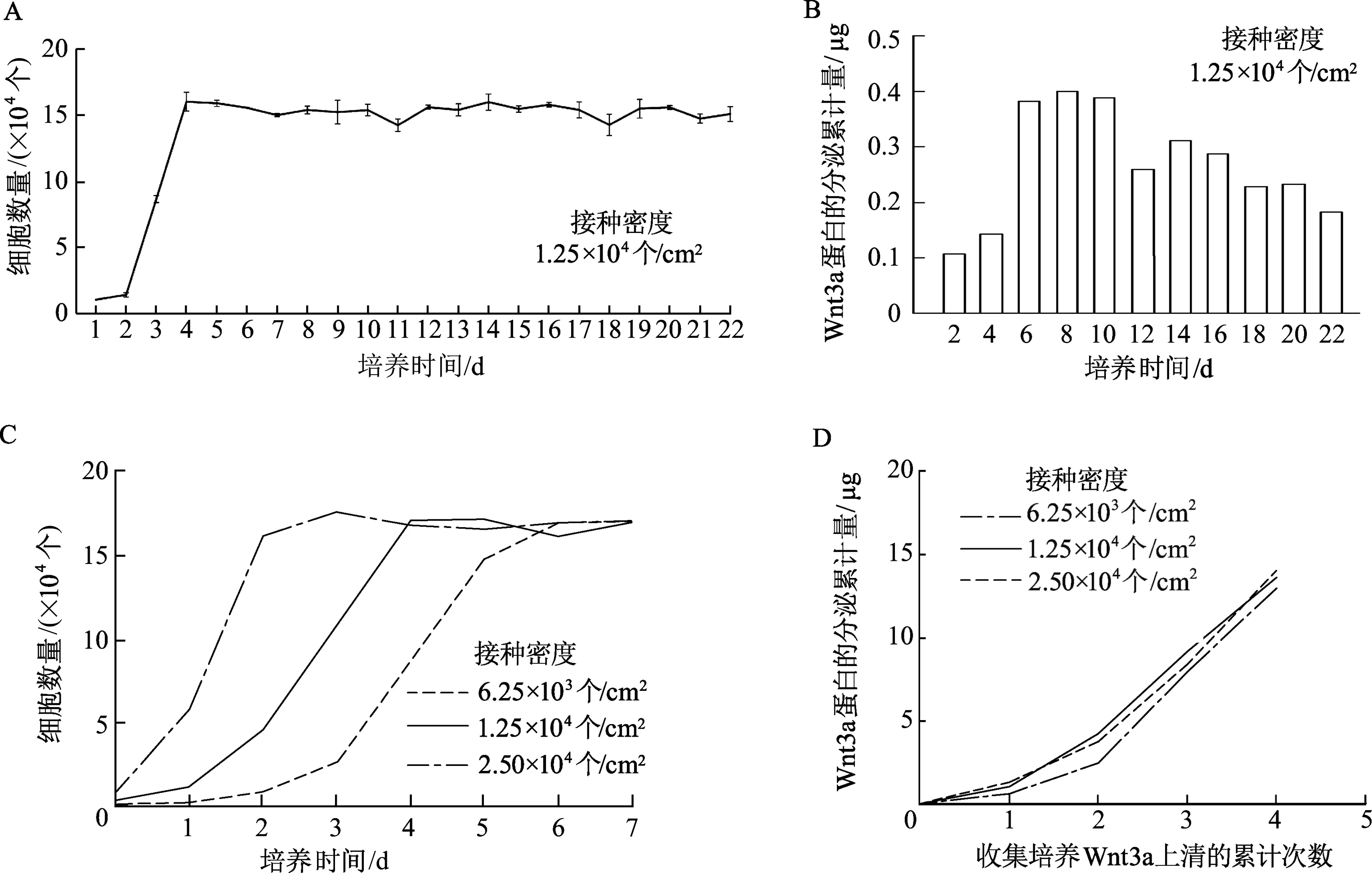
A:特定接种密度L-Wnt3a细胞的生长曲线;B:不同时段L-Wnt3a细胞分泌Wnt3a蛋白到上清液中的情况;C: 3种接种密度L-Wnt3a细胞的生长曲线;D:3种接种密度组以新型上清液收集方式获得的Wnt3a总量比较
2.3 利用明确Wnt3a浓度的条件培养基诱导黑素细胞生成
使用10、50、100 ng/mL 3种浓度Wnt3a蛋白的黑素细胞分化培养基对胚胎干细胞株WA09及诱导多能干细胞株WTC-11细胞进行黑素细胞的悬浮诱导分化,分化28 d时的结果显示,各组最终得到的细胞在形态上都呈现树突状,与黑素细胞接近,且都具有较好的增殖能力;各组的分化细胞均高表达黑素相关基因MITF、PAX3、SOX10、PMEL、TYR,TYRP1及DCT,低表达SOX2及NANOG基因,几乎不表达OCT4、LIN28、DNMT3B等多能干性基因(图4)。分化42 d的Masson-Fontana染色结果显示,与人表皮黑素细胞相比较,在诱导得到的细胞中能够观察到被染为黑色的黑色素(图5)。以上结果验证了在新型的分化体系,即应用了新型上清液收集方案的明确Wnt3a浓度的培养分化系统中,随着分化时间的延长,细胞失去干细胞的特性,趋向成熟黑素细胞分化。
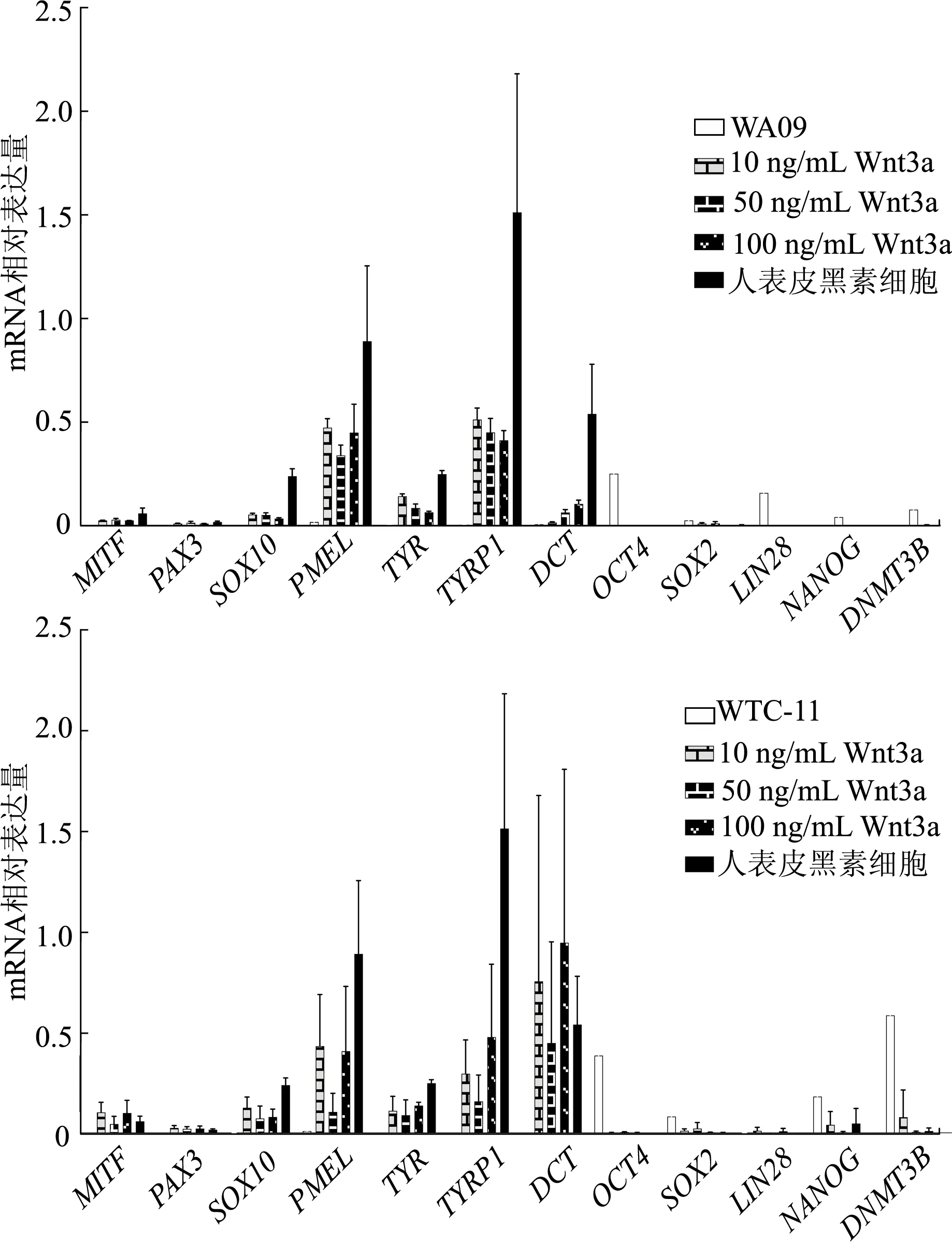
图4 分化28 d时WA09、WTC-11分化组黑素
2.4 明确浓度的条件培养基与重组蛋白在黑素细胞诱导中的效价比较
使用Wnt3a浓度为50 ng/mL的条件培养基与相应浓度的Wnt3a重组蛋白进行分化实验的结果显示,分化21 d时各组均有黑素发育相关基因如MITF、PAX3、SOX10、PMEL、TYR、TYRP1及DCT的表达(图6)。在分化后期对两株多能干细胞分化的黑素细胞进行Masson-Fontana染色,在条件培养基以及重组蛋白各组中均能观察到被染为黑色的黑色素(图7)。结果表明,明确Wnt3a浓度的条件培养基与相应浓度的重组Wnt3a蛋白均可作为黑素细胞分化中Wnt3a蛋白的来源,能够达到相似的效果。
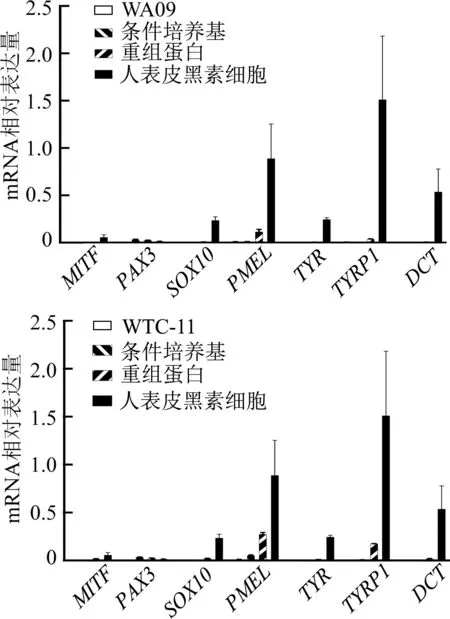
图6 分化第21天WA09、WTC-11
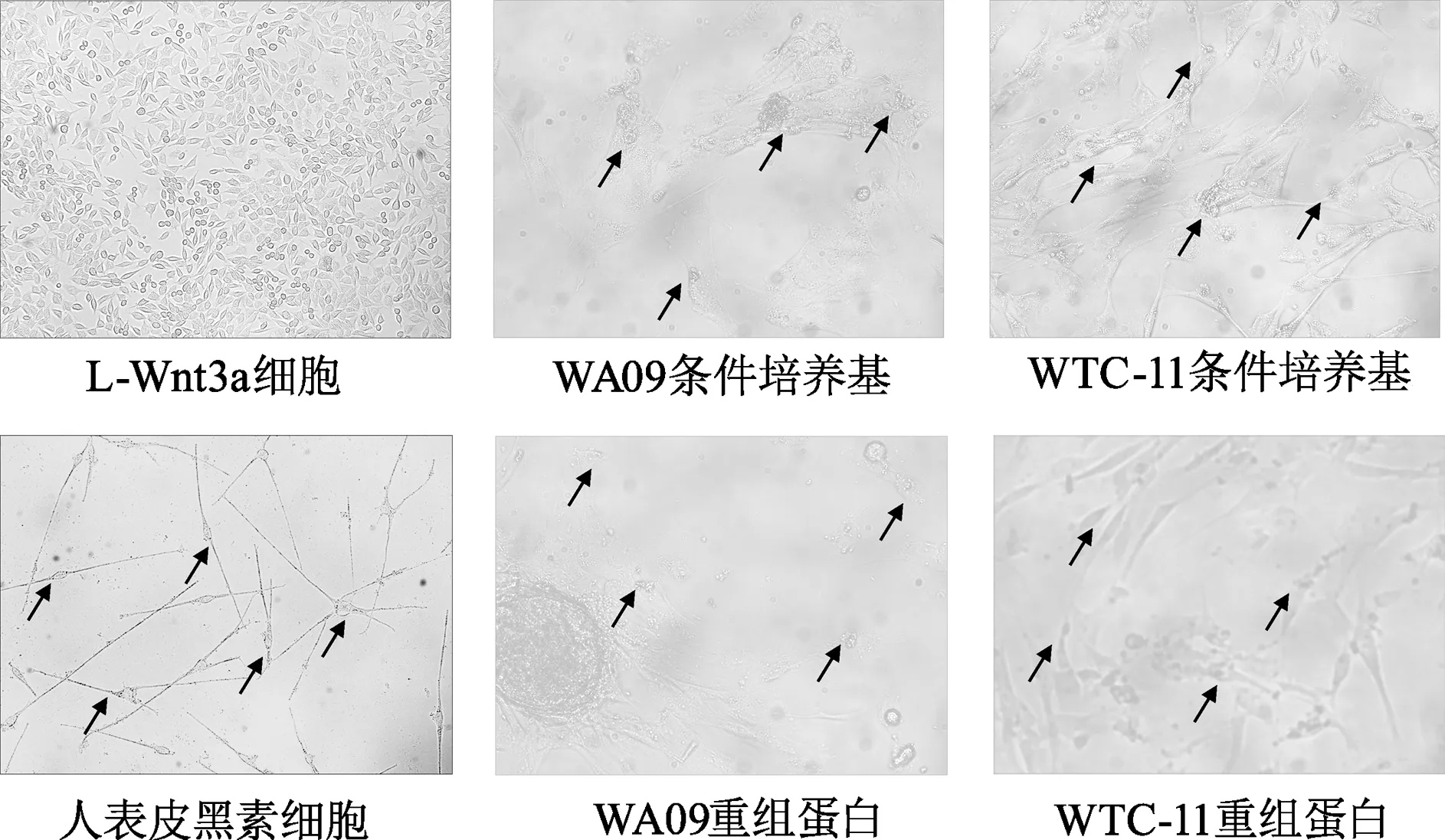
图7 黑素细胞的功能鉴定(Masson-Fontana染色,×200)
3 讨论
黑素细胞由神经嵴发育而来,在人体中黑素细胞通过与周围的角质形成细胞、组成表皮黑素单元并以黑素小体的形式传递黑色素,黑色素是保护皮肤抵御紫外线辐射损伤及形成肤色的重要基础。通过多能干细胞分化来大量扩增并替代治疗白癜风等功能性黑素细胞缺乏与破坏导致的疾病,有符合伦理要求、细胞来源广泛、能够大量扩增的优势。而多能干细胞的分化是一个复杂和长期的过程,不断优化分化方案、使多能干细胞分化的条件更为稳定及可控是当前研究的重点方向。
Fang等[6]在人胚胎干细胞分化为黑素细胞的实验中使用了L-Wnt3a条件培养基作为分化体系中Wnt3a蛋白的来源。研究发现[7-8],人诱导多能干细胞生成拟胚体也能够成功诱导黑素细胞。进一步研究发现,使用较均一的拟胚体进行三维黑素细胞分化较传统方法具有更高的分化效率[17],而形状规则的、光滑的非囊性拟胚体与具有明亮或黑暗空腔的囊状拟胚体相比,更易分化成黑素细胞[8]。
以上研究针对分化使用的生长因子以及分化条件进行探索,但并未对分化体系中提供Wnt3a蛋白来源的L-Wnt3a条件培养基制作条件进行精密的控制。本研究通过对L-Wnt3a细胞生长状态进行监测并绘制细胞生长曲线,分时段收集培养上清液并利用ELISA法测定蛋白含量,对Wnt3a蛋白分泌水平进行监测。设计了不同于传统方法[6,17-18]的明确了细胞接种密度、培养上清液按批次收取且不互相混合并标定其浓度的新型收集方案。发现在培养的全程,这种细胞均能够分泌Wnt3a蛋白,在生长到达平台期后的6 d内,分泌Wnt3a蛋白的效率高于其他时段,与初始接种密度无关。这种方案在细胞接种8 d后即可收集3个批次、可用于后续研究的条件培养基,极大地提升了效率。
应用于黑素细胞分化体系中的Wnt3a蛋白浓度如果不明确,会造成分化体系的不稳定,从而对后续的多能干细胞来源的黑素细胞生成效率造成影响。使用本研究设立的明确Wnt3a浓度的黑素细胞悬浮诱导分化系统,能够较稳定地对胚胎干细胞株WA09及诱导多能干细胞株WTC-11细胞维持分化并得到诱导黑素细胞。在分化过程中多能干细胞相关基因表达下调并逐渐表达黑素相关基因,诱导得到的细胞具有与人表皮黑素细胞类似的树突状生长的形态学表现,Masson-Fontana染色阳性提示有成熟的黑色素颗粒生成,提示明确Wnt3a浓度的黑素细胞悬浮诱导分化体系能够成功得到诱导黑素细胞。使用L-Wnt3a条件培养基与Wnt3a重组蛋白作为分化培养基中的Wnt3a来源,均能够对两株多能干细胞进行黑素细胞的诱导分化,从而得到诱导黑素细胞。
本研究建立的明确Wnt3a蛋白浓度的培养上清液收集方案操作简便、收集周期短并能应用于多能干细胞诱导黑素细胞分化体系,进一步减少黑素细胞再生过程中的未知因素。而Wnt3a蛋白作为重要的生长因子,在其他类型细胞的再生中也是重要的研究方向,本研究可为其提供一定的参考与思路。
综上所述,本研究优化的L-Wnt3a培养上清液收集方案能够稳定高效地获取Wnt3a蛋白,应用于明确Wnt3a蛋白浓度的多能干细胞黑素细胞分化体系,成功得到诱导黑素细胞,L-Wnt3a 条件培养基与重组Wnt3a蛋白在多能干细胞来源的黑素细胞诱导中具有相似效价。

