间歇性高容量血液滤过对脓毒症合并急性肾损伤患者炎性介质及血流动力学的影响
叶红
(信阳市人民医院 肾内科,河南 信阳 464100)
脓毒症是人体对感染反应失调导致的器官功能障碍综合征,病死率极高,是重症监护病房(ICU)主要病死原因之一[1-2]。而急性肾损伤(AKI)是脓毒症常见的并发症,可加重患者的体循环障碍,增加病死的风险[3]。因此,对脓毒症合并AKI患者给予更积极的治疗以降低病死率具有重要意义。临床会采用血液透析的治疗脓毒症合并AKI,可以清除患者体内的代谢物质,维持机体内环境的平衡[4]。但有研究[5]指出,这种方式现已无法彻底清除患者体内毒素,治疗效果并不理想。高容量血液滤过是在标准连续性静脉—静脉血液滤过的基础上发展的,可以明显地改善血流动力学状态,全面下调炎症因子反应,对此临床考虑间歇性高容量血液滤过的方式,但应用该方式对患者的炎性介质和血流动力学影响的研究较少[6]。基于此,本研究开展此项研究,旨在探讨间歇性高容量血液滤过对脓毒症合并AKI患者炎性介质及血流动力学的影响,为临床治疗提供更多的参考。现报告如下。
1 资料与方法
1.1 一般资料
研究对象来源于信阳市人民医院2017年8月至2018年10月收治的60例脓毒症合并AKI患者,按照随机分组法分为两组,各30例。对照组男19例(63.33%),女11例(36.67%);年龄42~67岁,平均(54.52±4.54)岁;体重指数(BMI):18~25 kg/m2,平均(22.51±1.96)kg/m2;脓毒症诱因:肺部感染16例、泌尿系感染8例、腹膜炎6例;脓毒症病情:严重脓毒症22例、脓毒症休克8例;合并基础疾病:糖尿病6例、高血压11例、高血脂5例、冠心病5例。观察组男20例(66.67%),女10例(33.33%);年龄41~68岁,平均(54.71±4.58)岁;BMI:17~25 kg/m2,平 均(21.84±1.72)kg/m2;脓毒症诱因:肺部感染12例、泌尿系感染10例、腹膜炎8例;脓毒症病情:严重脓毒症20例、脓毒症休克10例;合并基础疾病:糖尿病8例、高血压10例、高血脂4例、冠心病5例。两组一般资料对比,差异无统计学意义(P>0.05),研究具有可比性。本研究经医院医学伦理委员会审核并通过,患者家属知晓本研究内容,且自愿在同意书上签字。
纳入标准:(1)脓毒症符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》中诊断依据[7],序贯器官衰竭(SOFA)评分较基线上升≥2分;伴有不同程度感染;伴有发热、心率加快、呼吸困难等症状;综合上述指标和实验室结果确诊;(2)AKI符合“AKI临床实践指南”[8]内相关诊断标准:48 h内血肌酐(Scr)较前升高50%以上;或Scr升高绝对值大于25 mmol/L(0.3 mg/dl);或尿量减少,超过6h小于0.5 mL/(kg/h);(3)脓毒症发病至入院时间<48 h;(4)脓毒症发病前肾功能正常;(5)均在医院ICU接受规范化治疗;(6)发病时急性生理学及慢性健康状况评分Ⅱ(APACHEⅡ)[9]评分15~30分。
排除标准:(1)合并活动性结核、恶性肿瘤等消耗性疾病;(2)合并先天性免疫功能缺陷;(3)合并急性传染性疾病;(4)合并先天性凝血功能障碍;(5)合并其他急需立即治疗的原发性脏器疾病;(6)长期服用抗凝药物;(7)存在活动性出血或严重出血倾向;(8)长期服用激素类药物或免疫抑制剂。
1.2 方法
对照组患者入院即进行监护,检测中心静脉压,各项生化指标及脏器功能;给予常规对症治疗,包括维持水电解质平衡、控制血糖血压、营养支持、抗感染、抗休克等,同时注射乌司他汀(生产批号20170316,广东天普生化医药股份有限公司,10万U/支)10万U治疗,加入500 mL 5%葡萄糖稀释后静脉滴注1次,1次/d,乌司他汀使用剂量根据啊患者症状改善情况调整。同时采用血液透析治疗,透析机由德国费森尤斯生产,由上海悦心同舸医疗器械有限公司所提供,透析液采用碳酸氢盐,治疗时以500 mL/min的流速(血流量200~300 mL/min)进行,治疗时间为4~5 h/d。
观察组其他治疗方案均同对照组,将对照组血液透析疗法改为间歇性高容量血液滤过:血管通路建立使用左股静脉双控导管,采用Fresenius Medical Care AG公司生产的Fresenius Plasmafilters P2S型血浆滤过器和膜面积为1.5 m2的一次性高通量聚砜膜血滤器,根据患者体征设置置换液中浓度及电解质成分。控制置换液的流速需在4000 mL/h,控制血流速度在150~200 mL/min,同时给予低分子肝素钠抗凝处理,避免发生血管通路凝血。定期为患者所用过的滤器使用生理盐水进行冲洗。治疗8~12 h/d。两组患者持续治疗1周。
1.3 观察指标
1.3.1 肾功能及炎性介质
比较两组治疗前、治疗1周后肾功能[Scr、尿素氮(BUN)、β2微球蛋白(β2-MG)、血尿酸(UA)]及炎性介质[白细胞介素-6(IL-6)、白细胞介素-17(IL-17)、肿瘤坏死因子-α(TNF-α)、血小板计数(PCT)]水平。抽取患者治疗前后空腹静脉血4 mL,以3000 r/min速率离心10 min,离心半径10 cm,取血清待检,试剂盒均购自上海晶抗生物工程有限公司。以肌氨酸氧化酶法检测Scr水平,采用迈瑞的(BA-90)半自动生化分析仪(上海赛默生物科技发展有限公司提供)检测BUN、UA水平;以贝克曼IAMMGE行酶联免疫吸附法测定β2-MG、IL-17、TNF-α、PCT水平;借助gc-2010型放射免疫计数器,检测IL-6水平。
1.3.2 血流动力学
记录两组治疗前、治疗后1周平均动脉压(MAP)、心率(HR)、心脏指数(CI)指标变化。
1.4 统计学方法
采用PASS 15.0软件计算本研究样本量;采用SPSS 25.0统计学软件处理数据,采用Shapiro-Wilk正态分布检验计量资料的正态性情况;符合正态分布的计量资料采用±s表示,两组间数据比较采用独立样本t检验,组内数据比较采用配对样本t检验;采用%表示计数资料,采用χ2检验,等级资料采用秩和检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 两组肾功能指标水平比较
两 组 治 疗 前Scr、BUN、β2-MG、UA水 平 比 较,差异无统计学意义(P>0.05);治疗1周,两组Scr、BUN、β2-MG、UA水平均降低,且观察组低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组肾功能指标水平比较(±s)

表1 两组肾功能指标水平比较(±s)
注:与本组治疗前比较,①P<0.05。
组别 例数 Scr/(μmol·L-1) BUN/(μmol·L-1) β2-MG/(mg·L-1) UA/(μmol·L-1)治疗前 治疗1周后 治疗前 治疗1周后 治疗前 治疗1周后 治疗前 治疗1周后对照组 30520.19±103.14360.71±79.33① 30.14±9.4320.69±4.19① 4.13±0.453.84±0.36① 460.25±84.20411.59±52.06①观察组 30500.24±102.35290.20±61.49① 28.50±8.1615.18±3.96① 4.16±0.482.97±0.28① 453.97±79.01371.42±50.37①t 0.7523.8480.7205.2350.25010.4480.2983.037 P 0.455 <0.0010.474 <0.0010.804 <0.0010.7670.004
2.2 两组炎性介质水平比较
两组治疗前IL-6、IL-17、TNF-α、PCT水平比较,差异无统计学意义(P>0.05);治疗1周,两组IL-6、IL-17、TNF-α、PCT水平均降低,且观察组低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组炎性介质水平比较(±s)
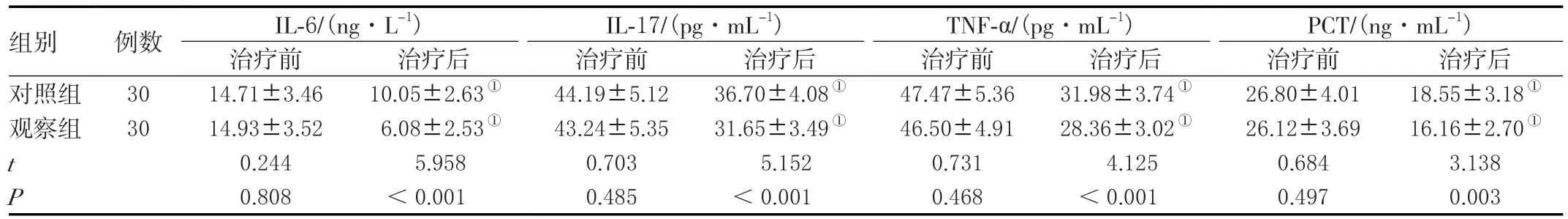
表2 两组炎性介质水平比较(±s)
注:与本组治疗前比较,①P<0.05。
组别 例数 IL-6/(ng·L-1) IL-17/(pg·mL-1) TNF-α/(pg·mL-1) PCT/(ng·mL-1)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 3014.71±3.4610.05±2.63① 44.19±5.1236.70±4.08① 47.47±5.3631.98±3.74① 26.80±4.0118.55±3.18①观察组 3014.93±3.526.08±2.53① 43.24±5.3531.65±3.49① 46.50±4.9128.36±3.02① 26.12±3.6916.16±2.70①t 0.2445.9580.7035.1520.7314.1250.6843.138 P 0.808 <0.0010.485 <0.0010.468 <0.0010.4970.003
2.3 两组血流动力学参数比较
两组治疗前MAP、HR、CI水平比较,差异无统计学意义(P>0.05);治疗1周,两组MAP、CI均升高,HR均降低,且观察组改善优于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组血流动力学参数比较(±s)

表3 两组血流动力学参数比较(±s)
注:与本组治疗前比较,①P<0.05。
组别 例数 MAP/mmHg HR/min CI/[L/(min·m2)]治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 3058.31±6.3662.50±5.46① 112.31±13.2195.88±10.27① 3.77±0.824.24±0.91①观察组 3057.39±6.6166.71±7.28① 109.31±11.1986.34±9.17① 3.79±0.864.81±1.03①t 0.5492.5340.9493.7950.0922.272 P 0.5850.0140.346 <0.0010.9270.027
3 讨 论
脓毒症作为一种全身炎症疾病,常合并AKI而增加临床治疗难度,增加患者病死风险,预后较差。血液透析治疗是脓毒症的基础治疗方法,可以清理血液中代谢废物和多余水分,同时维持血液内酸碱度及电解质平衡,从而发挥清除内毒素和炎性因子的作用[10-11]。但脓毒症合并AKI患者的肾功能严重缺失,血液透析无法完全代替肾脏功能,患者很容易在治疗过程中出现不良事件,影响治疗效果[12]。因此,临床考虑采用间歇性高容量血液滤过的方式来改善患者的预后。
本次研究结果表示,对照组和观察组分别给予血液透析和间歇性高容量血液滤过的治疗方式以观察其对患者肾功能的影响。从结果中可以看出,观察组的Scr、BUN、β2-MG、UA水平均显著低于对照组,这表明间歇性高容量血液滤过的治疗方式对患者改善肾功能更具有优势。因为间歇性高容量血液滤过法是在血液透析的基础上发展的,通过建立体外循环的方式进行血液净化,可以更好地对体内代谢废物及其他溶质进行连续性清除,从而维持机体代谢功能[13]。相较于传统的血液透析治疗,间歇性高容量血液滤过法具有治疗剂量更高、滤过更加充分、毒素清除率更高等优点,在一定程度上可以减轻肾脏负担,减小肾损伤,更有利于肾功能的恢复与改善[14]。
脓毒症合并AKI患者的肾脏排泄功能及内分泌功能受损,体内水电解质、酸碱平衡紊乱,导致毒副代谢产物蓄积,从而引起IL-6、IL-17、TNF-α等炎性介质大量释放,引发微炎症反应,对患者的组织及器官造成损伤。杨杰章[15]在研究中发现,随着治疗时间的推移,间歇性高容量血液滤过对清除患者血浆中的炎性介质效果更加显著,与本研究具有相似之处。本研究结果显示,治疗后,观察组炎性介质水平较对照组降低更加明显,减轻患者炎症反应效果更好。分析其原因,IL-6、IL-17、TNF-α是脓毒症发生和发展中常见的促炎因子,毒素积累会直接影响促炎因子在机体内的合成与释放,引起剧烈的炎症反应,使得机体内抗炎和促炎之间平衡失调,若不及时控制,会逐渐加重患者的病情[16]。高容量血液滤过所采用的滤器具有较高通透性和良好的生物相容性,能够保证置换液量充足,有效过滤炎性介质中大分子,提高炎性介质清除率,使机体内环境能够维持稳定;研究中采用的是间歇性滤过,避免了持续性高容量血液滤过可能会面临不可控的风险,在一定意义上也降低了不良事件的风险发生,因此得以提高治疗效果[17]。同时,高容量血液滤过采用对流吸附作用,具有抑制全身炎症的链式反应的作用,减少炎症因子释放,重新构建机体内环境的平衡,可以保证抗炎和促炎反应尽快恢复到稳定 状态。
血流动力学紊乱是脓毒症患者病情加重的重要危险因素,处于低灌注的肾脏状态的患者更易发生AKI。所以,改善血流动力学也是治疗脓毒症合并AKI的方面之一[18]。高容量血液滤过通过清除炎性介质,减轻机体免疫反应并重建免疫平衡,对维持机体内环境稳定、改善机体高动力状态、调节MAP、HR、CI水平具有较好的效果。在本研究中,观察组患者在进为期1周的治疗时,血流动力学指标改善程度更加明显,进一步证明间歇性高容量血液滤过可以改善患者血流动力学。究其原因,脓毒症在治疗过程中需要保证抗生素的足量使用,避免炎性介质被清除的同时,抗生素也会被清除,导致药物浓度达不到最佳有效值,从而降低治疗效果[19]。而间歇式高容量血液滤过可减少血管活性药物、抗生素的丢失,提高维持药物治疗效果,促进患者病情转归。通过间歇性的血液净化,不仅可减轻因血流不稳定或再灌注损伤而造成的脏器损伤,有助于促进肾功能恢复,还可规避透析治疗早产的低血压,具有一定安全性[20]。
综上所述,间歇性高容量血液滤过用于治疗脓毒症合并AKI更利于降低炎症反应,改善血流动力学,通过改善上述指标可进一步减轻肾损伤,促进肾功能恢复。

