肥胖者高TSH水平诱导胰岛β细胞功能与胰岛素抵抗的关系
谭娟,张敬进,许宗英
(临沂市中心医院 内分泌科,山东 临沂 276400)
近年来肥胖者有逐渐增多趋势。肥胖是机体饮食摄入过多或能量代谢失衡导致的机体处于脂肪容量高状态,是引发心脑血管疾病、2型糖尿病的高危因素[1]。临床观察发现,肥胖患者的促甲状腺激素(TSH)水平大多高于正常人群,而高TSH是提示甲状腺功能减退的敏感指标。此外,肥胖患者常伴随轻度的胰岛β细胞功能损伤,这可能与肥胖患者大量游离脂肪酸在胰岛中沉积对胰岛β细胞的脂毒性有关,长此以往可引发机体出现胰岛素抵抗(IR),增加2型糖尿病发生风险[2]。相关研究[3]指出,相比于普通型肥胖,中心型肥胖(腰臀比大于0.9)人群体内脂肪分解速率及转换率的游离脂肪酸(FFA)水平相对较高,进入血液后以TG的形式聚集在胰岛细胞中,而β细胞中FFA、TG的沉积,则会通过神经酰胺、蛋白激酶C、胰岛素受体底物-2、胰十二指肠同源异型盒-1、过氧化物酶体增殖物激活受体、内质网应激途径进一步损害胰岛β细胞,加速胰岛β细胞凋亡,导致胰岛功能衰退。目前关于肥胖患者出现甲状腺功能减退是否会影响胰岛β细胞功能及加重IR尚不明确,本次研究通过检测临沂市中心医院内分泌科收治的82例肥胖患者的胰岛功能及甲状腺功能,探究肥胖者高TSH水平对机体胰岛β细胞功能、IR的影响。
1 资料与方法
1.1 两组一般资料比较
选取2017年5月到2019年5月于临沂市中心医院内分泌门诊收治的82例肥胖患者作为研究对象,以血清TSH= 2.5 mU/L为界分为单纯性肥胖组和高TSH肥胖组,高于2.5 mU/L,则为早期亚临床甲状腺功能减退[4]。高TSH肥胖组42例,单纯性肥胖组40例,所有研究对象均知情同意。高TSH肥胖组(42例),男25例,女17例;年龄(45.16±12.40)岁;肥胖病程(5.23±1.23)年。单纯性肥胖组(40例),男22例,女18例;年龄(44.73±12.19)岁;肥胖病程(5.62±1.25)年。两组患者一般资料比较差异无统计学意义(P>0.05)。见表1。本次研究临沂市中心医院医学伦理委员会审核通过。

表1 两组一般资料比较[n(%)]
纳入标准:(1)确诊为肥胖患者,BMI≥28 kg/m2;(2)年龄18~65岁;(3)患者知情并签署知情同意书。
排除标准:(1)合并糖尿病;(2)合并肝肾功能不全、恶性肿瘤史;(3)合并充血性心力衰竭;(4)孕妇或处于哺乳期。
1.2 方法
所有纳入对象检测当日停用药物,统一培训后小组成员采用自制调查表调查所有肥胖者一般资料(性别、年龄、受教育程度、人均年收入、肥胖病程等)、体格检查(身高、体重、腰围、臀围等)、实验室检测(空腹血糖、血清总胆固醇、低密度脂蛋白、甘油三酯等)等临床资料。禁食8 h后抽取空腹静脉血,采用全自动生化仪(日立008型)检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C),空腹血糖(FPG)、餐后2 h血糖(2hPBG)、糖化血红蛋白(HbA1c),低密度脂蛋白(LDL-C),采用全自动化学发光法检测空腹胰岛素(FINS)和空腹C肽水平。TSH试剂盒来源于武汉基因美公司,EMSA试剂盒来自美国赛默飞有限公司。计算胰岛β细胞功能指数(HOMA-β)、胰岛素抵 抗 指 数(HOMA-IR),HOMA-IR=FPG×FINS/22.5,HOMA-β=20 FINS/(FPG-3.5)×100%,分析TSH水平与HOMA-β、HOMA-IR的相关性。
采用全自动生化仪(日立008型)检测空腹血糖(FPG)、餐后2 h血糖(2hPBG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),甲状腺功能正常按照本院实验室检测标准,TC:<5.20 mmol/L;TG:<1.70 mmol/L;HDL-C:>0.91 mmol/l,LDL-C:<3.12 mmol/L;FPG:6.11~6.94 mmol/L;2hPBG:7.78~11.11 mmol/L;HbA1c:4%~6%;FINS:5-20 μIU/mL;C肽:0.8~4.2 ng/mL;FT3:3.1~6.8 pmol/L;FT4:12~22 pmol/L;TSH:0.27~4.2 mU/L。
1.3 统计方法
采用SPSS 22.0统计软件包对数据进行统计分析,符合正态分布计量资料以±s表示,组间比较采用独立样本t检验;相关性分析采用Pearson检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组血脂水平比较
高TSH肥胖组TC、TG、LDL-C高于单纯性肥胖组,HDL-C低于单纯性肥胖组,差异具有统计学意义(P<0.05)。见表2。
表2 两组血脂水平比较(±s)单位:mmol·L-1

表2 两组血脂水平比较(±s)单位:mmol·L-1
组别 例数 TC TG HDL-C LDL-C高TSH肥胖组426.42±0.312.90±0.230.62±0.217.05±1.86单纯性肥胖组 405.03±0.462.54±0.250.73±0.195.84±1.52 t 16.1166.7912.4833.217 P<0.001 <0.0010.0150.002
2.2 两组血糖水平比较
高TSH肥胖组FPG、2hPBG、HbA1c水平均高于单纯性肥胖组,差异具有统计学意义(P<0.05)。见表3。
表3 两组血糖水平比较(±s)

表3 两组血糖水平比较(±s)
组别 例数FPG/(mmol·L-1)2hPG/(mmol·L-1)HbA1c/%高TSH肥胖组426.69±0.459.02±1.145.80±0.35单纯性肥胖组 406.42±0.448.24±1.175.12±0.42 t 2.7453.0587.979 P 0.0070.003 <0.001
2.3 两组胰岛功能相关指标比较
高TSH肥胖组HOMA-β水平低于单纯性肥胖组,FINS、C肽、HOMA-IR水平高于单纯性肥胖组,差异均具有统计学意义(P<0.05)。见表4。
表4 两组胰岛功能相关指标比较(±s)
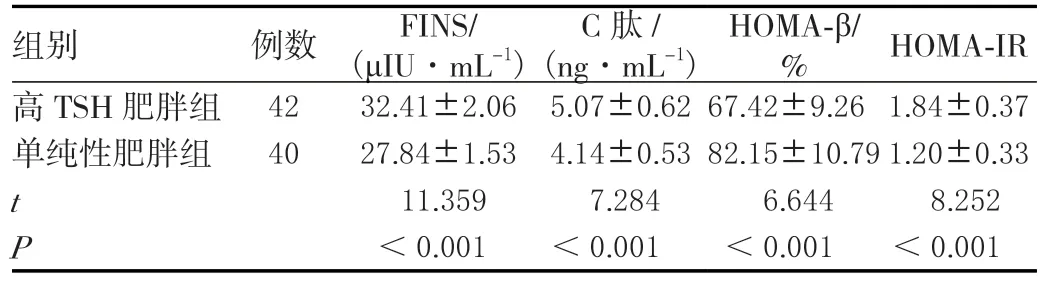
表4 两组胰岛功能相关指标比较(±s)
组别 例数 FINS/(μIU·mL-1)C肽/(ng·mL-1)HOMA-β/ % HOMA-IR高TSH肥胖组4232.41±2.065.07±0.6267.42±9.261.84±0.37单纯性肥胖组 4027.84±1.534.14±0.5382.15±10.791.20±0.33 t 11.3597.2846.6448.252 P<0.001 <0.001 <0.001 <0.001
2.4 两组甲状腺功能相关指标比较
高TSH肥胖组患者TSH水平高于单纯性肥胖组,FT3、FT4水平低于单纯性肥胖组,差异具有统计学意义(P<0.05)。见表5。
表5 两组甲状腺功能相关指标比较(±s)
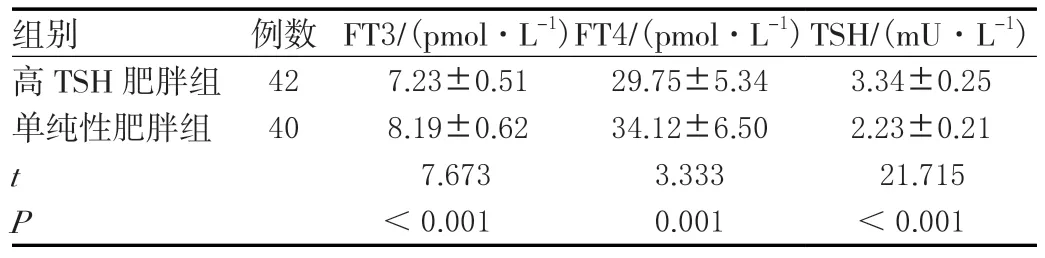
表5 两组甲状腺功能相关指标比较(±s)
组别 例数FT3/(pmol·L-1)FT4/(pmol·L-1)TSH/(mU·L-1)高TSH肥胖组427.23±0.5129.75±5.343.34±0.25单纯性肥胖组 408.19±0.6234.12±6.502.23±0.21 t 7.6733.33321.715 P<0.0010.001 <0.001
2.5 肥胖者TSH与HOMA-β、HOMA-IR的相关性分析
Pearson相关性分析显示,肥胖者血清TSH水平与HOMA-β呈负相关,差异有统计学意义(r=-0.542,P<0.05),肥胖者血清TSH水平与HOMA-IR呈正相关,差异有统计学意义(r=0.689,P<0.05)。见表6。

表6 肥胖者TSH水平与HOMA-β、HOMA-IR的相关性分析
3 讨 论
肥胖是多种代谢综合征(MS)的高危因素,与机体多种内分泌代谢疾病密切相关[5]。有学者发现肥胖大鼠较正常大鼠出现明显的IR和TSH水平升高,提示肥胖可能与IR和甲状腺功能减退有关[6]。目前临床共识认为肥胖是2型糖尿病的危险因素之一,肥胖促进2型糖尿病形成的主导病理因素为胰岛素抵抗。胰岛β细胞通过分泌胰岛素对血糖进行代偿,以维持健康的血糖水平,若胰岛β细胞分泌的代偿性的胰岛素无法平衡胰岛素抵抗,则血糖升高[7-8]。相关研究[9]指出,胰岛β细胞的功能是处于动态变化的,肥胖但血糖水平正常的人群仍然存在β细胞功能受损,因此需要对胰岛素抵抗与胰岛β细胞的功能之间的动态变化进行研究,可对肥胖人群进展为糖尿病进行预防与干预指导。同时肥胖患者机体中蓄积大量脂肪组织,脂肪组织既是能量储存场所,又能分泌多种炎症因子。还有研究[10]认为肥胖患者BMI与血清TSH水平呈正相关,且TSH水平升高是其脂代谢紊乱后果。TSH水平升高是提示甲状腺功能减退的敏感指标,这可能与肥胖者体内出现的脂质代谢紊乱有关[11-12]。 因此我们推测TSH可能通过影响肥胖患者脂代谢过程从而影响胰岛β细胞功能和IR的发生。
本次研究结果显示,高TSH肥胖组TSH高于单纯性肥胖组,FT3、FT4低于单纯性肥胖组,提示高TSH肥胖患者甲状腺功能减退和甲状腺激素分泌不足较单纯性肥胖者更严重。而高TSH肥胖患者TC、TG、HDL-C、LDL-C高于单纯性肥胖组,提示肥胖患者出现甲减后脂代谢紊乱更严重。此外,TSH与胰岛功能密切相关,高TSH肥胖组HOMA-β水平低于单纯性肥胖组,FINS、C肽、HOMA-IR水平高于单纯性肥胖组,提示高TSH肥胖患者胰岛β细胞功能受损和IR较单纯肥胖患者更严重,胰岛素分泌不足,因而引发了血糖水平升高。TSH与BMI呈正相关。Antunes T[13]研究发现,TSH参与脂肪细胞的分化,其机制为TSH相关受体亦在脂肪细胞与前脂细胞中存在,TSH与脂肪细胞中的受体结合,通过CAMP/蛋白激酶信号通路,诱导前脂细胞分化成脂肪细胞。另外有研究发现[14],TSH与胰岛素抵抗相关,高水平的TSH通过诱导前脂细胞分化成脂肪细胞进而参与胰岛素抵抗。同时甲状腺功能正常的肥胖人群中TSH水平较正常人高,同时与糖脂代谢指标呈正相关,证明其与肥胖、血糖的相关性[15]。有学者[16]认为,甲状腺功能减退可引发葡萄糖吸收和肝糖原合成不足,从而影响胰岛β细胞正常功能。IR是2型糖尿病发生的重要病理生理基础,IR的发生提示胰岛素对葡萄糖摄取、糖原合成及脂肪分解抑制作用。目前关于TSH对IR影响及具体机制尚不明确,有学者通过建立肥胖模型大鼠发现,甲状腺组织和睾周脂肪组织中TSH受体表达水平高于正常大鼠,推测TSH可能通过与睾周脂肪组织中TSH受体结合从而参与了IR的发生[17]。IR作为一个亚临床慢性炎症反应过程,其发生与机体的炎症因子密切相关[18]。有学者[19]给行甲状腺切除术的甲状腺癌病人重组TSH发现,短期内急性增加的TSH能明显促进血液中IL-6等炎症因子分泌,推测TSH可能通过增加机体促炎因子水平从而促进IR的发生。Pearson相关性分析显示,肥胖者血清TSH水平与HOMA-β呈负相关,与HOMA-IR呈正相关,提示肥胖患者TSH水平升高可加重IR和胰岛β细胞损伤,且临床中检测肥胖患者TSH水平能在一定程度上判断其胰岛β细胞功能受损情况和IR严重程度。而IR也能在一定程度上影响甲状腺功能。有研究发现,肥胖IR患者多伴随糖脂代谢紊乱而出现代谢性肝病,影响肝脏中T4和T3之间转化及TSH分泌的反馈调节,引发TSH水平的升高[20]。综合以上研究[21-22]认为,升高的TSH能促进脂肪细胞释放炎性因子,诱导IR的发生,而IR引发的高胰岛素血症造成机体血糖升高,高血糖反过来促进血清TSH水平进一步升高,因此TSH与IR存在互为因果关系,共同加重了肥胖患者甲状腺功能不足和增高2型糖尿病的发生风险。
综上所述,肥胖者TSH水平升高能影响胰岛β细胞功能、加重胰岛素抵抗,增加2型糖尿病发生风险。临床工作中应增加对肥胖患者的甲状腺功能筛查,能在一定程度上帮助医师评估IR严重程度并指导进行血糖控制,以减少相关代谢并发症的发生。

