抗生素联合宫腔灌注治疗对慢性子宫内膜炎患者妊娠结局的影响
陈瑶,孙丽君
(1.南京医科大学第二附属医院 生殖中心,江苏 南京 210011;2.南京市江宁医院 生殖中心,江苏 南京 211100)
慢性子宫内膜炎(CE)是一种持续存在的子宫内膜炎症,其表现具有多样性和非特异性,组织学上以内膜间质中浆细胞浸润为特征[1]。CE的临床症状轻微,一部分患者可表现为盆腔不适感、白带增多或点滴出血,四分之一的患者没有任何临床症状[2],所以常被患者和临床医生所忽视。近年来很多研究发现CE在不孕症女性中发生率为2.8%~46%,在反复种植失败(RIF)以及复发性流产(RSA)女性中甚至可以分别高达67.6%和56.8%[3-5]。随着近几年关于CE与不孕症以及反复种植失败(RIF)等疾病之间的研究不断增多,CE越来越受到生殖科医生的重视[6]。未经治疗的CE会降低自然受孕和体外受精的成功率,导致不利的产科结果[7-8]。接受足够抗生素治疗的女性与未接受治疗或有持续性疾病的女性相比,有更高的怀孕成功率[9]。
目前CE诊断的金标准是病理活检中子宫内膜间质浆细胞浸润。但因为取材、HE染色等条件的限制往往不易发现浆细胞,所以CE常常被漏诊[10]。有研究[11]表明,宫腔镜检查视野充足,弥补了组织病理学诊断的遗漏,对慢性子宫内膜炎的诊断、疗效评价、后期随访均有重大意义,较组织病理学的诊断治疗转归更有价值。
随着辅助生殖技术的迅速发展,累积妊娠率已达80%[12],但仍有约10%的患者多次胚胎移植仍未能成功植入,称为反复种植失败(RIF)[13]。目前RIF没有统一的诊断标准,一般是指40岁以下不孕患者经过大于等于3个取卵周期,新鲜或冻融移植周期一共至少移植4枚优质胚胎,仍然未能临床妊娠[14]。本研究选择因反复种植失败(RIF)行宫腔镜检查并诊断为CE的患者作为研究对象,旨在探讨宫腔灌注对冻融胚胎移植(FET)周期结局的影响,从而为临床治疗提供参考。
1 对象与方法
1.1 研究对象
选取2018年3月至2021年12月于南京医科大学第二附属医院生殖中心因RIF拟行再次冻融胚胎移植的患者作为研究对象,在FET前按照CE的宫腔镜诊断标准:(1)基质水肿;(2)局灶或弥漫性腺体周围充血;(3)微小息肉样改变(直径<1 mm)[6,15]对患者进行宫腔镜检查。按照不同的治疗方法将患者分为两组,组1(N=40):口服抗生素;组2(N=37):口服抗生素+宫腔灌注。本研究对象均知情同意,且本研究通过本院医学伦理学委员会批准。
纳入标准:宫腔镜检查诊断CE且宫腔形态正常;子宫内膜发育正常(自然周期或激素替代周期经阴道B超监测内膜厚度≥7 mm);至少有1~2枚Ⅰ~Ⅱ级胚胎者;年龄小于40岁。
排除标准:宫腔形态异常;宫腔粘连;子宫黏膜下肌瘤或子宫内膜息肉直径≥1 cm;卵巢储备功能下降[月经第2 d血清卵泡刺激素(FSH)>10 U/L、两侧卵巢窦卵泡数(AFC)≤5~7枚或AMH<1.1 ng/mL];Ⅲ~Ⅳ级胚胎。
1.2 方法
1.2.1 CE的不同处理方法
组1:多西环素/克拉霉素/左氧氟沙星+甲硝唑联合治疗14 d;组2:在抗生素治疗(同组1)的基础上进行宫腔灌注,患者取膀胱截石位,碘伏常规消毒外阴阴道,采用移植管宫腔灌注,庆大霉素16万U+地塞米松注射液10 mg+注射用绒促性素1000 IU+糜蛋白酶4000 IU混匀作宫腔灌注,持续15 ~30 min,1次/d,14 d为一个疗程。
1.2.2 月经血中炎性因子的测定
(1)标本收集:用子宫输卵管造影管抽取各组患者治疗前后月经第2 d的月经血0.5~2 mL,室温下1500 r/min离心30 min,取上清液置于-80℃冰箱待检。(2)标本检测:采用酶联免疫吸附试验(ELISA)法检测白介素-6(IL-6)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α),按照相关试剂盒(上海恒远生物科技)说明操作。检测波长450 nm,批内及批间变异<10%。
1.2.3 内膜准备及胚胎移植
月经规律、排卵正常的患者进行自然周期准备内膜,不满足以上条件者采用雌孕激素替代周期(即人工周期)准备内膜。雌孕激素替代周期:月经第4 d口服补佳乐(戊酸雌二醇,拜耳)2 mg,3次/d,B超监测子宫内膜形态及厚度,必要时调整剂量;在子宫内膜厚度≥8mm时口服地屈孕酮片(荷兰Abbott Biologicals B.V.)20 mg,2次/d,孕激素第4 d阴道用黄体酮软胶囊100 mg,2次/d;应用孕激素第4 d移植卵裂期胚胎,第6 d移植囊胚。
1.2.4 冻融胚胎移植
胚胎采用玻璃化法进行冷冻和复苏,卵裂期胚胎移植日前1 d解冻,体外培养过夜,囊胚培养1~3 h后,进行Gardner评分。B超监测下,将移植外导管轻轻置入到宫颈内口水平,内芯导管装载胚胎后,将内芯导管通过外套管置入官腔内,距离宫底0.5~1.0 cm处注入胚胎。
1.2.5 黄体支持与随访
胚胎移植后均行常规黄体支持至移植后8周,胚胎移植后均行常规黄体支持,移植后第14 d人绒毛膜促性腺激素(HCG)水平>20 mIU/mL判定为生化妊娠,移植30 d后 B超检测是否有孕囊或胎心搏动。生化妊娠率:生化妊娠周期数/移植周期数×100%;临床妊娠率:临床妊娠周期数/移植周期数×100%;早期流产率:孕12周内自然流产周期数/临床妊娠周期数×100%。
1.2.6 观察指标
比较两组患者的年龄、不孕年限、体重指数(BMI)、基础FSH、基础LH、抗缪勒管激素(AMH)、子宫内膜转化日厚度以及平均移植胚胎数。
1.2.7 统计学方法
采用SPSS 22.0软件进行统计分析。计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 CE患者宫腔镜下表现
患者在治疗前宫腔镜下发现弥漫性、局灶性充血、微小息肉样改变、基质水肿,符合宫腔镜镜下CE的诊断标准[16]。见图1。

图1 宫腔镜下CE宫腔内膜表现
2.2 两组患者基本情况比较
本研究共纳入77例宫腔镜检查诊断为CE的患者,口服抗生素治疗组40例,口服抗生素与宫腔灌注联合治疗组37例。两组间年龄、不孕年限、体重指数(BMI)、基础FSH、基础LH、抗缪勒管激素(AMH)、体重指数(BMI)、子宫内膜转化日厚度以及平均移植胚胎数,两组间差异无统计学意义(P>0.05)。见表1。
表1 两组患者基本情况比较(±s)
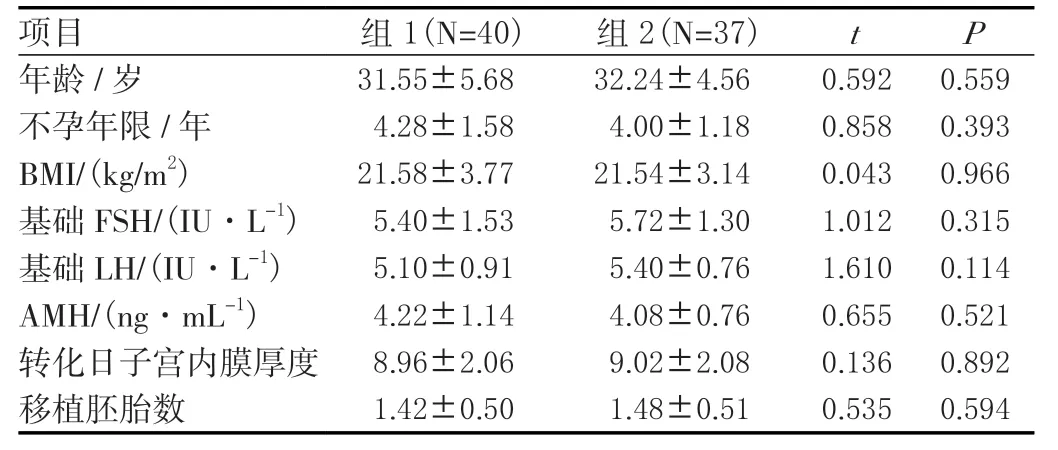
表1 两组患者基本情况比较(±s)
项目 组1(N=40) 组2(N=37) t P年龄/岁 31.55±5.6832.24±4.560.5920.559不孕年限/年 4.28±1.584.00±1.180.8580.393 BMI/(kg/m2) 21.58±3.7721.54±3.140.0430.966基础FSH/(IU·L-1) 5.40±1.535.72±1.301.0120.315基础LH/(IU·L-1) 5.10±0.915.40±0.761.6100.114 AMH/(ng·mL-1) 4.22±1.144.08±0.760.6550.521转化日子宫内膜厚度 8.96±2.069.02±2.080.1360.892移植胚胎数 1.42±0.501.48±0.510.5350.594
2.3 两组治疗前后月经血炎性因子比较
治疗前,两组IL-6、IL-1β、TNF-α水平差异无统计学意义(P>0.05);治疗后,两组IL-6、IL-1β、TNF-α水平治疗后均显著低于治疗前(P<0.001),且组2明显低于组1,差异有统计学意义(P<0.01)。见图2。
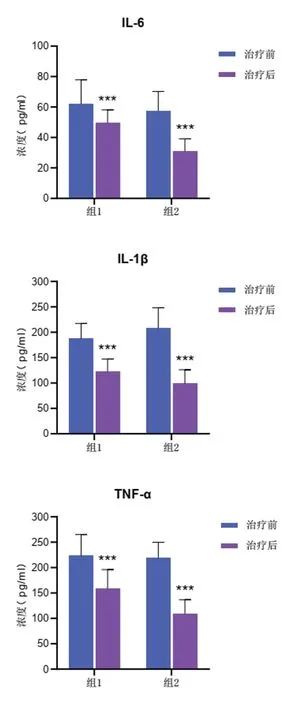
图2 两组治疗前后炎症因子浓度比较(±s)
2.4 两组患者助孕妊娠结局比较
组2临床妊娠率明显高于组1,差异有统计学意义(P<0.05);两组生化妊娠率和早期流产率比较,差异无统计学意义(P>0.05)。见表2。

表2 两组患者助孕妊娠结局比较
3 讨 论
慢性子宫内膜炎(CE)与女性生殖预后密切相关。目前认为CE是一种持续的炎症过程,在此过程中子宫内膜的结构和功能被破坏。由于子宫内膜局部炎症细胞浸润以及炎症介质渗出,子宫内膜微环境和子宫内膜容受性发生改变,不利于胚胎着床[17]。RIF可能是由许多不同的因素引起的,包括宫腔异常、子宫内膜容受性、免疫因素和胚胎因素。在过去的几年中,越来越多的生殖医学专家认为子宫内膜容受性下降与RIF密切相关。CE发生时,病原体会刺激机体的免疫反应,产生大量免疫细胞和各种细胞因子,使子宫内膜微环境具有细胞和胚胎毒性,在胚胎植入过程中通过改变有关基因及雌孕激素受体的表达,从而影响子宫内膜基质细胞的蜕膜化、绒毛血管生成以及子宫的收缩,最后造成RIF、RSA等不良妊娠结局。所以,CE的治疗仍然是生殖科医生在日常临床工作中必须解开的难题。
有研究[18]发现在CE患者的子宫内膜中,多种炎症因子的基因表达谱与对照组相比存在显著差异,巨噬细胞炎性因子参与调节滋养细胞凋亡,最终导致胚胎植入失败或者胎盘形成不良[19]。CE治愈后,合并CE的RIF患者首次胚胎植入的活产率显著高于不合并CE的RIF患者[20]。目前CE临床诊断的金标准是病理活检发现内膜间质中浆细胞浸润,但是寻找浆细胞可能会受到许多条件的阻碍,例如单核炎症细胞浸润、基质细胞增殖、基质细胞浆细胞样出现或月经前明显的蜕膜前反应等。并且活检所得到的子宫内膜组织如果非常少,可能会导致CE的漏诊。所以宫腔镜的诊断对CE的治疗显得尤为重要,能很大程度上减少CE的漏诊。通过病原体检测鉴定CE的致病微生物仍然较困难,所以对于CE的治疗多为经验性治疗。CE的主要病因是病原体感染内膜形成子宫内膜的慢性炎症,口服抗生素治疗的有效性充分证明了这一观点。口服抗生素过去一直是治疗CE的主要途径,但口服抗生素也存在许多限制条件,如药物浓度较低、耐药性,尽管子宫内膜间质中浆细胞被清除,但它们最初的存在降低了子宫内膜的容受性,导致临床妊娠率持续下降,对于部分CE患者口服抗生素的有效性有限。本研究中两组血炎症因子IL-6、IL-1β、TNF-α水平治疗后均显著低于治疗前,证明两种治疗方式都可明显改善CE患者子宫内膜炎性环境,但与组1的患者比较, 组2的患者月经血炎性因子水平下降更明显,主要由于CE可能同时存在病原微生物感染和局部免疫环境的改变,采用口服抗生素联合宫腔灌注治疗局部药物浓度高,抗炎效果更好。最近的一篇文献报道也证实了宫腔灌注的疗效,宫内抗生素输注的方法使三名经历了多次体外受精失败合并CE的患者得以受孕,这3例患者经历了常规抗感染治疗,均无法治愈,在采用宫腔灌注抗生素治疗后,最终获得了临床妊娠[21]。
宫腔灌注给药的优点是局部浓度高,系统效应小,成本低,宫内抗生素给药系统可以将抗生素直接作用在宫腔内,这是一种有利的、辅助的选择,因为它最小化了全身毒性,并使用较少的药物来最大化作用部位的浓度,从而杀死细菌。同时在RIF合并CE患者的治疗中,仅仅杀灭细菌是不够的,还应考虑改善子宫内膜容受性,因此本研究综合考虑CE可能同时存在病原微生物感染,局部免疫微环境和子宫内膜容受性的改变,在使用抗生素局部灌注的同时,还添加了地塞米松、绒促性素和糜蛋白酶。经治疗后两组的患者月经中促炎因子明显降低,且口服抗生素联合宫腔灌注组炎症因子低于口服抗生素组。口服抗生素联合宫腔灌注组的临床妊娠率明显高于口服抗生素组,与相关研究[22]结果一致。宫腔灌注治疗后改善了宫腔免疫微环境和子宫内膜容受性,其主要机制可能与灌洗液冲洗宫腔改变宫腔微环境,庆大霉素局部消除病原体,地塞米松改变宫腔的免疫环境,人绒毛膜促性腺激素改善子宫内膜容受性有关。
综上所述,通过局部抗炎、改善宫腔免疫微环境及增加子宫内膜容受性,有助于胚胎在宫腔的着床和发育,从而提高了临床妊娠率,而生化妊娠率、早期流产率等没有明显差异可能与样本量小有关,后期需要加大样本量进一步验证。

