OCT4及其假基因POU5F1B在子宫内膜腺癌中的表达及临床意义▲
张靖羚 杨雅静 周留林
(蚌埠医学院附属泰兴市人民医院妇产科,江苏省泰兴市 225400)
子宫内膜癌是发生于子宫内膜的一组上皮性恶性肿瘤,以腺癌多见。2020年,全球子宫内膜癌新发病例数和死亡病例数分别为417 367例、97 370例[1]。子宫内膜癌起病较为隐匿,早期临床症状不典型,易被忽视,导致患者不能及时就诊而预后不佳。目前子宫内膜癌的治疗方法主要有手术、放疗、药物(化学药物及激素)治疗、靶向治疗。手术治疗的标准术式多为全子宫、双附件切除及盆腹淋巴结清扫。目前子宫内膜癌的发病人群呈年轻化趋势[2],而年轻且要求保留生育功能的子宫内膜癌患者对传统手术治疗较为抵触[3]。因此,如何实现子宫内膜癌的早期诊治成为目前临床上亟待解决的难题,而寻找新型的生物标志物对于子宫内膜癌的早期诊断、靶向治疗及预后评估具有重要意义。
八聚体结合转录因子4(octamer-binding transcription factor 4,OCT4)参与胚胎干细胞的分化和调节,其主要表达于胚胎时期[4]。研究表明, OCT4基因缺失时,胚胎干细胞会失去自我更新的能力,并向胚胎外的滋养外胚层细胞分化[5]。OCT4还表达于生殖细胞肿瘤,如男性泌尿生殖细胞来源的恶性肿瘤或胚胎癌[6-7]。此外,在某些与原始细胞生殖及发育关联不密切的肿瘤细胞和组织中也可以检测到OCT4,如膀胱癌、肺癌、乳腺癌等[8-10]。研究发现OCT4在部分女性生殖系统的恶性肿瘤中异常表达,如卵巢癌、宫颈癌等[11-12]。但OCT4在子宫内膜癌中的表达情况尚不明确,且其在子宫内膜癌中的具体作用尚不清楚。假基因是与编码基因序列高度同源的非编码基因,由于重复基因的反复拷贝,导致其失去原有的功能。既往研究认为假基因是进化过程中被淘汰的基因片段[13]。然而近年来有研究表明假基因具有重要的遗传功能。POU结构域5类转录因子1B(POU domain class 5 transcription factor 1B,POU5F1B),即OCT4假基因5,与亲本基因OCT4有95%的同源性,是一种OCT4假基因。POU5F1B可作为一种长链非编码RNA调控多种肿瘤的发生和发展,如食管癌、胃癌等[14-15]。有研究显示,POU5F1B在宫颈癌细胞中呈高表达,沉默假基因POU5F1B会导致其亲本基因OCT4的表达量下降[16]。这说明在部分肿瘤中POU5F1B与OCT4的表达存在一定的关联性。但是目前尚无关于两者在子宫内膜癌中的生物学作用的研究。本研究探讨两者在子宫内膜腺癌中的表达情况及其与患者临床病理参数之间的关系,旨在为子宫内膜癌患者的疾病诊断及病情评估提供新思路。
1 材料与方法
1.1 临床资料 纳入2018年1月至2020年11月蚌埠医学院附属泰兴市人民医院收治的62例子宫内膜腺癌患者(观察组)和50例子宫内膜良性病变患者(对照组)。收集观察组患者手术切除的子宫内膜腺癌组织标本及对照组患者手术切除的增生期子宫内膜组织标本,两类组织均包括石蜡标本(主要用于免疫组化检测)和临床新鲜组织标本,其中新鲜标本组织在离体30 min内取材,置于-80 ℃冰箱中贮存备用(主要用于实时荧光定量PCR)。纳入标准:(1)观察组患者均经病理证实为子宫内膜腺癌,对照组患者均因子宫肌瘤行全子宫切除术,且术后病理证实子宫内膜为增生期;(2)所有患者均为初始治疗;(3)所有患者的临床病理资料完整,并知情同意参加本次研究。排除标准:(1)术前接受放化疗治疗的患者;(2)合并其他部位的恶性肿瘤患者;(3)影像学资料、病例资料不完善的患者。观察组患者年龄48~70(57.04±5.86)岁;国际妇产科联盟分期为Ⅰ期32例,Ⅱ~Ⅳ期30例,其中ⅠA期患者均行全子宫+双附件切除,ⅠB期及以上患者均行子宫内膜癌全面分期手术;无淋巴结转移共33例,有淋巴结转移共29例;浸润肌层深度≤1/2共34例,浸润肌层深度>1/2共28例;分化程度为高分化共36例,中低分化共26例。对照组患者年龄45~63(53.07±5.71)岁。由2名以上的主任医师进行临床诊断,由2名病理科主任医师进行病理诊断。本研究经过本院医学伦理委员会批准。
1.2 主要试剂及仪器 兔抗人OCT4多克隆抗体(批号:ab19857)购自英国Abcam公司,免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)法即用型试剂盒(批号:SV0002)、二氨基联苯胺(diaminobenzidine,DAB)显色剂(批号:AR1022)、乙二胺四乙酸抗原修复液(批号:AR0023)均购自武汉博士德生物工程有限公司。TRIzol试剂(批号:15596026)购自美国Thermo Fisher Scientific公司。反转录试剂盒(批号:DRR06A)、SYBR®Premix Ex TaqTMⅡ试剂盒(批号:DRR081A)购自日本TaKaRa公司。
1.3 免疫组织化学法检测OCT4蛋白表达情况 常规制备组织石蜡切片,经二甲苯脱蜡、梯度乙醇脱水后,于乙二胺四乙酸中进行抗原热修复,然后于3%过氧化氢中孵育10 min消除内源过氧化酶活性,添加5%的山羊血清,37 ℃下封闭1 h后,加入OCT4一抗(用抗原稀释液按1 ∶500的比例稀释)100 μL,于4 ℃下孵育过夜。以PBS作为阴性对照,添加兔抗人IgG(武汉博士德生物工程有限公司,批号:SV0002)100 μL,37 ℃下孵育30 min后,用PBS洗涤3次,5 min/次,行DAB显色后,于光学显微镜(Olympus公司)下观察图像。OCT4蛋白主要定位在细胞核内,呈棕黄色至深棕色。根据着色细胞数及染色程度确定OCT4的表达情况:着色细胞数<10%或未染色,记(-);着色细胞占10%~20%且染色弱至中等,记(+);着色细胞占10%~20%且染色强,或着色细胞占 20%~50%且染色弱至中等,记(++);着色细胞占20%~50%且染色强,或着色细胞>50%,记(+++)。其中(-)和(+)定义为低表达,(++)和(+++)定义为高表达。
1.4 实时荧光定量PCR检测OCT4 mRNA和POU5F1B mRNA的表达水平 从-80 ℃冰箱中取出新鲜组织标本,切取约100 mg组织转入研磨器中并加入液氮磨碎,加入1 mL TRIzol试剂,用匀浆仪进行匀浆处理,样本的体积不超过TRIzol试剂的10%。按照 TRIzol试剂说明书的方法提取组织总RNA,采用核酸蛋白检测仪(Bio-Rad公司,型号:CFX96)检测RNA浓度。按照反转录试剂盒说明书的操作步骤将总RNA转录为cDNA,然后采用SYBR®Premix Ex TaqTMⅡ试剂盒试剂盒检测POU5F1B、OCT4的mRNA相对表达水平。引物序列由生工生物工程(上海)股份有限公司设计(见表1)。总反应体系为25 μL,包括SYBR® Premix Ex TaqTMⅡ12.5 μL、cDNA 2 μL、上下游引物各1 μL,加 Nase Free H2O 8.5 μL。每个样本均设置 3个复孔。POU5F1B反应程序:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,共40个循环。OCT4反应程序:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火64 ℃ 30 s,延伸72 ℃ 30 s,共40个循环。以GADPH作为内参基因,根据2-ΔΔCt法计算POU5F1B mRNA、OCT4 mRNA的相对表达水平。

表1 目的基因PCR的引物序列
1.5 统计学分析 采用SPSS 21.0、Microsoft Office Excel、GraphPad Prism 5.0软件进行统计分析及绘图。计量资料以(x±s)表示,两组间比较采用两独立样本t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组组织中POU5F1B mRNA和OCT4 mRNA表达水平的比较 观察组组织中的POU5F1B mRNA、OCT4 mRNA表达水平均高于对照组(均P<0.05),见表2。
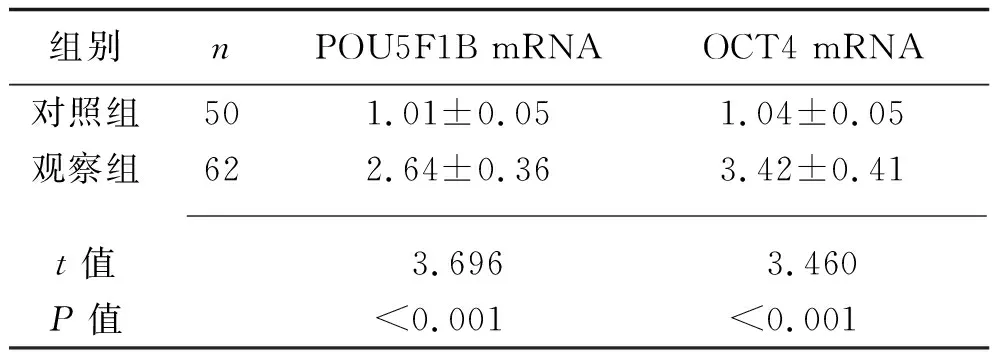
表2 两组组织中POU5F1B mRNA和OCT4 mRNA相对表达水平的比较(x±s)
2.2 两组组织中OCT4蛋白表达情况的比较 免疫组织化学分析结果显示,正常组、观察组组织中OCT4蛋白的高表达率分别为38.0%(19/50)、61.3%(38/62),观察组组织中的OCT4蛋白高表达率高于对照组(χ2=6.007,P=0.014)。见表3和图1。
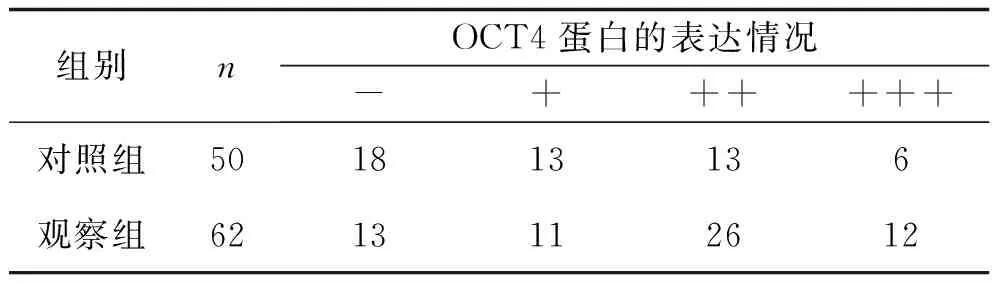
表3 两组OCT4蛋白表达情况的比较(n)
2.3 观察组患者子宫内膜腺癌组织OCT4蛋白表达情况与其临床病理特征的关系 不同年龄、分化程度的子宫内膜腺癌患者的OCT4蛋白表达情况比较,差异均无统计学意义(均P>0.05);而临床分期为Ⅱ~Ⅳ期、肌层浸润深度>1/2、有淋巴结转移的子宫内膜腺癌患者的OCT4蛋白高表达率分别高于临床分期为Ⅰ期、肌层浸润深度≤1/2、无淋巴结转移的患者(均P<0.05)。见表4。
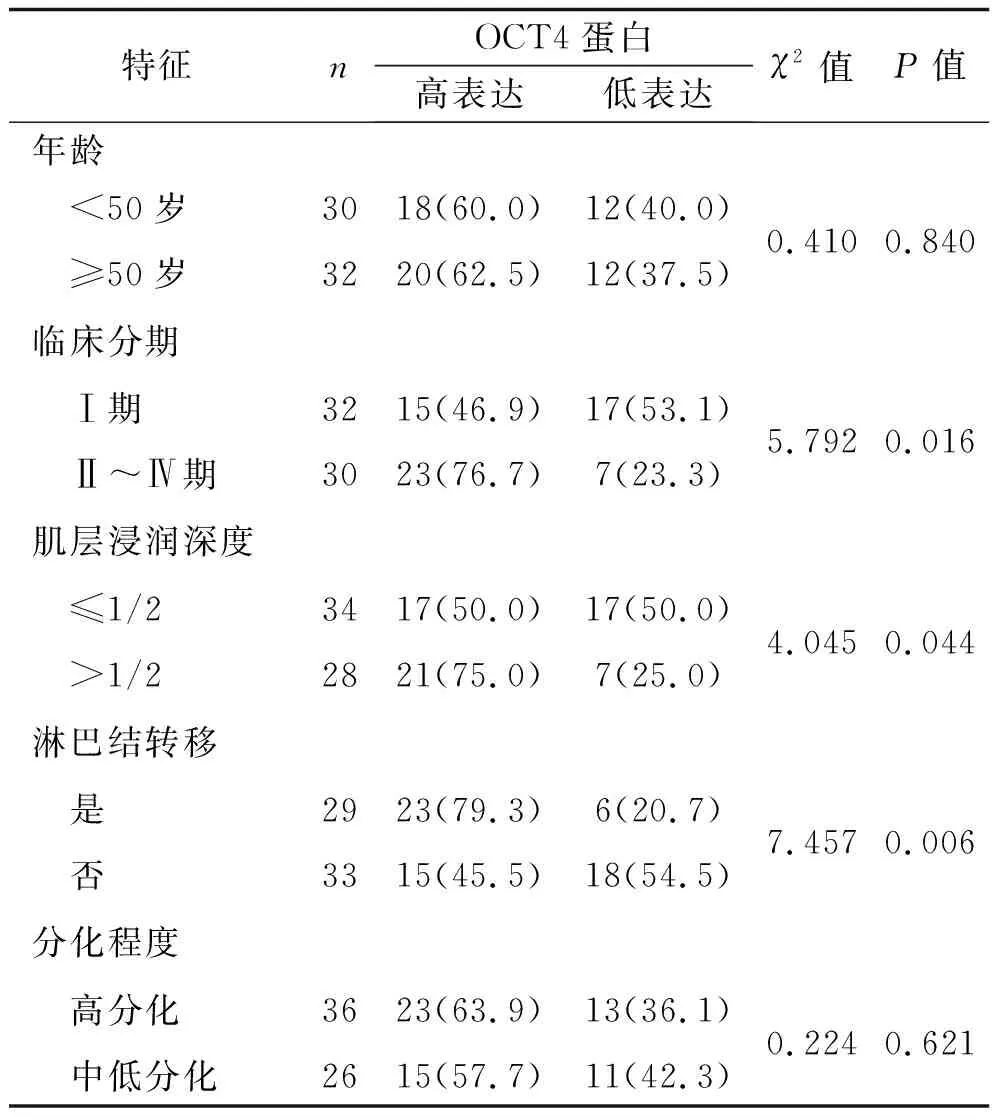
表4 OCT4蛋白表达与子宫内膜腺癌患者临床病理参数的关系[n(%)]
3 讨 论
OCT4基因不仅可在胚胎发育过程中维持脂肪干细胞的多能性和自我更新性,还可在肿瘤干细胞的增殖分化过程中起到调控作用[17]。大量研究显示OCT4表达异常与多种肿瘤的发生及发展有关,如胃癌[18]、结直肠癌[19]。此外,OCT4在鉴别子宫内膜与卵巢双发恶性肿瘤的原发灶和转移灶中有一定的价值[20]。本研究结果显示,子宫内膜腺癌组织中的OCT4 mRNA表达水平和蛋白高表达率均高于增生期子宫内膜组织(均P<0.05),提示OCT4表达上调可能会导致子宫内膜癌变。进一步分析发现,临床分期为Ⅱ~Ⅳ期、肌层浸润深度>1/2、有淋巴结转移的子宫内膜腺癌患者的OCT4蛋白高表达率分别高于临床分期为Ⅰ期、肌层浸润深度≤1/2、无淋巴结转移的患者(均P<0.05)。这提示OCT4蛋白的表达情况可能与子宫内膜腺癌的病情严重程度有关。由此推测,子宫内膜癌组织中OCT4的异常表达可能促进子宫内膜癌细胞的迁移、侵袭,进而参与子宫内膜癌的进展。此外,OCT4蛋白在Ⅱ~Ⅳ期子宫内膜腺癌患者中的高表达率高于Ⅰ期子宫内膜腺癌患者,提示OCT4在晚期子宫内膜癌中的表达可能更高,虽然OCT4不能替代手术病理分期成为诊断的金标准,但是其或许可以作为评估晚期子宫内膜癌的潜在分子标志物。
假基因与其亲本基因具有高度的同源性,但它们长期以来一直被认为是无功能的,并被认为是随机突变的[21],经常被用于作为校准分子进化中各种模型的参数,如中性突变率的估计。近年来有大量研究表明,假基因对基因及蛋白水平的调控作用不容忽视,例如磷酸酶-张力蛋白同源性基因假基因1是磷酸酶-张力同源性基因的假基因,磷酸酶-张力蛋白同源性基因假基因1可以通过某些微小RNA发挥作用,从而影响磷酸酶-张力同源性基因的表达,这在乳腺癌[22]、骨质疏松症[23]的发生和/或发展中发挥一定的作用。POU5F1B作为OCT4的假基因,对肿瘤的进展既可以发挥正向调控作用,也可以发挥负向调控作用,例如,在宫颈癌细胞中下调假基因POU5F1B后,肿瘤细胞的增殖、迁移及侵袭能力均下降,亲本基因的表达量也明显降低[16];POU5F1B在食管癌[13]、胃癌[14]、肝癌[24]中充当原癌基因促进肿瘤进展,而在急性髓性白血病中POU5F1B则是作为一种负向调节因子抑制肿瘤进展[25]。本研究通过实时荧光定量PCR法检测POU5F1B mRNA在子宫内膜腺癌组织中的表达情况,以初步了解POU5F1B在子宫内膜腺癌中的作用。结果显示POU5F1B mRNA在子宫内膜腺癌中的表达水平高于增生期子宫内膜组织(均P<0.05),提示POU5F1B有可能会促进子宫内膜癌的发生和进展,属于促癌因子。关于假基因的作用机制,Hu等[26]研究发现,假基因可以在转录和转录后水平调控亲本基因的表达,在转录水平上,假基因可能会与基因的启动子相互作用,例如,由假基因产生的反义RNA可以与同源亲本基因的正义链mRNA结合,从而抑制翻译或形成能够抑制亲本基因表达的小干扰RNA序列,另外假基因还可以作为竞争性内源性RNA,通过竞争共享的miRNA来调节亲本基因mRNA的表达水平。假基因POU5F1B可能就是通过调控miRNA的表达来调节OCT4的表达,从而促进肿瘤的发生和进展[27]。POU5F1B与OCT4基因在子宫内膜腺癌中的表达均升高,结合上述研究结果,推测POU5F1B异常表达可能与OCT4表达异常有关联,假基因POU5F1B可能是通过调控OCT4的表达来参与子宫内膜腺癌的发生和发展,两者共同参与子宫内膜腺癌的发生和发展,但是目前其具体的调控机制尚不明确。
综上所述,OCT4及其假基因POU5F1B在子宫内膜腺癌组织中高表达,并且OCT4蛋白的表达情况与子宫内膜腺癌患者的临床分期、浸润深度、淋巴结转移有关。假基因POU5F1B可能通过调控OCT4来影响子宫内膜腺癌的发生和发展,两者或可作为诊断子宫内膜癌的潜在分子标志物,对评估子宫内膜癌患者的病情有一定参考价值。但是两者的具体调控机制尚不明确,有待进一步研究探讨。

