地衣芽孢杆菌-角蛋白酶联合降解羽毛体系的优化及产物应用
张宝玉, 彭 政, 张 娟, 李江华
(1.江南大学生物工程学院;2.江南大学工业生物技术教育部重点实验室/未来食品科学中心;3.江南大学食品合成生物技术教育部工程研究中心,江苏 无锡 214122)
禽肉加工业的蓬勃发展导致全世界范围内每年产生约几百万吨羽毛废弃物[1],这些废弃物的处理成为亟待解决的问题.羽毛中含有超过85%的粗蛋白和各种必需氨基酸,还含有维生素和生长因子等[2].羽毛中的蛋白质主要是角蛋白,角蛋白富含胱氨酸,会形成大量二硫键,使得羽毛具有坚硬的稳定结构而难以被降解[3].
目前,羽毛的加工处理方法主要有高温高压水解法、化学法、酶法和微生物法.其中:高温高压水解法和化学法存在能耗高、污染大和水解产物中氨基酸破坏严重等问题[4-5];酶法和微生物法因环境友好、能耗低和水解产物营养价值高而被广泛应用.自然界中能降解羽毛的微生物主要有芽孢杆菌属(Bacillus)、曲霉属(Aspergillus)、链霉菌属(Streptomyces)等[6-8].这些微生物通过产角蛋白酶的多酶降解体系和自身代谢活动,实现对羽毛的降解[9].Huang et al[10]发现,假单胞菌H11在48 h内对10 g·L-1羽毛的降解率为88.8%;Li et al[11]筛选到一株链霉菌SCUT-3,其可在36 h内完全降解10 g·L-1的羽毛.但是,这些菌株可降解的羽毛量十分有限,降解效率低,无法满足工业应用需求.Peng et al[12]利用角蛋白酶和亚硫酸钠协同作用降解羽毛,12 h后可观察到100 g·L-1羽毛被完全水解,且产物中的氨基酸转化率达56.6%.郝鲁江等[13]将碱性蛋白酶和角蛋白酶复配,酶解36 h后10 g·L-1羽毛的降解率达到79.8%.但是,基于角蛋白酶的酶解需要化学还原剂或其他多种蛋白酶的协同作用,且水解产物的脱盐和酶制剂的成本较高,限制了其在工业上的广泛应用.地衣芽孢杆菌(B.licheniformis) BBE11-1为本实验室筛选的一株能分泌角蛋白酶的菌株,且其具有半胱氨酸代谢和亚硫酸盐分泌途径,可为羽毛降解提供还原力[14];角蛋白酶KerZ1是本实验室构建的工程菌株WB600-pP43NMK-ker的发酵产物[12].
本研究拟利用B.licheniformisBBE11-1和角蛋白酶KerZ1的协同作用水解羽毛,通过单因素和正交试验探究B.licheniformisBBE11-1种子液培养时间、接种量以及角蛋白酶添加时间、酶活性、水解温度、pH和水解时间对羽毛降解效果的影响,以期为羽毛降解工艺的开发提供依据.
1 材料与方法
1.1 材料
羽毛:鸭毛和鸡毛都收集于江苏省无锡市家禽市场,用自来水冲洗后,经121 ℃高温处理30 min,置于65 ℃烘箱中干燥24 h,待用.
菌株:B.licheniformisBBE11-1(CCTCC NO.M2011319)、枯草芽孢杆菌(B.subtilis) WB600由本实验室保藏;角蛋白酶重组菌株WB600-pP43NMK-ker由本实验室构建,其基因来源于B.licheniformisBBE11-1的角蛋白酶基因ker(NCBI数据库登录号:JX504681).
可溶性角蛋白,购自梯希爱(上海)化成工业发展有限公司;酵母粉、蛋白胨,购自OXIOD公司;其他试剂购自国药集团化学试剂有限公司.
LB液体培养基:酵母粉5.0 g·L-1、蛋白胨10.0 g·L-1、氯化钠10.0 g·L-1,pH 7.0,121 ℃灭菌15 min.发酵培养基:蔗糖20.0 g·L-1、酵母粉10.0 g·L-1、蛋白胨20.0 g·L-1、Na2HPO4·12H2O 6.0 g·L-1、KH2PO43.0 g·L-1、MgSO4·7H2O 0.3 g·L-1,pH 7.0,121 ℃灭菌15 min.羽毛培养基:鸡毛或鸭毛100.0 g·L-1、KH2PO40.7 g·L-1、K2HPO41.4 g·L-1、NaCl 0.5 g·L-1、MgSO40.1 g·L-1,pH 7.0,121 ℃灭菌15 min.
1.2 仪器与设备
恒温培养箱,购自上海跃进医疗器械有限公司;恒温摇床,购自上海知楚仪器有限公司;GI54DWS型灭菌器,购自美国Zealway公司;台式高速离心机,购自德国Eppendorf公司;UVmini-1280紫外分光光度计,购自岛津公司;pH计,购自美国OHAUS公司.
1.3 材料制备和指标测定
1.3.1 角蛋白酶KerZ1粗酶液制备 取保藏于超低温冰箱的菌株WB600-pP43NMK-ker,于LB平板(含50 mg·L-1卡那霉素)上划线活化,37 ℃倒置培养.挑取单菌落至2 mL LB液体培养基(含50 mg·L-1卡那霉素)中,37 ℃、220 r·min-1培养12~16 h,按5%(体积分数)接种量接种至250 mL三角瓶[含50 mL发酵培养基(含50 mg·L-1卡那霉素)]中,37 ℃、220 r·min-1培养24 h.发酵菌液经8 000 r·min-1离心10 min,上清液即为粗酶液.
1.3.2 菌株B.licheniformisBBE11-1种子液培养 取保藏于超低温冰箱的B.licheniformisBBE11-1甘油菌,于LB平板上划线活化,37 ℃倒置培养.挑取单菌落至2 mL LB液体培养基中,37 ℃、220 r·min-1培养12~16 h,即为菌株B.licheniformisBBE11-1种子液.
1.3.3 角蛋白酶活性测定 参考冒鑫哲[15]的方法:将150 μL 50 mmol·L-1Gly-NaOH 缓冲液(pH 9.0)、100 μL 2.5%(体积分数)可溶性角蛋白和50 μL稀释200倍的粗酶液混合均匀,于60 ℃下反应20 min,再加入200 μL 4%(质量分数)三氯乙酸终止反应,室温下8 000 r·min-1离心3 min;取200 μL上清液,加1 mL 4%(质量分数)Na2CO3和200 μL福林酚试剂混匀,50 ℃显色10 min,测定其在660 nm处的光密度.对照组中先将粗酶液与三氯乙酸混合再加可溶性角蛋白,其余操作与处理组相同.
角蛋白酶活性定义:在660 nm处光密度值每分钟增加0.001为一个酶活性单位(U).
1.3.4 羽毛降解率计算 羽毛降解率按照减重法[16]计算:羽毛水解完成后,经滤纸过滤,残渣用蒸馏水冲洗2~3次,65 ℃烘干24 h,称重,计算减重和降解率.
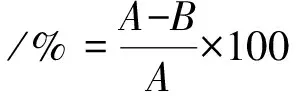
(1)
式中:A为初始羽毛干重(g);B为降解后羽毛残渣干重(g).
1.3.5 氨基酸含量测定 使用氨基酸分析仪(日立L-8900,日本)检测羽毛水解产物上清液中的氨基酸含量.将羽毛水解产物过滤获得水解液,8 000 r·min-1离心10 min,保留上清液,等体积加入10%(质量分数)磺基水杨酸,混合均匀,4 ℃静置4 h,12 000 r·min-1离心10 min;取上清液,加入0.02 mol·L-1HCl(GR)稀释至0.1 mmol·L-1,通过0.22 μm的膜滤器过滤至样品瓶,等待上机检测.
1.4 菌株B.licheniformis BBE11-1和角蛋白酶单独水解
1.4.1 菌株B.licheniformisBBE11-1单独水解 将活化后的B.licheniformisBBE11-1种子液按10%(体积分数)接种量接种至羽毛培养基,37 ℃、220 r·min-1水解36 h,计算羽毛降解率.
1.4.2 角蛋白酶单独水解 将羽毛按照100 g·L-1的量添加到角蛋白酶粗酶液(角蛋白酶活性100 kU·mL-1)中,在60 ℃、pH 10的条件下水解24 h,计算羽毛降解率.
1.5 菌株B.licheniformis BBE11-1和角蛋白酶联合水解
1.5.1 菌株B.licheniformisBBE11-1种子液培养时间优化 取培养6、8、10、12、14、16 h的B.licheniformisBBE11-1种子液,接种至羽毛培养基,随后添加终酶活为30 kU·mL-1的角蛋白酶液,37 ℃、220 r·min-1条件下水解24 h后,计算羽毛降解率.
1.5.2 菌株B.licheniformisBBE11-1接种量优化 将活化后的B.licheniformisBBE11-1种子液分别按5%、10%、15%、20%、25%、30%的接种量接种至羽毛培养基,8 h后添加终酶活为30 kU·mL-1的角蛋白酶液,37 ℃、220 r·min-1条件下水解24 h后,计算羽毛降解率.
1.5.3 角蛋白酶添加时间优化 分别在B.licheniformisBBE11-1种子液接种至羽毛培养基0、4、8、12、16 h后,添加终酶活为30 kU·mL-1的角蛋白酶液,37 ℃、220 r·min-1条件下水解24 h后,计算羽毛降解率.
1.5.4 角蛋白酶活性优化 将B.licheniformisBBE11-1种子液接种至羽毛培养基,再分别按照低(5 kU·mL-1)、中(20和50 kU·mL-1)、高(100 kU·mL-1)终酶活水平添加角蛋白酶液,37 ℃、220 r·min-1条件下水解24 h后,计算羽毛降解率.
1.5.5 菌株B.licheniformisBBE11-1和角蛋白酶联合水解条件的优化 采用L16(45)正交设计,以降解率为指标确定菌-酶联合水解条件,各因素水平见表1.通过正交试验获得最佳水解条件,并测定该条件下的羽毛降解率.
1.6 水解液对WB600-pP43NMK-ker菌株生长及其酶活性的影响测定
设置2种处理:将LB培养基中的酵母粉和蛋白胨替换成10%(体积分数)无菌羽毛水解液;在LB培养基中添加10%(体积分数)无菌羽毛水解液.每个处理设置3个重复,对照组添加等量无菌水,其余操作同处理组.挑取WB600-pP43NMK-ker单菌落至2 mL LB培养基中,37 ℃、220 r·min-1培养12 h,按5%接种量分别接种至上述培养基,37 ℃、220 r·min-1培养24 h,测定D600 nm值和发酵上清液中的角蛋白酶活性.

表1 正交试验各因素水平的设计Table 1 Design of factor level in the orthogonal test
1.7 数据处理与分析
采用SPSS 24.0软件的ANOVA和Duncan′s方法(α=0.05)进行统计分析,使用Origin 2019软件绘图.所有试验均设置3组重复,结果表示为平均值±标准差.
2 结果与分析
2.1 菌株B.licheniformis BBE11-1和角蛋白酶单独水解效果
B.licheniformisBBE11-1对鸭毛和鸡毛的降解率分别为59.0%±2.3%和35.5%±0.9%.水解前、后形态见图1A、1C,羽毛降解程度较低.角蛋白酶KerZ1对鸭毛和鸡毛的降解率分别为56.0%±1.4%和35.0%±1.7%,鸭毛被水解成液体状但不完全(图1B),鸡毛呈糊絮状但仍可见明显羽毛纤维(图1D),水解效果有待提高.
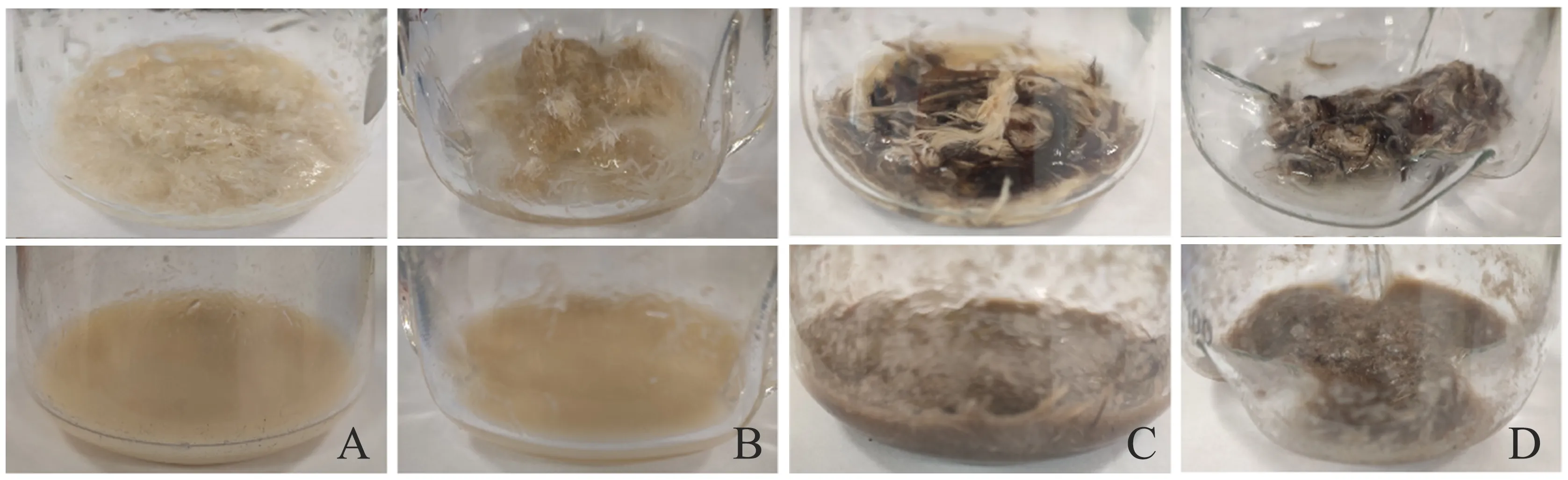
A.B.licheniformis BBE11-1单独水解鸭毛前、后;B.角蛋白酶单独水解鸭毛前、后;C.B.licheniformis BBE11-1单独水解鸡毛前、后;D.角蛋白酶单独水解鸡毛前、后.图1 B.licheniformis BBE11-1和角蛋白酶单独水解羽毛效果Fig.1 Degradation effect of B.licheniformis BBE11-1 and keratinase alone
2.2 菌株B.licheniformis BBE11-1和角蛋白酶联合水解效果
2.2.1 菌株B.licheniformisBBE11-1种子液培养时间的优化 由图2可知,不同培养时间的种子液对鸭毛和鸡毛的降解率分别为52.00%~57.33%和55.33%~58.67%.为缩短生产周期和降低成本,后续B.licheniformisBBE11-1种子液培养时间定为6 h.
2.2.2 菌株B.licheniformisBBE11-1接种量的优化 由图3可知:B.licheniformisBBE11-1接种量在5%~20%时,鸭毛降解率为60%~64%,鸡毛降解率为52%~55%;随着菌株B.licheniformisBBE11-1接种量的增加,羽毛降解率总体上呈下降趋势.过高的菌株接种量一方面带入了部分营养成分,不利于形成营养胁迫的羽毛降解环境,另一方面会造成溶氧不足,影响酶的合成[17].因此,正交试验中接种量范围选择小于10%.
2.2.3 角蛋白酶添加时间的优化 由图4可以看出:降解鸭毛时角蛋白酶最佳添加时间为B.licheniformisBBE11-1种子液接种至羽毛培养基4~12 h,降解率为62%~64%;降解鸡毛时角蛋白酶最佳添加时间为B.licheniformisBBE11-1种子液接种至羽毛培养基0~8 h,降解率为54%~60%.为了操作便利和简化工序,选择0 h添加角蛋白酶,即在接种B.licheniformisBBE11-1种子液的同时添加角蛋白酶.
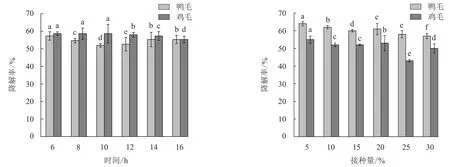
柱上不同字母表示不同时间之间有显著差异(P<0.05).图2 B.licheniformis BBE11-1种子液培养时间对降解率的影响Fig.2 Effect of B.licheniformis BBE11-1 culture time on degradation rate
2.2.4 角蛋白酶活性的优化 由图5可知,角蛋白酶活性在5~100 kU·mL-1时,羽毛降解率随角蛋白酶活性升高呈先增大后减小的趋势.在低酶活水平(5 kU·mL-1)时,鸭毛和鸡毛降解率最低,分别为31.33%±0.9%和44.67%±1.1%;在中酶活水平(20和50 kU·mL-1)时,降解率最高,鸭毛在酶活性20 kU·mL-1时降解率达66.67%±1.4%,鸡毛在酶活性50 kU·mL-1时降解率为61.33%±0.8%;在高酶活水平(100 kU·mL-1)时,鸭毛和鸡毛降解率略低于中酶活水平.可见,在菌-酶联合降解羽毛体系中,并非角蛋白酶活性越高越好,这与之前的报道[17]一致.因此,选择20~50 kU·mL-1酶活性进行后续的正交试验.
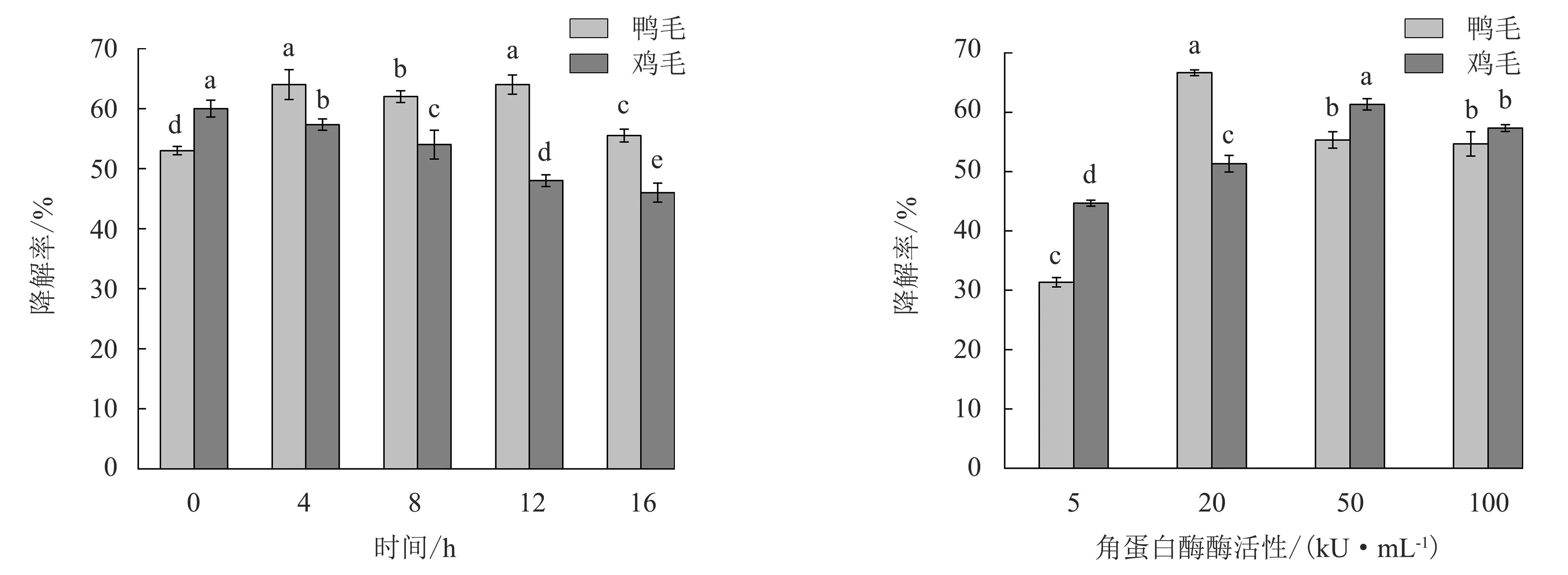
柱上不同字母表示不同添加时间之间有显著差异(P<0.05).图4 角蛋白酶添加时间对降解率的影响Fig.4 Effect of keratinase adding time on degradation rate
2.2.5 联合水解正交试验结果 根据表2中K值大小,鸭毛降解条件的最佳组合为A2B4C4D4E4,即温度40 ℃、pH 10、角蛋白酶活性50 kU·mL-1、B.licheniformisBBE11-1接种量10%、水解时间36 h.该条件下的鸭毛降解率达74.0%±1.2%,较KerZ1和B.licheniformisBBE11-1单独水解分别提高了18.0%和15.0%.鸡毛降解条件的最佳组合为A2B4C2D3E3,即温度40 ℃、pH 10、角蛋白酶活性30 kU·mL-1、B.licheniformisBBE11-1接种量8%、水解时间32 h.该条件下的鸡毛降解率为64.0%±0.7%,比KerZ1和B.licheniformisBBE11-1单独水解提高了29.0%和28.5%.
2.3 羽毛水解液中的氨基酸含量
由表3可知,水解液中检测到常见氨基酸15种.鸭毛水解液中氨基酸总量达7 472.33 mg·L-1,其中,丝氨酸(Ser)、甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)含量较高;鸡毛水解液中氨基酸总量为5 589.67 mg·L-1,其中,缬氨酸、亮氨酸、酪氨酸(Tyr)、苯丙氨酸、赖氨酸(Lys)含量较高.可见,羽毛水解产物中氨基酸种类丰富且含量较高.
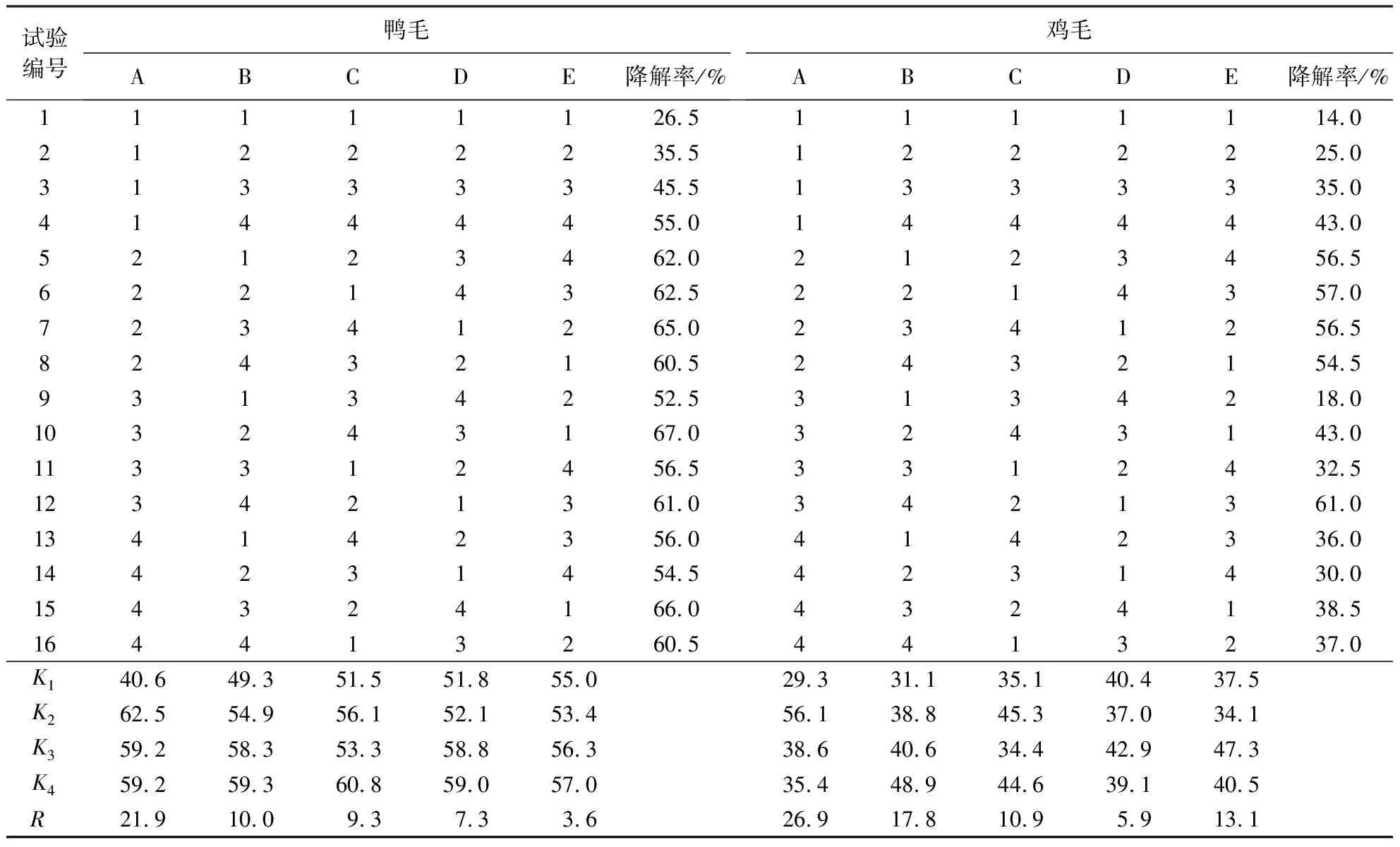
表2 正交试验设计及结果Table 2 Design and results of orthogonal test
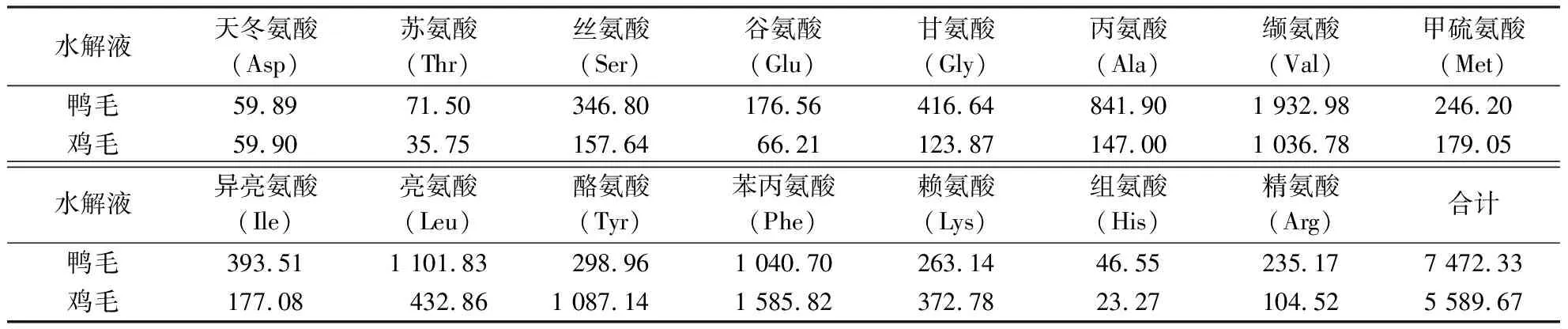
表3 羽毛水解液中各氨基酸含量Table 3 Contents of amino acids in feather hydrolysate mg·L-1
2.4 羽毛水解液对WB600-pP43NMK-ker菌株生长及其角蛋白酶活性的影响
由图6可知,羽毛水解液能促进WB600-pP43NMK-ker菌株生长和提高其角蛋白酶活性,这与曹亮亮等[18]的研究结果类似.在LB培养基中添加10%羽毛水解液后,WB600-pP43NMK-ker菌体密度和角蛋白酶活性均显著提高;用10%羽毛水解液代替LB培养基中的碳、氮源后,WB600-pP43NMK-ker菌体密度和角蛋白酶活性与对照无显著差异.羽毛水解液中丰富的氨基酸可为菌株的生长和代谢提供营养物质,因此,羽毛水解液可作为培养基添加成分,甚至可以替代蛋白胨、酵母粉等昂贵成分,大幅降低菌株培养成本.此外,羽毛降解产物富含氨基酸,还可以作为生物肥料[19]、饲料添加成分[20]等,具广阔应用前景.
3 讨论
微生物降解羽毛角蛋白一般包括3个步骤:变性、分解和转氨基作用[21],分别起到破坏二硫键、水解角蛋白酶、转化小分子多肽和氨基酸的作用,且转氨基作用与蛋白水解程度相关.降解过程一般发生在营养胁迫条件下[22],并且在该条件下产胞外蛋白酶能力显著提高.杜永凯[23]指出,具角蛋白降解能力的菌株B.amyloliquefaciensACCC 19735胞外蛋白中除含角蛋白酶外,还含有肽酶、二硫键还原酶、氧化还原酶、氨基酸代谢相关酶等.Liang et al[24]利用基因组和转录组对羽毛培养基和非羽毛培养基的样本进行测序分析,发现两种条件下差异表达上调的基因主要为胞外蛋白酶、代谢相关基因、跨膜转运相关基因、膜蛋白等.可见,微生物降解羽毛是一个以角蛋白酶降解为主的多酶复合降解体系,微生物在产生大量蛋白酶降解羽毛的同时将其转化为自身生长所需的营养物质.B.licheniformisBBE11-1已被证实在以羽毛为碳、氮源的培养基中可以将半胱氨酸转化成亚硫酸盐并转运至细胞外,起到破坏二硫键的作用,进而与自身分泌的角蛋白酶协同作用降解羽毛[14].但是,其分泌的角蛋白酶活性不高,导致降解羽毛的能力不强.角蛋白酶由于缺乏还原力无法高效降解羽毛,即使是高酶活的重组菌效果也不尽如人意[11].本实验室前期研究表明,角蛋白酶KerZ1与亚硫酸钠协同作用能实现对羽毛的高效降解[12].
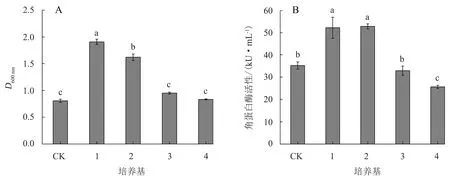
1.LB培养基中添加10%(体积分数)鸭毛水解液;2.LB培养基中添加10%(体积分数)鸡毛水解液;3.10%(体积分数)鸭毛水解液替代LB培养基中的碳、氮源;4.10%(体积分数)鸡毛水解液替代LB培养基中的碳、氮源;CK. LB培养基中添加10%(体积分数)无菌水.图6 水解液对WB600-pP43NMK-ker菌株生长(A)及其角蛋白酶活性(B)的影响Fig.6 Effect of hydrolysate on WB600-pP43NMK-ker growth (A) and keratinase activity (B)
微生物和角蛋白酶联合降解羽毛是一种可行的方法.Mazu Sabirath Shanti et al[17]研究表明,蜡样芽孢杆菌(B.cereus)和角蛋白酶联合作用5 d可降解25 g·L-1的鸡羽毛,且水解产物可用于水产养殖.本研究中,B.licheniformisBBE11-1与角蛋白酶KerZ1联合作用32~36 h可实现对100 g·L-1羽毛64.0%~74.0%的降解率,降解效率高,且操作过程简单、所需能耗低.另外,羽毛水解产物可以促进菌株WB600-pP43NMK-ker的生长和产酶能力.然而,B.licheniformisBBE11-1在整个降解过程中除了将亚硫酸盐转运至细胞外,是否还提供了其他还原力,如二硫键还原酶等,目前还不明确.因此,今后除继续优化角蛋白酶的性能外,如酶活水平、热稳定性等,深入解析微生物对羽毛的降解机制,挖掘关键基因、酶等,也是提高羽毛降解率的重要研究方向.

