福州地区宠物犬源大肠杆菌耐药性及耐药基因调查
邓翔文, 郑婷婷, 陈 璐, 王梦竹, 赵梦诗, 黄小红,, 邓 辉,
[1.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002;2.福建省兽医中药与动物保健重点实验室(福建农林大学), 福建 福州 350002]
自20世纪40年代青霉素被运用于临床治疗以来,抗生素的使用历史已有80余年.然而,抗生素的长时间及广泛应用使得细菌耐药性成为当今人类社会面临的主要健康问题之一,并且临床对抗生素的不合理使用加速了细菌耐药性的出现和传播[1].大肠杆菌(Escherichiacoli)又称大肠埃希菌,为革兰氏阴性菌,定殖于人类和动物肠道内,在一定条件下可以引起人类和动物胃肠道、尿道等多种局部组织器官感染[2].近年来研究表明,大肠杆菌对抗生素类药物极易产生耐药性,大肠杆菌耐药性的出现增加了临床治疗的难度及对人类健康的危害[3].随着宠物数量的日渐增多,宠物与人类之间的频繁或亲密接触增加了将耐药细菌及耐药基因传播给人类的风险,因此,宠物源细菌耐药性调查对加强宠物用药管理并保证人类健康具有重要意义.不仅国外重视研究宠物源大肠杆菌的耐药问题,在我国也有多个地区开展了针对宠物源大肠杆菌的耐药性研究,吉林、成都、广州、石河子等地[4-6]发现宠物携带有大量的耐药菌,但福州地区关于此类相关研究报道相对较少.本研究以福州地区分离的宠物犬源大肠杆菌为研究对象,调查宠物源大肠杆菌对临床上常见抗菌药物的耐药情况及其相关耐药基因的流行情况,旨在为避免耐药性传播,并制定临床合理用药方案及相关政策提供参考.
1 材料与方法
1.1 材料
1.1.1 样品和菌株 2019年10月从福建农林大学校宠物医院采集宠物犬肛拭子样品50份(健康犬23份、患病犬27份).质控菌大肠杆菌ATCC 25922由本实验室保存.
1.1.2 药物 头孢噻呋、头孢他啶、美罗培南、庆大霉素、阿米卡星、卡那霉素、四环素、氟苯尼考、阿奇霉素、多黏菌素E、环丙沙星、甲氧苄啶/磺胺甲噁唑均购自北京索莱宝科技有限公司.
1.1.3 培养基 麦康凯琼脂培养基、水解酪蛋白(MH)肉汤培养基、MH琼脂培养基购自广州环凯微生物科技有限公司.
1.1.4 细菌生化鉴定管 肠杆菌科细菌生化编码微量鉴定管(11种×15支)购自杭州天河微生物试剂有限公司.
1.1.5 主要试剂与耗材 琼脂糖购自生工生物工程(上海)股份有限公司;核酸染料(EB)购自北京索莱宝科技有限公司;10×rTaqBuffer、dNTP Mixture、rTaq、DL2000 DNA Marker(50 ng·μL-1)、6×Loading Buffer购自宝日医生物技术(北京)有限公司;细菌培养皿(90 mm)购自赛默飞世尔科技(中国)有限公司.
1.1.6 主要仪器设备 超净工作台购自苏州净化设备有限公司;PCR仪、电泳凝胶成像系统购自伯乐生命医学产品(上海)有限公司;电泳仪购自北京六一仪器厂.
1.2 方法
1.2.1 细菌的分离鉴定 将采集的肛拭子样品置3~5 mL LB肉汤培养基中,于 37 ℃、200 r·min-1摇床培养16~18 h,用接种环蘸取增菌液在麦康凯琼脂培养基上划线,于37 ℃恒温培养24 h后,挑取红色不透明的单菌落再次划线培养,挑取单菌落进行纯化.将纯化后的待检菌株接种于伊红美兰和麦康凯琼脂培养基中,观察菌落形态和培养基颜色的变化,并采用肠杆菌科细菌生化编码微量鉴定管进行细菌鉴定.经鉴定的大肠杆菌菌株置30%甘油肉汤培养基(-80 ℃)中保存待用.
1.2.2 最小抑菌浓度的测定 根据临床实验室标准化委员会(Clinical and Laboratory Standards Institute, CLSI)标准采用琼脂二倍稀释法测定12种抗菌药物对待检菌株的最小抑菌浓度.挑取纯化后的单菌落于2 mL新鲜的MH肉汤培养基中,于37 ℃、200 r·min-1摇床培养4~6 h至对数生长期.用灭菌的MH肉汤培养基将菌液稀释至1×108CFU·mL-1.
采用二倍稀释法将各抗菌药物在空白平皿上稀释至所需要的各个浓度梯度.将9倍于药液量的高压灭菌MH琼脂加入到各平皿中,混匀.用多点接种仪将稀释好的菌液接种到MH琼脂平板上,待菌液晾干,于37 ℃倒置培养16~18 h后观察结果.按照CLSI[7]规定的敏感(susceptible, S)、中介(intermediate, I)、 耐药(resistance, R)折点值范围判断结果(表1).
1.2.3 DNA模板的提取 采用水煮法制备细菌基因组模板.取单菌落于3 mL灭菌的LB肉汤培养基中过夜培养,于12 000 r·min-1离心3 min,吸弃上清,收集菌体沉淀.在收集的菌体沉淀中加入100 μL灭菌双蒸水重悬菌体,于100 ℃水浴10 min,冰浴5 min,于12 000 r·min-1离心10 min,取上清转移至1.5 mL无菌离心管中,置-20 ℃存放.
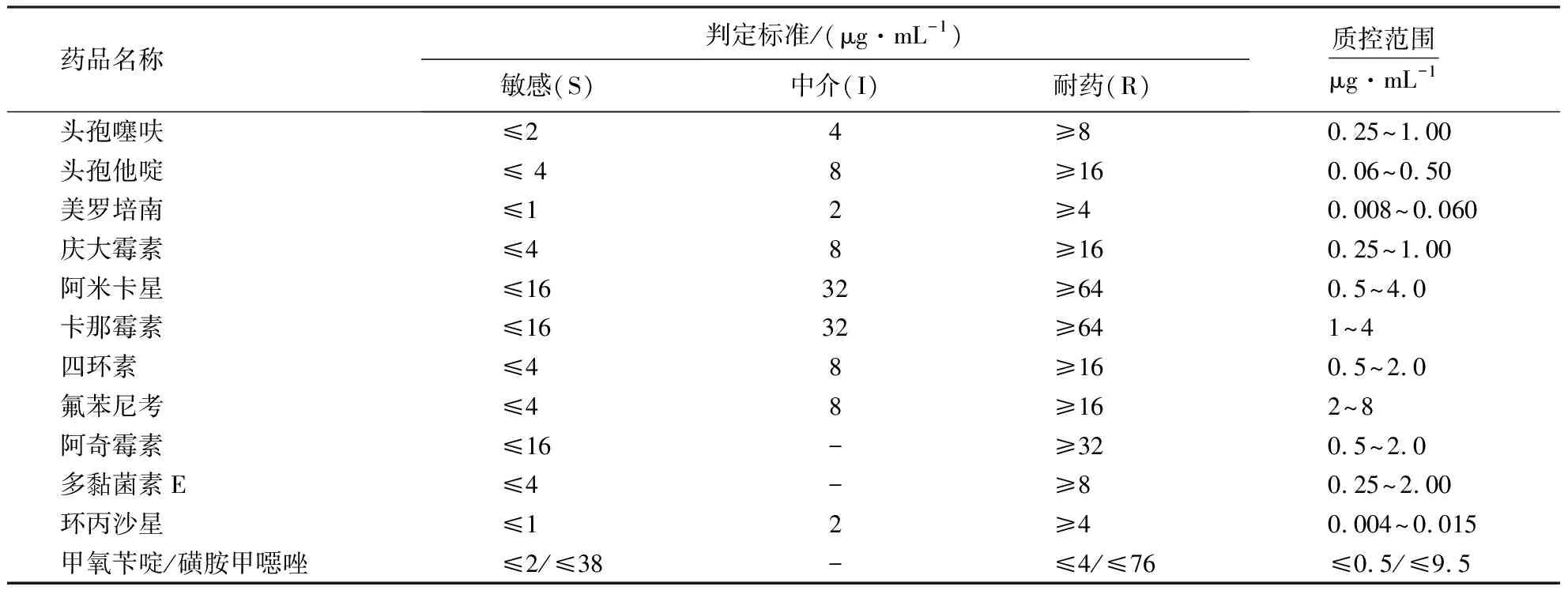
表1 药敏试验结果判断标准1)Table 1 Breakpoints for antimicrobial susceptibility test
1.2.4 耐药基因的检测 针对福建农林大学校宠物医院宠物犬常用的四环素类、氟喹诺酮类、β-内酰胺类3类抗菌药物的临床用药情况,采用PCR检测此3类共24种耐药基因的流行情况.耐药基因特异性引物序列和扩增片段长度如表2所示.设置25 μL的反应体系,包括2 μL模板DNA、上下游引物各0.5 μL、2.5 μL 10×rTaqBuffer、2 μL dNTP Mixture、0.5 μL rTaq,用灭菌 ddH2O加至25 μL.PCR反应程序为:95 ℃预变性3 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃延伸5 min;4 ℃保存.供试引物均由生工生物工程(上海)股份有限公司合成.

表2 耐药基因PCR检测的引物序列 Table 2 Sequences of primers used to screen resistance genes
2 结果与分析
2.1 菌株的分离鉴定
从福建农林大学校宠物医院50份宠物犬肛拭子样品中分离得到大肠杆菌50株,分离率达100%.其中,健康犬23株,患病犬27株.
2.2 药物敏感性
大肠杆菌对各类抗菌药物的耐药率(表3)显示,除对美罗培南和甲氧苄啶/磺胺甲噁唑敏感外,所有菌株均对其余抗菌药物呈现不同程度的耐药.其中,对氟苯尼考和四环素的耐药率较高,分别达86%、50%;对庆大霉素、环丙沙星、卡那霉素、头孢噻呋、阿奇霉素、头孢他啶的耐药率为10%~30%,对阿米卡星和多黏菌素E的耐药率均为4%.除美罗培南、甲氧苄啶/磺胺甲噁唑、多黏菌素E外,患病犬源大肠杆菌对其余抗菌药物的耐药率均高于健康犬.

表3 50株大肠杆菌的耐药性Table 3 Antimicrobial resistance rates of 50 E.coli isolates
多重耐药性是指微生物对3类或3类以上抗生素具有耐药性的现象.大肠杆菌多重耐药性分析结果(表4)显示,在50株分离菌中,多重耐药菌数为20株,耐药率为40%,其中,14株为患病犬源菌,6株为健康犬源菌.患病犬源菌多重耐药率(14/27,51.9%)显著高于健康犬源菌(6/23,26.1%),其中,5株6重耐药菌均来源于患病犬.

表4 50株大肠杆菌的多重耐药性Table 4 Multi-drug resistance of 50 E.coli isolates
耐药基因检测结果(表5)显示:tet(A)的检出率最高,达28%;其次是blaTEM(24%)、qnrS(18%)、qnrB(14%)、oqxA(14%);tet(M)、tet(G)、aac(6′)-Ib-cr、blaSHV、blaCMY的检出率均低于10%.blaCTX-M、tet(B)、tet(C)、tet(O)、tet(Q)、tet(W)、qnrA、qnrC、qnrD、qepA、oqxB均未检出.患病犬源大肠杆菌β-内酰胺类和四环素类耐药基因的检出率均高于健康犬源菌;而氟喹诺酮类耐药基因除oqxA外,健康犬源菌的检出率均比患病犬源菌高.
3 讨论
本研究在2019年从福建农林大学校宠物医院的宠物犬源肛拭子样品中分离到50株大肠杆菌.药物敏感性检测结果显示,50株大肠杆菌中有47株(耐药率94%)对12种抗菌药物有不同程度的耐药性,与国内其他地区相比,对四环素、庆大霉素、阿米卡星、美罗培南的耐药率与乌鲁木齐和扬州地区所报道的宠物源大肠杆菌相似[17-18];对头孢噻呋、阿米卡星、卡那霉素的耐药率低于郑州和广州地区[19-20].本研究中,宠物源大肠杆菌分离株对氟苯尼考的耐药率高达86%,均高于国内其他地区[1,19-20],原因可能是近几年氟苯尼考作为抗菌药物在宠物犬临床上的广泛使用.目前国外也有对宠物源大肠杆菌耐药性的研究,如:丹麦犬源大肠杆菌全部对环丙沙星、头孢噻呋、庆大霉素、氟苯尼考敏感[21];2017年,澳大利亚犬源大肠杆菌对四环素的耐药率不足15%,对环丙沙星和庆大霉素的耐药率不足10%,对阿米卡星的耐药率为1.6%[22],远低于国内宠物源大肠杆菌的耐药率,表明国内宠物临床用药需进一步规范.本研究分离的50株宠物犬源大肠杆菌有20株(耐药率40%)存在多重耐药的现象,健康犬和患病犬的多重耐药率分别为26.1%、51.9%,低于国内其他地区,但比国外宠物源大肠杆菌多重耐药情况严重[23-25].此外,9种抗菌药物敏感检测结果显示,患病犬源大肠杆菌的耐药率均高于健康犬源菌,表明宠物在患病后使用抗生素会增强细菌对抗生素的耐药性.
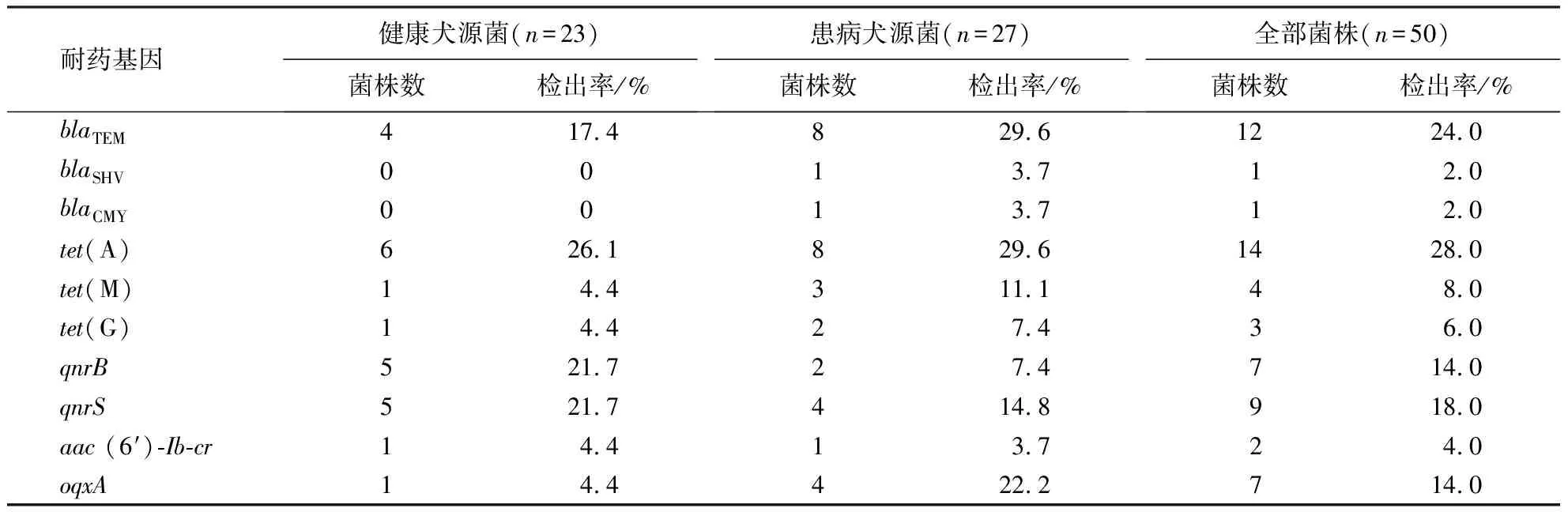
表5 50株大肠杆菌耐药基因的检出率Table 5 Detection rates of resistance genes in 50 E.coli isolates
根据福建农林大学校宠物医院临床用药情况,本研究对β-内酰胺类、四环素类、氟喹诺酮类3类抗菌药物共24种耐药基因进行了检测,共检出10种耐药基因.其中,β-内酰胺类的耐药基因以blaTEM为主(检出率24%),四环素类以tet(A)为主(检出率28%),氟喹诺酮类则以qnrS(检出率18%)、qnrB(检出率14%)、oqxA(检出率14%)较为流行.第3代头孢菌素被认为是最重要的抗菌药物之一,并广泛用于人类和动物[26].β-内酰胺水解酶(extended spectrum beta lactamases, ESBLs)是大肠杆菌对β-内酰胺类抗菌药物耐药的重要原因,目前宠物已被公认为全球ESBLs的重要来源之一[27].ESBLs几乎可以水解所有青霉素类和头孢菌素类抗生素,由基因同源性差异分为5类:CTX-M型、TEM型、SHV型、OXA型、其他型[28].blaTEM基因于1963年首次在希腊一名病人血液分离的大肠杆菌中发现,是由质粒介导的主要β-内酰胺类药物基因,blaTEM基因编码的β-内酰胺酶可以降解包括头孢曲松在内的所有头孢菌素[29].本研究中blaTEM基因的检出率与印度宠物犬中流行情况相似[30].在中国部分地区也有关于blaTEM耐药基因检出的相关报道.如河南和新疆地区blaTEM基因的检出率分别为45%[17]、100%[31],表明blaTEM基因呈现流行趋势.四环素类抗菌药物是20世纪40年代发现的一类抗生素,长期广泛用于治疗人类和动物的细菌感染,导致近年来不断出现耐药菌株.细菌对四环素类抗菌药物的耐药机制主要有外排泵机制[tet(A~G)]、核糖体保护机制[tet(M)、tet(O)]、钝化酶机制[tet(X)]3种[32],tet(A)通过编码主动外排泵介导对四环素耐药[33].Costa et al[34]在犬的四环素耐药大肠杆菌分离株中观察到tet(A)基因占优势;崔耀明等[35]对河南地区犬源大肠杆菌中tet(A)的检出率高达62%,表明tet(A)在介导宠物犬源大肠杆菌对四环素耐药中的重要作用.氟喹诺酮类药物是治疗人类和动物感染的重要抗生素,对氟喹诺酮类药物的耐药性可导致治疗失败,因此被认为是一种公共卫生风险[36].在过去30年间,人类和兽医临床分离株中的肠杆菌科对氟喹诺酮类药物的耐药性有所增大[37].细菌对氟喹诺酮类药物的耐药机制包括拓扑异构酶突变(gyrA、gyrB)、靶标保护(qnr)、外排泵(acrA、acrB、oqxA等)以及膜通透性的改变(ompF)[38].qnrS和qnrB是质粒介导的氟喹诺酮类耐药基因,其编码的拓扑异构酶结合蛋白对氟喹诺酮类药物作用靶位具有保护作用[39].OqxA多药外排泵负责降低对氟喹诺酮类药物的敏感性[40].由此可见,本研究中宠物犬大肠杆菌主要通过靶标保护和主动外排系统介导对氟喹诺酮类耐药.本研究中宠物犬源大肠杆菌β-内酰胺类和氟喹诺酮类耐药率与耐药基因检出率基本保持一致,表明上述耐药基因在介导β-内酰胺类和氟喹诺酮类中的重要作用.而四环素类耐药基因的检出率则显著低于四环素耐药率,表明除上述耐药基因外染色体突变、外膜孔蛋白改变等其他相关耐药机制共同介导了宠物犬源大肠杆菌的四环素耐药.
本研究除了为宠物临床治疗提供数据支持外,还发现福州地区宠物犬源大肠杆菌耐药状况严峻,且携带多种重要耐药基因.因此迫切需要加强对宠物临床用药的管理以及宠物源细菌耐药性的监测以防止抗菌药物过度使用,减少细菌耐药性的产生.

