氧化锌和纳米氧化锌对小鼠肠道肠球菌耐药性的影响
徐传芳, 宋辉辉, 林永豪, 苏 悦, 任子宁, 孙成龙, 徐 睿, 俞道进
[福建农林大学动物科学学院(蜂学学院)/中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002]
细菌耐药性一直是困扰人们的全球公共卫生难题,临床中抗生素药物的使用介导了细菌耐药性的产生.研究表明,细菌可通过基因突变、基因水平或垂直转移获得外源性耐药基因,从而产生耐药性[1].自2006年以来,欧盟已禁止在畜牧业中使用抗菌促生长剂,而重金属离子(如Zn2+、Cu2+)、益生元或益生菌一直作为抗菌剂的替代品用于改善动物体质和促进生长[2].
亚抑制浓度重金属(如Zn、Cu、Ag、Cr)刺激可促进细菌中抗生素耐药基因的接合转移,提高细菌基因突变和重组频率[3].自然环境中的金属在细菌耐药性的维持和增强中起重要作用[4],如污水中的Zn水平与红霉素耐药基因[ere(B)、mef(A)/mef(E)、erm(B)]的表达水平呈显著正相关(P<0.05)[5].此外,细菌的重金属抗性与抗生素耐药性之间存在共选择机制,主要作用机制包括协同抗性机制、交叉抗性机制和协同调控机制[6].
氧化锌(ZnO)是养猪业广泛使用的化合物,用于预防仔猪断奶期间由致病性大肠杆菌感染而导致的一系列疾病.纳米氧化锌(ZnO NPs)具有独特的物理化学特性,可通过金属离子释放、颗粒吸附和活性氧生成来影响微生物的生物学和毒理学反应[7],最终起到抗菌作用[8].养殖业中,低剂量ZnO NPs的使用对提高仔猪生长性能和改善肠道形态具有相似甚至更好的影响[9].
鉴于锌抗性与抗生素耐药性的共选择机制,使用高锌饲料添加剂的利弊一直是人们讨论的话题.目前国内养殖业仍添加高剂量ZnO用于改善动物体质和促进生长,而针对ZnO NPs的研究多倾向于抗菌性能方面,因此有必要探究二者对细菌耐药性的影响,为养殖业合理使用ZnO和ZnO NPs提供依据.
肠球菌为革兰氏阳性球菌,普遍存在于人类和动物的胃肠道,与人类和动物疾病有着长期密切的联系引起严重的公共卫生问题[10-11].除具有产生多重耐药的能力外,肠球菌在不同环境中的持久性和代谢灵活性也使其获得在极端环境下的生存能力,因此可成为研究共生与病原菌应激耐受性的模式属[11].
1 材料与方法
1.1 材料
30只15~20 g清洁级ICR小鼠购自吴氏实验动物(http://www.wssydw.com/m/index.asp);ZnO和ZnO NPs(50 nm)购自上海麦克林生化科技有限公司.
1.2 试验设计
将30只供试小鼠分为A、B、C组,每组各10只,每笼放置一只小鼠.设A组为对照组,饲料不做处理;B组饲料添加500 mg·kg-1ZnO NPs;C组饲料添加1 600 mg·kg-1ZnO.所有组别的小鼠置于相同环境中饲养,饲料和饮用水均经高压灭菌处理.
1.3 样品处理及肠球菌的分离鉴定
采集各组小鼠粪便并置于无菌的0.01 mol·L-1PBS缓冲液中,振荡,吸取悬浊液并用PBS缓冲液倍比稀释.取稀释后的悬浊液滴加至添加不同浓度ZnO NPs(0、125、250、500、1 000 μg·mL-1)的肠球菌选择性培养基中,于37 ℃恒温培养18~24 h.尽量挑取高浓度ZnO NPs平板上的单菌落并置于BHI肉汤培养基中增菌培养.采用水煮法提取分离菌株基因组DNA,用PCR检测肠球菌,阳性对照为粪肠球菌ATCC29212,阴性对照为无菌双蒸水.肠球菌16S rRNA上游引物(序列:GTGTCGCTGATGGATGG)和下游引物(序列:GCAAGCCGAACTGAGAGA)由福州白鲸生物技术有限公司合成,熔点54 ℃,产物长1 096 bp.
1.4 药敏试验
按照美国临床实验室标准化协会(CLSI)的微量肉汤稀释法测定氨苄西林、头孢唑林、环丙沙星、红霉素、四环素、亚胺培南、利福平、氯霉素和呋喃妥因对肠球菌的最低抑菌浓度(the minimum inhibitory concentration, MIC).
1.5 肠球菌耐药基因的检测
采用PCR检测肠球菌erm(A)、erm(B)、lsa、tet(L)、tet(M)、fexA、cfr等耐药基因以及gyrA、parC、rpoB等基因的耐药决定域.所有基因序列均在NCBI基因数据库查找下载,利用Primer 5软件设计引物,引物信息如表1所示.引物由福州白鲸生物技术有限公司合成.以各组肠球菌DNA为模板进行PCR扩增,根据Premix Taq说明书配制反应体系.PCR反应程序为:98 ℃预变性3 min;98 ℃变性10 s,熔点+5 ℃退火20 s,72 ℃延伸20 s,共35个循环;72 ℃终延伸2 min.PCR产物用1%琼脂糖凝胶电泳检测.阴性对照为灭菌双蒸水.
1.6 PCR产物测序
将gyrA、parC、rpoB基因和耐药基因阳性PCR产物送至福州白鲸生物技术有限公司测序,测序结果在NCBI基因数据库进行BLAST比对,确定耐药基因序列及突变位点并作统计处理.

表1 肠球菌耐药基因PCR检测的引物信息Table 1 The primer information for identification of Enterococcus and detection of antibiotic resistance genes
2 结果与分析
2.1 肠球菌的分离鉴定
随着饲喂时间的延长,A组小鼠粪便悬浊液样品只可在含低浓度(0、125 μg·mL-1)ZnO NPs的平板上长出单菌落;B、C组样品可逐步在含高浓度ZnO NPs的平板上长出单菌落,高浓度ZnO NPs平板上的单菌落数量与饲喂时间呈正比.
PCR鉴定结果(图1)显示,受试菌株条带与阳性对照一致,确定平板上的菌落为肠球菌,可进行下一步试验.
P:阳性对照;N:阴性对照;M:DL2000 Marker;1~10:样品.图1 肠球菌PCR检测电泳图谱Fig.1 Electrophoretogram of PCR product for Enterococcus identification
2.2 药敏试验结果
图2显示,在饲料中添加ZnO NPs和ZnO后,小鼠肠道肠球菌对抗生素药物的敏感性发生了变化.
图2a显示,饲喂25 d,与A组相比,红霉素和利福平对C组大部分肠球菌的MIC明显升高,分别达到8和64 μg·mL-1;红霉素对B组部分肠球菌的MIC升高;与C组不同的是,四环素对B组部分肠球菌的MIC明显升高;B、C组部分肠球菌对其他抗生素药物,如环丙沙星、氨苄西林和氯霉素的敏感性降低.
图2b显示,饲喂30 d,与A组相比,B、C组抗生素药物MIC的变化与饲喂25 d的相差不大,总体呈上升趋势,值得注意的是,B组出现四环素MIC升高的菌株数量增多了.
图2c显示,饲喂50 d,与A组相比,C组肠球菌对抗生素药物的敏感性大大降低,红霉素、四环素的MIC最高,达256 μg·mL-1以上.其中,环丙沙星对两株肠球菌的MIC可达64 μg·mL-1,亚胺培南的MIC最高达到16 μg·mL-1,其他抗生素药物的MIC均值高于A组.
将饲喂25、30和50 d各组的耐药菌株进行统计,计算耐药菌株的分离率.结果(图2d)显示:与A组相比,在饲料中添加ZnO和ZnO NPs可明显提高抗生素耐药菌株的分离率, C组耐药菌株的分离率总体高于B组;A组利福平耐药菌株的分离率虽高于B、C组,但A组耐药表型均为低水平耐药(8 μg·mL-1);B、C组大部分肠球菌呈中高水平耐药,其抗生素药物的MIC均值大于A组.

a:饲喂25 d;b:饲喂30 d;c:饲喂50 d;d:耐药菌株分离率.图2 肠球菌对抗生素的敏感性Fig.2 Susceptibility of Enterococcus to antibiotics
2.3 肠球菌抗生素耐药基因的检测率及测序结果
表2显示,抗生素耐药基因只在B、C组肠球菌样品中检出,且大部分抗生素耐药基因的检出率与饲喂时间呈正比.饲喂25~30 d,B、C组耐药基因erm(A)、lsa和fexA的检出率均由25%上升至100%;饲喂50 d,C组红霉素耐药基因erm(B)、四环素耐药基因tet(L)和氯霉素耐药基因cfr的检出率明显上升,由0分别上升至91.7%、66.7%和58.3%.
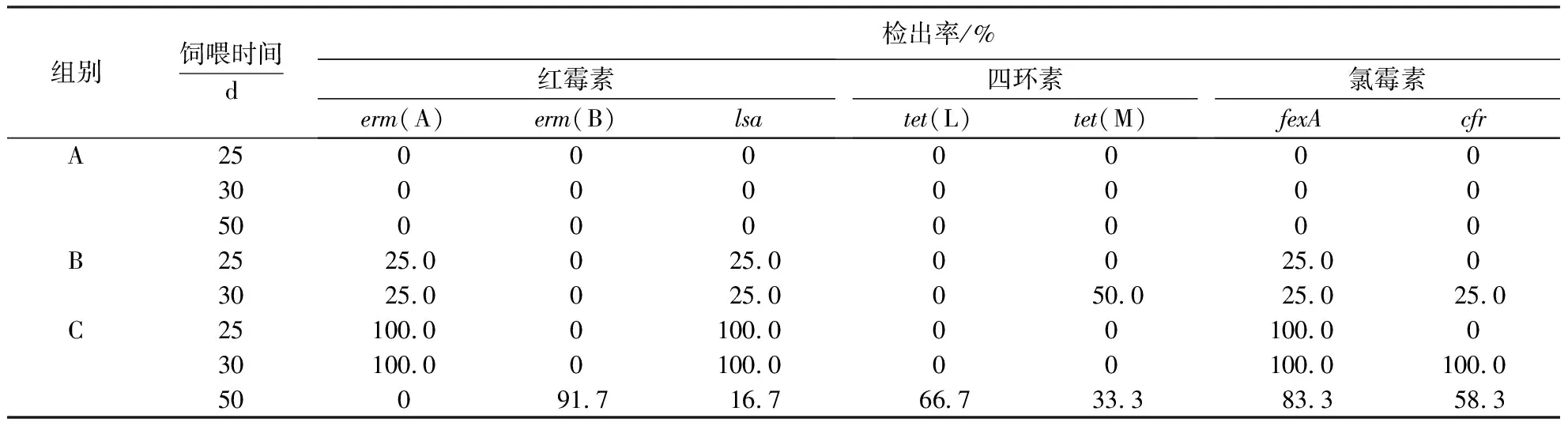
表2 肠球菌耐药基因的检出率Table 2 Detection rate of antibiotic resistance genes in Enterococcus
测序结果显示,饲喂50 d,C组两株环丙沙星耐药肠球菌的gyrA和parC基因发生单点突变,导致第84、82位丝氨酸转变为异亮氨酸,利福平耐药肠球菌未发现rpoB基因突变.此外,肠球菌的耐药表型与基因型高度相关.
3 讨论
本研究采用不增菌的样品处理方法,保留了粪便原始的微生物群落结构,鉴于细菌的重金属抗性与抗生素耐药性之间的共选择机制[12],将粪便悬浊液用可解离出Zn2+的ZnO NPs进行肠球菌筛选.结果显示,随着饲喂时间的延长,小鼠肠道肠球菌对ZnO NPs的耐受性日益增强,抗锌菌落数增多,说明重金属Zn或可成为直接选择压力,使抗锌细菌成为优势菌群,B、C组抗锌肠球菌的分离数量和分离率明显高于对照组,该结果与史亚楠[13]的研究结果相似.另有研究表明,用高浓度Zn长时间处理土壤后可促进抗性优势菌群的生长[14].根据本研究和前人[13-14]的研究结果,推测高锌饲喂可导致动物肠道菌群结构发生改变.
重金属抗性细菌一般通过生物吸附、胞外沉淀、生物转化和外排作用等生理机制解除重金属毒性[15],当然这种解毒机制也伴随细菌耐药性的发生.本研究中,抗生素药物对肠球菌的MIC与平板菌落的生长情况密切相关,耐受高浓度ZnO NPs(≥500 μg·mL-1)的肠球菌对多种抗生素药物表现出高水平耐药,如在饲喂1 600 mg·kg-1ZnO 50 d后,从小鼠粪便中分离的肠球菌对红霉素和四环素的耐药水平上升,MIC可达256 μg·mL-1以上,而对照组的MIC无明显改变,这里可排除环境耐药菌污染的可能.且随着饲喂时间的延长,B、C组耐药肠球菌的比例不断增加,多重耐药肠球菌比例升高,这与前人[16-17]对大肠杆菌耐药性的研究结果一致.
细菌高水平耐药一般与抗生素耐药基因的存在与表达有关,肠球菌对红霉素和四环素的耐药性主要由编码红霉素甲基化酶的erm(B)基因[18]和编码外排泵蛋白的tet(L)基因[18]所介导.本研究中,随着饲喂时间的延长,抗生素耐药基因的检出率呈上升趋势,特别是介导红霉素和四环素耐药基因的检出率较高,这解释了肠球菌对红霉素和四环素耐药水平增强的现象.值得注意的是,含有erm(B)和tet(L)基因的肠球菌均表现出高水平耐药,且多在饲喂后期检出.另外,在饲喂过程中,多种抗生素耐药基因同时存在的概率增大,特别是饲喂50 d时,出现两株同时含erm(B)、lsa、tet(L)、tet(M)和fexA基因的肠球菌,对红霉素、四环素和环丙沙星等抗生素药物均表现出高水平耐药.抗生素耐药基因检出率的增高与肠道环境中的Zn水平密切相关,抗生素耐药基因与重金属的共同选择是使其丰度增加的主要原因[19].大量研究表明,环境中四环素类、红霉素、氯霉素类、磺胺类等抗生素耐药基因的丰度与Zn水平呈显著正相关(P<0.05)[5,20-21].
DNA螺旋酶gyrA基因和拓扑异构酶ⅣparC基因中保守区域的单点突变是氟喹诺酮类药物耐受的主要机制[22].本研究中,两株对环丙沙星高水平耐药的肠球菌出现gyrA和parC基因的单点突变,这种突变可能与Zn水平直接相关.Li et al[23]使用亚抑制浓度Zn对细菌进行连续传代培养,结果出现多种基因(如gyrA、cytR)突变情况,抗性突变体在继代培养5 d后表现出遗传抗性,即出现相应抗生素的耐受.结合本研究结果,推测高锌饲喂可能提高肠道细菌的基因突变率.
一般情况下,革兰氏阳性细菌中的多数四环素耐药基因位于可移动的质粒或转座子上,如tet(L)、erm(A)和erm(B)基因通常位于质粒上,tet(M)基因位于染色体或接合转座子上,肠球菌中的转座子通常同时含有tet(M)和erm(B)基因[18],本研究有4株同时含这两个基因的肠球菌.李庆辉等[24]研究表明,单增李斯特菌耐药基因tet(M)和erm(B)可通过质粒等可移动遗传原件向肠球菌跨种水平传播.Mazhar et al[25]在研究抗生素和金属残留物共存模式下与抗生素耐药基因的联系时发现,细菌群落组成和基因水平转移是形成抗生素耐药基因组成的主要因素,金属对抗生素耐药基因组成的影响大于抗生素,Zn[3]和ZnO NPs[26]更可以促进抗生素耐药基因的水平转移.高浓度的纳米CeO2可通过提高细胞应急反应,增加胞内活性氧积累,提高胞外聚合物含量,进而提高携带抗生素耐药基因质粒的接合转移频率,从而促进抗生素耐药基因在菌群中的传播和扩散[27].另外,抗生素与重金属协同抗性表明,抗生素耐药基因和金属抗性基因可同时位于同一遗传元件上[28],在重金属压力下,二者的共选择机制可使抗生素耐药基因扩散[29].外界环境中,即使是低浓度的单一抗生素或重金属均可让含有多重抗生素抗性质粒的细菌得以选择和富集[30].根据本研究结果推测,在肠道中高浓度Zn的作用下,肠道菌群结构发生改变,一些含锌抗性基因和抗生素耐药基因的菌群成为优势菌,同时提高可移动遗传原件的丰度,锌抗性基因和抗生素耐药基因在细菌间的转移频率也随之提高,这将增强抗生素耐药基因随粪便传播到环境中的风险.
综上,随着饲喂时间的延长,在饲料中添加ZnO和ZnO NPs可逐步提高小鼠肠道中抗锌细菌的丰度、肠球菌对Zn和抗生素药物的耐受性、抗生素耐药基因的检出率,可能提高细菌的基因突变率和抗生素耐药基因水平转移频率.目前,我国养殖业的高锌饲喂仍在继续,本研究可为养殖业合理使用ZnO和ZnO NPs提供科学依据.

