非洲猪瘟病毒减毒活疫苗研究进展
陈 平, 梁昌镛
(扬州大学生物科学与技术学院,江苏 扬州 225100)
非洲猪瘟病毒(African swine fever virus, ASFV)是非洲猪瘟(African swine fever, ASF)的病原,属于非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的唯一成员,是具有囊膜的大型二十面体双链DNA病毒[1].其基因组大小为170~194 kb[2],含有160~175个开放阅读框(open reading frames, ORFs),编码150~200种蛋白质,包括结构蛋白和非结构蛋白,但许多蛋白的功能尚不清楚[1].衣壳组成成分包括主要衣壳蛋白p72和4种次要衣壳蛋白M1249L、p17、p49和H240R[3].依据病毒交叉血凝性将ASFV划分为8个血清群,依据主要衣壳蛋白p72的B646L序列将其划分为24个基因型(Ⅰ~ⅩⅩⅣ)[4].该病毒的宿主是家猪和野猪,主要通过直接和间接接触形成循环传播网络(图1)[5-6].发病猪、隐性感染猪及其排泄物和污染物以及传染媒介蜱虫等均是ASFV的传染源.在非洲,ASFV流行传播方式主要是蜱虫叮咬后形成“野猪—软蜱—野猪”的“森林循环”模式;在非洲之外,传播方式主要是“家猪—家猪”循环和“家猪—软蜱”循环的模式.有的家猪和野猪在感染后隐性带毒[5]或康复后潜伏带毒[7],并向环境中排毒,导致ASFV不断传播[8].ASFV DNA复制发生在宿主单核细胞或巨噬细胞的细胞核周围胞质中,最终ASFV从受感染的细胞中出芽[9].此外,感染ASFV的猪的血液具有高度传染性,是猪接触感染的主要传染源[10].
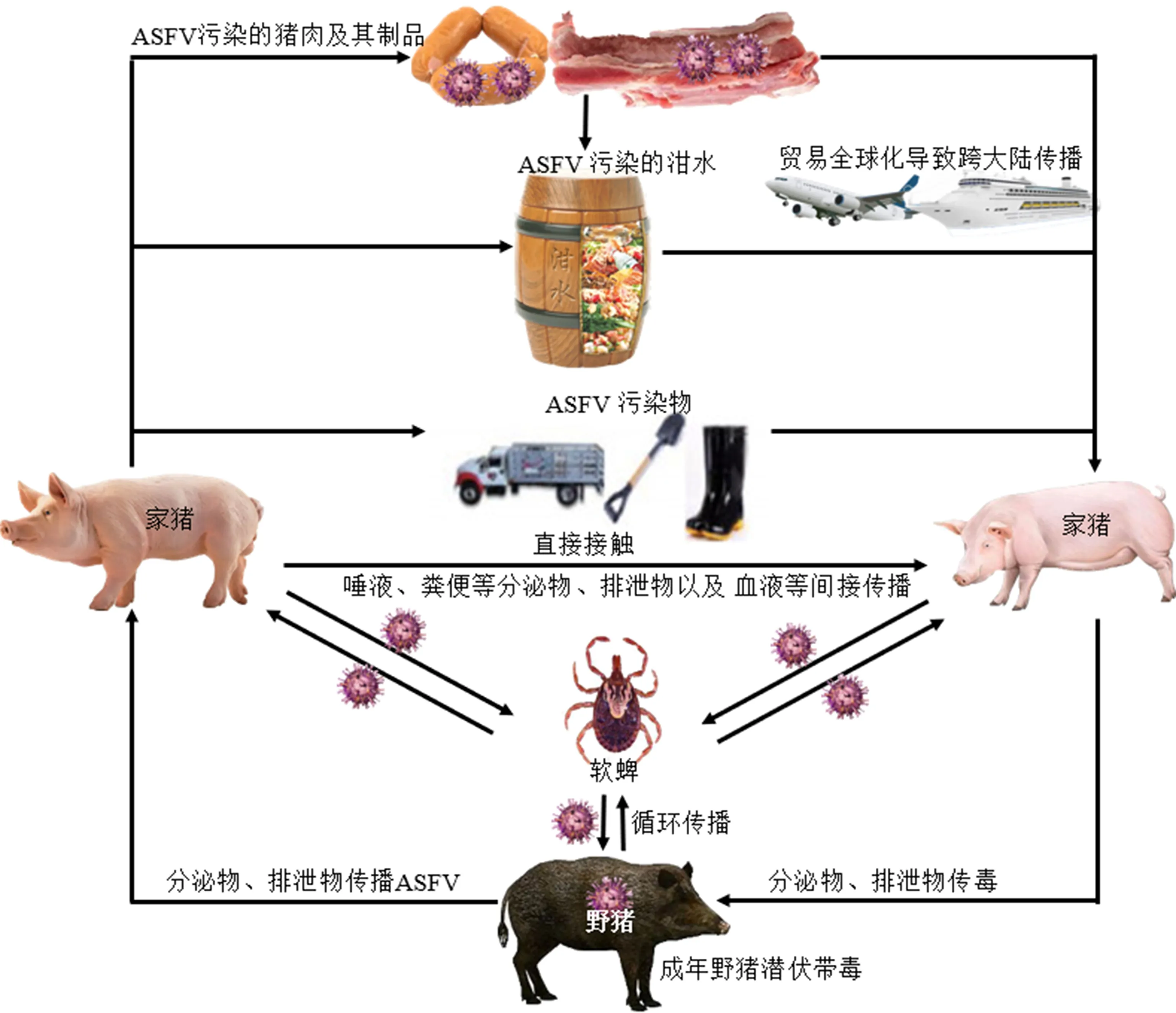
图1 ASFV的主要传播网络Fig.1 Main spreading network of ASFV
1921年,ASF始发于非洲肯尼亚[11].2018年8月,我国报告首例ASF疫情,由于缺乏有效的ASFV疫苗和治疗方法,ASF迅速蔓延至全国32个省(市、自治区).农业农村部[12]公开信息显示,截至2021年7月底全国范围内暴发ASF疫情192起,扑杀生猪100万头以上,这给我国养猪业造成严重损失.世界动物卫生组织将ASF列为法定报告动物疫病,我国将其列为一类动物疫病.本文对NCBI发布的VN/QP-ASFV1(2019)毒株编码蛋白中已知功能的主要蛋白在病毒感染过程中发挥的作用进行总结,并对ASFV减毒活疫苗的研究情况进行综述,以期为ASF的防控与疫苗研发提供参考.
1 ASFV蛋白种类及功能
ASFV与其他核质大DNA病毒具有类似的结构、基因组和复制特性,但ASFV的独特在于病毒颗粒的五层结构和二十面体形态.利用冷冻电镜单颗粒三维重构方法,解析出ASFV全颗粒的三维结构[3],发现细胞外的ASFV颗粒平均直径为260~300 nm,由内向外的五层结构分别为病毒核心(nucleoid)、病毒核壳(core shell)、内囊膜(inner membrane)、病毒衣壳(capsid)、外囊膜(outer membrane).病毒核心包含病毒基因组和核蛋白,它们是早期mRNAs合成所需的元件;病毒核壳由pp220、pp62等多聚蛋白构成;核壳外周附着一层来自内质网的内囊膜,并形成二十面体对称的病毒衣壳,以细胞质膜出芽获得外囊膜.
通过分析NCBI发布的VN/QP-ASFV1(2019)毒株的全基因组信息(表1)发现,ASFV基因组编码蛋白有163种,其中,功能被试验表征的蛋白有67种,一半以上的ASFV ORFs未被确定结构和功能.已确定功能的主要蛋白按其在感染宿主时发挥的作用分为6类:参与病毒形态形成的蛋白(16种);参与病毒入侵的蛋白(8种);病毒进入宿主后,参与病毒复制、mRNA转录的调控蛋白(25种);参与宿主机体免疫调控的蛋白(18种);参与病毒跨膜与传播的蛋白(2种);多基因家族(multigene family, MGF)编码的病毒蛋白(6种).其中,大多数MGF蛋白的功能和种类尚未被确定,预测MGF蛋白的结构和功能具有多样性,但同一MGF的蛋白具有相似的结构、位置和功能.MGF基因在相同基因型ASFV毒株的进化过程中倾向于丢失拷贝数[13].

表1 VN/QP-ASFV1(2019)毒株中主要功能蛋白分类Table 1 Classification of main functional proteins in VN/QP-ASFV1 (2019) strain
2 ASFV减毒活疫苗
ASFV于20世纪20年代初就被发现并报道,但其疫苗研究滞后了近50年,主要原因在于ASFV庞大基因组的多样性及其免疫逃避机制的复杂性.目前,ASFV疫苗主要包括灭活疫苗、重组活载体疫苗、亚单位疫苗、核酸疫苗、减毒活疫苗.在中短期内,ASFV减毒活疫苗是最有希望研究成功的候选疫苗[42-43],也是研究者们的重点研究方向.ASFV减毒活疫苗是将ASFV经过特殊处理后减弱其致病力而保留其免疫原性的一类疫苗,该疫苗用较小剂量就能实现持续性的免疫保护,且其能针对同源亲本病毒的攻击起到完全保护效果[44],但对异源毒株的交叉保护效果欠佳[42].ASFV减毒活疫苗按减毒方式可分为传统减毒活疫苗和重组减毒活疫苗.
2.1 传统减毒活疫苗
传统减毒活疫苗包括自然致弱疫苗和细胞传代致弱疫苗.其中,自然致弱疫苗是通过自然衰减毒力的毒株制备的疫苗.在20世纪60年代初期,葡萄牙和西班牙学者在野外接种自然致弱疫苗,发现其对同源ASFV可产生一定的免疫保护作用,但对异源病毒保护效率低或没有保护作用[44],且该疫苗的使用对动物存在低病毒血症或发热、肺炎、关节肿胀、流产、死亡、慢性感染等诸多不良副作用[45].因此,该类疫苗安全性还需要进一步评估.
自然致弱疫苗的常见毒株有OURT88/3和HN/P86.Oura et al[46]证实,OURT88/3毒株免疫后可以抵抗OUR/T88/3强毒株的攻击,但OUR/T88/3毒株免疫可能使细胞毒性T淋巴细胞耗尽而不能免受OUR/T88/1毒株的攻击,致使感染猪出现病毒血症和发烧症状[47].家猪使用减毒的OURT88/3株,虽然可以诱导产生高滴度抗体发挥保护作用,但并不持久[48-49].HN/P86弱毒株可促进细胞产生毒性T淋巴细胞,并抵抗L60强毒株的攻击,但同时会引起部分猪出现感染加剧现象[50];HN/P86还会引起CD8+T细胞释放细胞因子IFNα、TNFα以及巨噬细胞释放IL12p40,进而诱导细胞抵抗病毒.IL12p40是自然杀伤(natural killer, NK)细胞活化所必需的,而IFNα对IL12p40的表达呈负调控作用,这可能是减毒活疫苗造成部分猪感染加剧的原因[46].这些试验不仅证实了减毒活疫苗在异源保护方面的不足,还指出了CD8+T细胞和NK细胞介导的细胞免疫在抵抗ASFV中发挥的重要作用.
细胞传代致弱疫苗是ASFV对培养细胞系适应后,引起病毒基因组部分片段自发缺失,导致病毒毒力减弱的一类减毒活疫苗.已有研究表明,Georgia强毒株在Vero细胞中的复制能力随着连续传代而增强,而在原代猪巨噬细胞中的复制能力随着连续传代而减弱.这表明适应Vero细胞系的ASFV突变株缺失了在猪巨噬细胞中复制和生长相关的特定功能基因.在Vero细胞中,随着传代次数的增加,Georgia毒株的毒力逐渐减弱,并在第110次传代时完全减毒,但家猪接种完全减毒的病毒并未针对强毒亲本Georgia的攻击起到保护效果[51].这暗示该毒力完全丧失的毒株在猪体内的复制能力可能受限使其丧失免疫原性,造成免疫保护效果不佳.
传统减毒活疫苗已逐渐被淘汰,主要是由于其慢性感染会引起安全问题以及接种后会产生严重的副作用[52].然而,Borca et al[53]研究表明,CRISPR/Cas9基因编辑系统可对基因组中靶序列进行高精度编辑,极大提升了重组ASFV的纯化效率,这为研制ASFV重组减毒活疫苗提供了思路.
2.2 重组减毒活疫苗
重组减毒活疫苗是通过减弱病毒的致病力而保留其免疫原性,并靶向缺失毒力相关病毒基因的ASFV疫苗.常见的缺失基因包括TK、NL、9GL、UK、CD2v、DP148R及MGF360/505基因.
TK基因参与三磷酸脱氧核苷的合成,对细胞培养物中的病毒生长不是必需的,但缺失TK基因的ASFV-Georgia株被完全减毒,且无法在猪巨噬细胞中复制,不能诱导针对强毒亲本攻击的免疫保护机制[54];而Malawi株缺失TK基因却可以诱导对同源病毒攻击的免疫保护机制[55].除了TK基因外,NL(DP71L)基因也与病毒毒力有关,E70分离株缺失该基因可以有效减毒,但在Georgia分离株中NL基因的缺失不会减毒且会引起异质反应,使动物提前发生病毒血症甚至死亡[56].这说明在不同病毒分离株中同一基因的功能可能存在一定的差异.
9GL缺失后,Malawi、Pretoriuskop分离株毒力减弱,且能针对亲本分离株的攻击起到完全保护的效果;而9GL缺失的Georgia分离株仅部分减毒,且针对亲本分离株攻击的保护作用也不完全,高剂量免疫还会诱发ASF病症现象[57].在9GL缺失的基础上进一步缺失了E70分离株的毒力相关基因UK,构建了9GL、UK双基因缺失分离株,不仅避免了高剂量产生的病理作用,还可在接种2周后针对亲代Georgia分离株的攻击起到完全保护的效果[58].这表明多个毒力相关基因的共同缺失可能是实现疫苗安全和提供有效保护的重要途径.
ASFV疫苗开发需要特别注意保护性免疫的血清群特异性,因为血清群内的病毒可以相互交叉保护,这对防止ASFV感染非常重要[59-61].Monteagudo et al[62]研究指出,CD2v基因在减弱病毒毒力和防止宿主感染方面起着关键作用,以CD2v缺失的BA71分离株制成的减毒活疫苗既可以诱导对同源强毒株BA71攻击的完全保护机制,又能产生对异源Georgia毒株和E75毒株攻击的交叉保护作用.而Georgia分离株缺失CD2v对病毒毒力和免疫保护均无作用[63];研究也发现,Congo-a分离株缺失CD2v并不影响病毒的体外复制能力,但不能对强毒株Congo-a的感染起到保护作用[64].这些与Monteagudo et al[62]的研究结果不符,推测可能与ASFV的遗传变异有关.
MGF360/505基因单缺失的Georgia分离株拥有与亲代病毒一样的复制力且毒力完全减弱,能诱导针对同源Georgia强毒株攻击的完全保护机制[41];但MGF360/505和9GL多基因缺失的分离株虽然安全性有所提高,但因在猪巨噬细胞中的复制能力降低而不会诱导针对亲本Georgia强毒株攻击的保护机制[65].研究发现,9GL、CD2v、EP153R多基因共缺失后,Georgia分离株的免疫保护作用不如9GL单基因缺失株[66].还有研究指出,BA71毒株同时缺失CD2v、EP153R或CD2v、UK基因,未实现体内减毒和诱导免疫保护机制[67].这些试验结果表明,在通过基因缺失制备疫苗时,不仅要减弱病毒毒力还要保持病毒的复制能力,才能保证减毒株具备有效的免疫原性,达到有效的免疫保护效果.
2.3 ASFV的免疫抑制因子
国内外研究表明,在感染病毒期间,pA528R通过靶向p65激活和核易位抑制NF-κB信号传导,从而抑制IFN-β的产生,抑制细胞抗病毒活性[68].pA224L和pA179L通过抑制宿主细胞caspase活性和细胞凋亡促进病毒粒子的产生[31-32];EP153R能降低宿主TP53的反式激活活性,从而抑制细胞凋亡[33].此外,感染早期,pL83L通过与宿主IL-1β相互作用并干扰其功能而破坏宿主的先天免疫反应[37].F317L也是对抗宿主先天免疫反应的因子,其通过破坏NF-κB活性抑制NF-κB通路的激活,从而降低各种促炎细胞因子的表达[69].感染后期,CD2v通过抑制淋巴细胞增殖及促进病毒复制和感染而发挥免疫抑制作用[70].pA238L对活性T细胞依赖的免疫反应基因的核因子钙调神经磷酸酶功能和宿主NF-κB转录因子活性有抑制作用[71];I226L、A151R、NP419L、QP383R能抑制先天免疫相关基因和细胞因子的表达[34];I329L是功能性病毒TLR3的同源物,可在TRIF水平上抑制IFN的表达[35];DP96R能抑制cGAS-STING-TBK1信号通路中IFN-α的产生及NF-κB信号传导,这在病毒免疫逃避中起重要作用[38].这些说明ASFV感染会导致严重的免疫抑制.但目前人们对免疫抑制机制仍知之甚少,参与免疫抑制的病毒因子还有哪些,以及删除这些抑制因子是否会影响病毒的复制能力,这些都将是未来ASFV减毒活疫苗研究的重要内容.
3 总结与展望
ASFV感染野猪和家猪,导致死亡率高达100%[72].但由于ASFV的复杂性和基因多样性以及有关其保护性免疫研究的缺乏,目前尚无有效、安全的ASFV疫苗[73].今后不仅要加强对毒力关键基因的研究,包括控制ASFV复制、参与宿主免疫抑制的病毒基因,还要关注关键基因功能与细胞免疫和体液免疫机制的联系,从而既能实现ASFV减毒活疫苗体内减毒,减少副作用,又能诱导有效的免疫保护机制.
细胞免疫在免疫保护中起着至关重要的作用.已有研究指出,大多数因急性感染而死亡的病例都是由炎性细胞因子风暴引起的感染性急性呼吸窘迫综合征和败血症等多种疾病导致的[74-75].研究表明,炎性细胞因子风暴是引起ASFV感染病症的重要原因[76].因此,通过控制ASFV感染后产生的细胞因子抵抗ASFV感染,成为今后研究的重要方向之一.此外,VN/QP-ASFV1(2019)毒株中已确定的参与宿主机体免疫调控的功能蛋白,都是ASFV的重要保护性抗原,但有关其具体免疫机制的研究尚不完善,今后需继续探明更多刺激T细胞免疫的关键抗原,明确其免疫保护机制,为开发新型有效且安全的ASFV减毒活疫苗奠定基础.
野猪相对于家猪更容易在ASFV感染中存活下来,说明野猪体内可能存在着家猪没有或表现较弱的抗ASFV感染的机制,因此,学者们围绕家猪和野猪开展了免疫方面的对比研究,并取得了一些成果.如:家猪在被强毒力Armenia08分离株感染后,淋巴细胞减少,血液和淋巴器官均无CD8+T细胞增殖而迅速死亡,野猪的CD8+T细胞则快速被激活,但依旧表现出严重的急性致死性症状[77],表明野猪中的T细胞对高毒力ASFV感染产生了细胞毒性反应,只是未起到保护作用.中等毒力“Estonia 2014”分离株感染家猪和野猪后,家猪体内产生了保护性T细胞免疫反应,T细胞的活化和持续增殖降低了家猪死亡率,而该毒株对野猪的毒力更高,野猪表现出更严重的临床症状[78];与家猪相比,野猪的γδ T细胞反应更明显,野猪病情加重可能是由于调节性T细胞反应增强,缩短了炎症反应[79].调节性T细胞反应能够特异性地抑制抗病毒反应,提示该调节反应可能是ASFV逃避宿主免疫的方式,且该免疫逃避方式在野猪中比家猪中更为明显.因此,围绕ASFV减毒活疫苗在家猪与野猪中的作用开展对比研究,将有可能探明野猪体内的抗病毒机制.

