供磷水平对杉木根表铁膜含量及幼苗生长的影响
郭昊澜, 赵子豪, 连晓倩, 李娜娜, 曹 越, 吴鹏飞
(1.福建农林大学林学院;2.人工林可持续经营福建省高校工程研究中心,福建 福州 350002)
杉木(Cunninghamialanceolata)是我国南方重要的用材树种之一,具有速生丰产和易繁殖等特点.其广泛分布的林区以酸性红壤为主,这类土壤中的磷素易被铁铝氧化物或氢氧化物吸附固定,形成难溶解和难移动的磷酸铁、铝,难以被植物根系直接吸收利用,使磷素成为该区域限制林木生长的营养元素,严重影响了杉木林的可持续经营[1-2].然而,在长期低磷环境中,有些杉木基因型(地理种源或无性系)可通过启动多种形态生理学机制适应逆境,如改变根系形态、分泌有机酸、皮层组织细胞溶解等来提高自身的磷素吸收与利用能力[3-5].
近年来,国内外学者致力于根表铁膜对植物应对逆境的生物学功能研究[6-7],结果表明植物根系表面附着的这种铁氧化或铁氢氧化物,通过其携带的正负电荷基团吸附和共沉淀等作用对根际环境中的重金属如镉、铅等进行拦截,以减缓其对植物的毒害.根表铁膜也可对磷、锌等营养元素进行吸附,将其固定于根系表面,待植物需要时再通过根系分泌物活化吸收,从而有效增强了植物对养分的吸收利用[8-9].研究[10-11]表明,水生植物如水稻(Oryzasativa)、芦苇(Phragmitesaustralis)、美人蕉(Cannaindica)等,以及木本植物如云杉(Piceaasperata)、多脂松(Pinusresinosa)等均能在根系表面形成铁膜覆盖.根表铁膜的形成主要受到根系生长介质中Fe2+浓度和根际局部氧化条件的影响[12].南方杉木林区多为富含铁铝的酸性红壤,较低的pH值使得红壤中沉积铁的溶解度提高,造成土壤中Fe2+的大量积累[13],这为杉木形成根表铁膜提供了环境条件.此外,研究[6]表明,根表铁膜的形成量与根系环境中的磷浓度有着密切关系,较低的磷浓度环境能够明显促进香蒲(Typhaorientalis)根表铁膜的形成.傅友强等[14]研究发现,低磷胁迫环境可显著诱导水稻形成红棕色的根表铁膜,有利于水稻根系对磷素的吸收.根据根表铁膜的营养效应,外源氮和钾的匮乏对水稻形成红棕色根表铁膜的影响不明显,且当水稻内源磷素不足时也不能诱导红棕色铁膜的形成.可见,植物根系生长环境的磷素丰缺情况对根表铁膜的形成具有重要作用.因此,探究低磷胁迫环境中杉木根表铁膜的形成情况,以及根表铁膜与杉木根系磷素吸收积累能力的关系,对于进一步挖掘杉木在低磷胁迫环境中产生的适应性生物学机制有着重要意义.
鉴于此,本研究选择同一杉木无性系的2 a生幼苗为材料,采用室内胁迫模拟盆栽试验,通过设置3个供磷水平,在分析不同处理时间(10和20 d)杉木根表形成铁膜的表型和含量差异性的基础上,结合各处理中杉木参试幼苗根系形态、生物量、根冠比、比根长以及根系与地上部磷素积累量的变化,探究不同供磷环境下杉木形成根表铁膜的变化规律,以及杉木生长性状与磷素积累量的相关性,为研究杉木根表铁膜形成机制与磷素吸收利用功能提供依据.
1 材料与方法
1.1 供试材料
选取福建省洋口国有林场培育的根系完整、无病害的2 a生洋—020号杉木无性系幼苗为试验材料,其株高为(43.58±6.62) cm.使用盆口直径18.5 cm、盆底直径10.5 cm、高度18 cm的聚乙烯材料花盆为培育容器.洗净的河沙[全磷含量为(0.130±0.004) g·kg-1,有效磷含量为(1.14±0.12) mg·kg-1]作为栽植基质,每个容器栽植1株杉木.在福建农林大学林学院温室大棚进行室内盆栽培养,温室大棚室温18~33 ℃,平均每日光照8 h·d-1,相对湿度>75%.
1.2 试验设计
将参试杉木幼苗根部洗净,参照陈智裕等[15]的方法设置3个供磷水平.处理1:不供磷处理(0 mmol·L-1KH2PO4).处理2:低磷处理(0.5 mmol·L-1KH2PO4).CK:正常供磷处理(1.0 mmol·L-1KH2PO4).其中,不供磷处理和低磷处理中缺失的K+使用KCl溶液经换算后予以等量补充,保证不同供磷水平条件下施加的K+含量一致.为满足试验期间幼苗对其他养分的需求,其余养分元素施加均参照Wu et al[16]改良的1/8 Hoagland营养液配方,以满足参试幼苗的正常生长需要.每4 d施加1次营养液,每盆每次施加100 mL.试验于2020年10月进行,每10 d收获1次幼苗,每次各处理收获3个重复,共收获2次.
1.3 指标测定
参试幼苗收获后,用去离子水洗净根系后吸干根系表面水分,将幼苗按照根系和地上部分分离,分别称取鲜重后采用数字化根系扫描仪(STD1600 Epson, USA)进行根系扫描,并运用其配套的根系分析软件WinRHIZO(version4.0B, Rengent Instruments Inc, Canada)定量分析根系长度和根表面积,然后将幼苗的根系分出5.00 g用于铁膜提取.提取铁膜后,与其余根系以及地上部分共同置于105 ℃下杀青30 min,再于65 ℃下烘干至恒重后称量,记录根系和地上部分干重.
采用连二亚硫酸钠—柠檬酸钠—重碳酸钠提取法(sodium dithionite-citrate-bicarbonate, DCB)进行根表铁膜提取[17],利用火焰原子吸收分光光度计测定提取液Fe含量.参试杉木幼苗在烘干并称量干重后用HNO3-H2O2进行微波消解,采用钼锑抗比色法[18]测定各器官磷含量.
1.4 数据分析
采用参试杉木幼苗根系表面所吸附的Fe含量来表示杉木根表铁膜形成的情况,根表铁膜含量(mg·g-1)=铁膜提取液Fe含量/用于铁膜提取的根生物量.各器官磷素积累量(mg)=各器官磷含量×各器官生物量;根冠比=根系生物量/地上部生物量;比根长(cm·g-1)=根长/根系生物量.
利用Excel 2019进行数据处理,通过SPSS 19.0对不同供磷水平处理的杉木幼苗根系形态、生物量、根表铁膜含量和磷素积累量进行单因素方差分析(one-way ANOVA)和最小显著差异( least significant difference, LSD) 法检验,用Pearson相关性分析法判断根表铁膜含量与杉木根系形态指标、生物量、磷素积累量之间的相关性.用Origin 2021软件制图,图表中数据均为平均值±标准误.
2 结果与分析
2.1 不同供磷条件下杉木根表形成铁膜的差异性
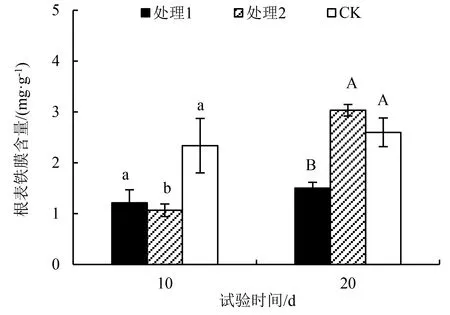
图中不同小写字母表示10 d供磷处理之间的差异显著(P<0.05);不同大写字母表示20 d供磷处理之间的差异显著(P<0.05).图1 不同供磷条件下杉木幼苗根表铁膜含量的差异Fig.1 Root iron plaque content of C. lanceolata seedlings under different P supplies
从图1可知,供磷水平和试验胁迫时间对杉木幼苗根表铁膜含量均具有较大影响.经过10 d处理,CK处理条件下形成的根表铁膜含量最高,且显著高于处理2(P<0.05).试验时间延长至20 d,处理2的根表铁膜含量提高了183.85%,处理2和CK处理的铁膜含量均显著高于处理1.而与处理10 d相比,处理1和CK在处理20 d后的铁膜含量分别提高了23.61%、11.27%.由此可见,处理2对杉木幼苗的根表铁膜形成有着明显的促进作用.
通过对参试幼苗根表颜色的观察,发现处理1的参试幼苗在试验处理20 d后在根系表面局部有红棕色物质覆盖,而处理2和CK处理未观察到明显的红棕色物质覆盖(图2).这种红棕色物质是一种胶状物而不是杉木根系木质化后形成的红棕色表皮,并且在经过DCB溶液[17]浸提后,红棕色物质的覆盖面积明显减少甚至消失,这与傅友强等[14]发现的磷胁迫环境下水稻形成红棕色铁膜的结果相似.据此可推测这是杉木幼苗根系在处理1构建的重度磷胁迫环境下形成的一种红棕色根表铁膜,其附着空间包括根系伸长区、分生区以及根冠等部位的表层,表现出局部区域的连续覆盖,但未见均匀分布在全株根系.
2.2 供磷水平对杉木幼苗生长的影响
由表1可见,在试验初期(10 d),供磷水平对杉木幼苗根冠比、比根长、根长、根表面积等生长指标的影响均未达显著水平;随着试验时间延长至20 d,处理2杉木根系出现明显生长,其根长和根表面积分别比试验处理10 d时增长27.34%、48.79%.与处理1相比较,不同试验时期(10和20 d)内处理1和CK均有利于杉木幼苗根系生物量的积累(P<0.05).

图中方框选取部分为根系红棕色铁膜形成的局部区域.图2 不同供磷条件下杉木幼苗根系红棕色铁膜的形成情况Fig.2 Red-brown iron plaque on root surface of C. lanceolata seedlings under different P supplies
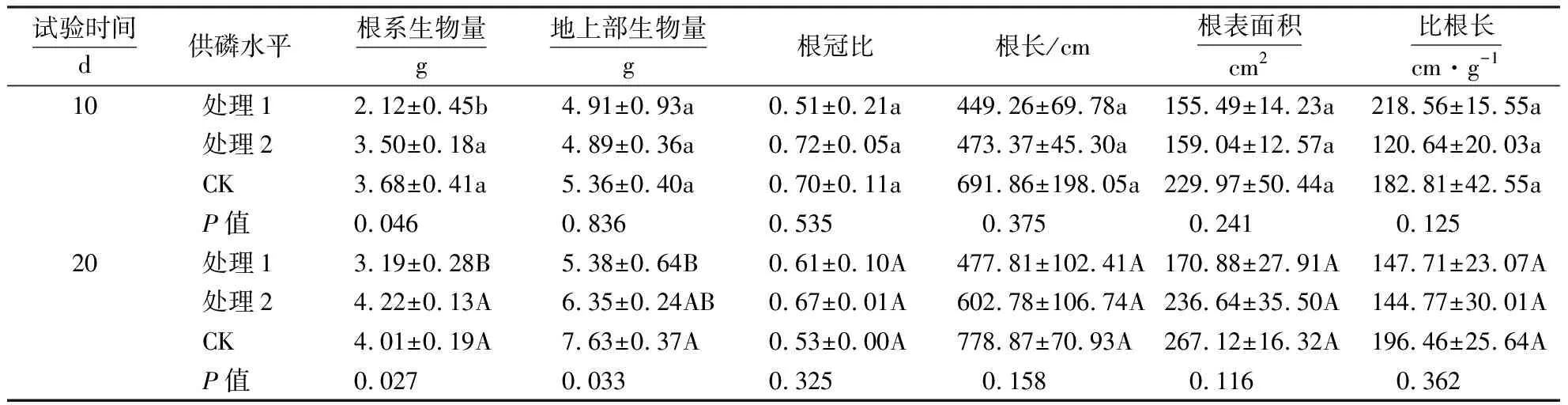
表1 不同供磷水平的杉木幼苗根系形态和生物量分配1)Table 1 Root morphology and biomass of C. lanceolata seedlings under different P supplies
2.3 供磷水平对杉木磷素积累量分配的影响
由图3可知,在试验10 d时,CK根系磷素积累量显著高于处理1和处理2(P<0.05),而2种处理和对照的地上部磷素积累量无显著差异.随着试验时间延长至20 d,不同处理的根系和地上部磷素积累量保持相同的变化趋势,随供磷水平的提高而递增.其中CK和处理2的根系磷素积累量显著高于处理1;CK的地上部磷素积累量也显著高于处理1.处理1和处理2的根系磷素积累量分别增长了23.95%、91.96%,CK则无明显变化;而处理1的地上部磷素积累量无明显变化,处理2和CK分别增长了44.39%和80.86%.
2.4 根表铁膜含量与杉木生长及磷素积累量的相关性
从图4可看出,根表铁膜含量与参试幼苗的根系生物量、地上部生物量、根长、根表面积、根系磷素积累量、地上部磷素积累量的相关系数分别为0.59、0.52、0.54、0.64、0.64和0.48,均呈显著正相关关系(P<0.05),但与根冠比和比根长的相关性未达显著水平.表明杉木根表铁膜的形成有利于杉木幼苗根系和地上部磷素积累,进而对根系形态生长及植株生物量积累产生积极的影响.
3 讨论与结论
3.1 杉木根系形成根表铁膜的能力
本研究发现,正常供磷、低磷处理、不供磷处理3种条件下的参试杉木幼苗均可从根表提取测定出根表铁膜含量.其中,仅不供磷(处理1)条件下的杉木幼苗根系能观察到明显的红棕色根表铁膜形成(图2).然而,从颜色上鉴别,根表铁膜可区分为红棕色铁膜与非红棕色铁膜,两者主要是由于形态结构的差异而出现了不同的颜色,但生物功能大致相同[14,19].傅友强等[14]研究发现红棕色根表铁膜的可见程度与根系生长环境的外源磷缺乏程度有关,当外源磷素匮乏时就会诱导红棕色根表铁膜的形成,这与本研究结果相似.本研究结果表明,不同供磷处理条件下参试杉木幼苗根表铁膜平均数量达1.92 mg·g-1.试验处理10 d和20 d时,正常供磷(CK)环境中的杉木幼苗根系表面虽未观察到红棕色铁膜,但经测定,其根表铁膜含量分别为2.29和2.55 mg·g-1.
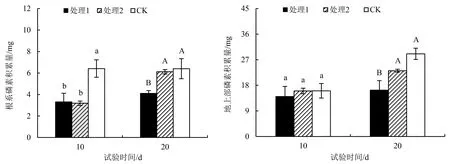
图中不同小写字母表示10 d供磷处理之间差异显著(P<0.05);不同大写字母表示20 d供磷处理之间差异显著(P<0.05).图3 不同供磷处理杉木根系和地上部磷素积累量Fig.3 P accumulation of C. lanceolata seedlings under different P supplies
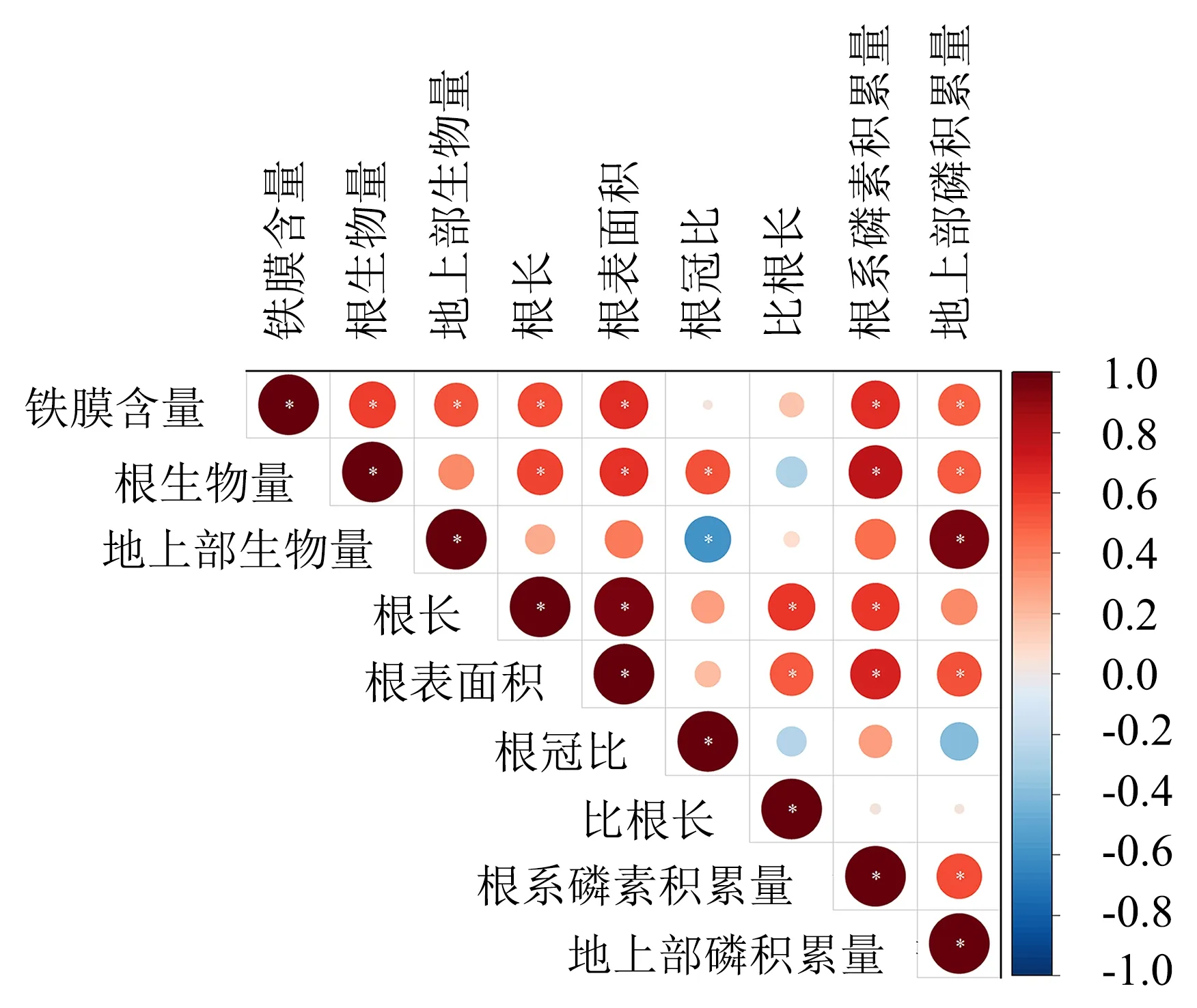
*表示在0.05水平(双侧)上显著相关.红色表示指标之间呈正相关关系,蓝色表示指标之间呈负相关关系,指标间的相关程度越大则颜色越深,圆形面积也越大.图4 杉木根表铁膜含量与根系形态、生物量分配和磷素积累量的相关性分析Fig.4 Correlation analysis of root iron plaque content with root morphology, biomass allocation and P accumulation in C. lanceolata seedlings

从试验时间的变化来看,CK和处理1的铁膜含量仅分别增长了11.27%和23.61%,而处理2的根表铁膜含量从10 d至20 d,提高了183.85%,表明处理2对参试幼苗根表铁膜形成的促进作用最为明显.这可能是由于根表铁膜形成是一个动态变化过程,需同时具备2个条件即根际氧化环境和根际Fe2+浓度[10].杉木根系在磷胁迫环境中会产生、分泌活性氧,并释放有机酸活化根际土壤中的难溶性磷酸铁供自身吸收,从而改善根际氧化环境,同时也提高了根际微环境中Fe2+浓度,最终有利于根表铁膜的形成[5,21];而不供磷处理构建的重度磷胁迫分泌有机酸较多[22],根表覆盖的铁膜被大量活化分解,从而呈现出缓慢增长的状态.经相关性分析发现,参试杉木根表铁膜含量与根长、根表面积、根系生物量等根系形态指标均呈显著正相关关系,进一步表明随着杉木幼苗对低磷胁迫环境响应程度的增强,植株会将养分优先分配给地下部分,通过伸长根系、增大根表面积等方式来提高根系的觅磷能力,同时也为根表铁膜形成提供了更大的附着空间[3-5].
3.2 根表铁膜对杉木抵抗低磷逆境的贡献
植物在磷素有限的逆境条件下为了生存会适应性地提高自身对磷素吸收利用的能力,以缓解外界磷素匮乏的危机[23].本研究发现,处理10 d时,不同供磷处理的杉木根系磷素积累量表现为CK显著大于处理1和处理2(P<0.05),各处理的地上部磷素积累之间均无显著差异(P>0.05).相较于试验10 d时,处理2的根系磷素积累量增长了91.96%,处理2和CK的地上部磷素积累量分别增长了44.39%和80.86%.处理20 d后,CK和处理2的根系磷素积累量均显著高于处理1.这可能是由于杉木幼苗在正常供磷环境下会将得到的磷素优先供给地上部生长,低磷胁迫环境需要经过一定的胁迫时间才通过形态生理学指标的变化来增强自身对磷素的吸收、利用能力.通过相关性分析发现,杉木根表铁膜含量与根系磷素积累量存在显著正相关关系,这可能是由于铁膜通过吸附或共沉淀的方式成为一个“库”将磷素储存其中,以供杉木根系缓慢吸收[24-25].然而,这种作用在提供根系更多磷素储备的同时也限制了根系对于磷素的吸收[26].
有研究[8,14]表明,铁膜对植株根系磷素吸收的这种限制与土壤低磷胁迫环境存在显著差异,根表铁膜虽然将磷素吸附固定限制了根系的吸收,但也有利于土壤空间中的更多磷素向植株根系聚集,从而间接拓展了根系觅磷范围.此外,当杉木体内磷素不足时,该植株则会通过根系释放有机酸等分泌物活化铁膜中的磷素营养以提高磷素吸收效率,而且有机酸的释放会酸化根际环境,从而进一步促使土壤中的铁氧化物与磷素结合形成根表铁膜[25-28].因此,根表铁膜的形成可明显提高杉木幼苗的磷素吸收、积累能力,从而有助于杉木抵抗低磷胁迫逆境.
本研究结果表明:不同供磷水平的杉木幼苗均能够形成根表铁膜,其中处理1能观察到明显的红棕色根表铁膜形成.杉木幼苗的根表铁膜含量与供磷水平以及试验时间均有着密切关联:当试验处理10 d时,CK在环境中具有丰富的磷素时更易与铁氧化物结合形成铁膜;试验处理延长至20 d时,2种处理和CK的根表铁膜含量均出现增长的情况,其中,处理2对根表铁膜含量提高的促进作用最强.通过相关性分析得知,杉木根表铁膜含量与根系和地上部磷素积累量呈显著正相关关系.可见,提高杉木幼苗根表铁膜含量能有效提高根系和地上部的磷素积累能力以抵抗磷胁迫逆境.

