印度梨形孢对百香果抗寒性的影响
梁党弟, 黄旭萍, 唐启文, 韦晓霞, 李斌奇, Ralf Oelmüller,4, 陈发兴
(1.福建农林大学园艺学院,福建 福州 350002;2.漳平市新桥镇人民政府,福建 龙岩 364403;3.福建省农业科学院果树研究所,福建 福州 350013;4.耶拿大学普通植物与植物生理研究所,图林根州 耶拿 07743)
百香果(PassifloraedulisSims.)为西番莲科(Passifloraceae)西番莲属(Passiflora)的草质藤本植物[1],在福建、广西、台湾、云南等地广泛种植[2].近年来,百香果市场接受度高,我国种植面积迅速增长,百香果产业已成为我国部分地区的重要经济产业之一[3].百香果对温度敏感,温度过高或偏低均易造成其生理障碍[4];秋冬季低温会导致果实不能完熟,且低温寒害或冻害会抑制幼苗生长,使叶片萎蔫,植株生长缓慢甚至停止,给众多果农造成较大的经济损失[5-6].因此,提高植株抗寒性对保障百香果产业可持续发展具有重要意义.
断路器的合闸出现问题时,容易造成断路器发热;分闸不可靠会导致无法对故障进行彻底切除,从而引发断路器产生电弧,这对系统的稳定将将会产生一定影响。
印度梨形孢(Piriformosporaindica)是印度学者Varma et al[7]在印度西北部塔尔沙漠中发现的一种根部内生真菌[8],其宿主范围广泛[9-10],对宿主植物具有促生和抗逆作用[11].王斌等[12]研究表明,在4 ℃低温处理下,经印度梨形孢预处理的香蕉(Musaspp.)苗冷害症状轻于未处理组,且电解质渗透率下降了47.8%,说明根系定殖印度梨形孢能提高香蕉苗的抗寒性;杨芮[13]研究表明,印度梨形孢可以通过提高红掌(Anthuriumandraeanum)的抗氧化能力增强其抗寒性;Wei et al[14]指出,在低温胁迫下,印度梨形孢通过诱导拟南芥(Arabidopsisthliana)CBF基因的表达,提高其抗冻性和解冻后的恢复能力;Wei et al[15]还通过转录组分析发现,拟南芥经印度梨形孢处理后,在634个差异表达基因中有193个上调表达.
本实验室前期研究表明,印度梨形孢对百香果生长具有重要作用,可以促进其根系生长和果实发育,并参与调控百香果的逆境胁迫响应能力和果实品质[11],但印度梨形孢对百香果抗寒性的影响尚不明确.鉴于此,本试验通过印度梨形孢侵染百香果根系培育有益菌共生株系,并测定低温胁迫下百香果叶片的细胞膜损伤程度、渗透调节物质积累量和抗氧化酶活性等,以明确印度梨形孢对百香果抗寒性的影响,为秋冬季低温产区百香果的种植提供依据.
1 材料与方法
1.1 材料
百香果种苗由福建百果壹号农业发展有限公司提供,种苗健康且长势一致,高度约30 cm,种植地年均温19.6~21.1 ℃,年均日照时数1 880~1 888 h,年均雨量1 498~1 900 mm,终年无霜或仅有短霜期,气候条件较适合百香果植株生长.印度梨形孢菌株由德国耶拿大学Ralf Oelmüller教授提供.
管理会计与财务会计都是现代企业中不可缺少的,它们相互促进、相辅相成,共同发挥着管理与控制的基本职能。当下,在企业的运营过程中,无论是资本预算,还是战略决策和投资方向,都能很好地体现二者的融合,这也说明了财务会计与管理会计共同掌握着企业的生存与发展。
1.2 试验设计
低温胁迫0 h时两种处理的百香果幼苗表型无明显差异(图2).而低温胁迫24 h时两种处理的冷害症状差异显著(图2):CK组幼苗叶片表现卷曲、萎蔫和水渍等症状;印度梨形孢处理组也出现了冷害症状,但叶片卷曲程度明显轻于CK组,水渍面积更小.
1.3 生理生化指标的测定
将PDB培养基(内含印度梨形孢菌块)置于30 ℃恒温摇床中振荡150 r·min-1培养5~7 d,菌丝呈现团块状,随培养时间的延长菌丝体逐渐变大(图1A).接种印度梨形孢15 d后,在显微镜(凤凰MC-D500U)下可清晰地观察到百香果幼苗根表皮上圆形或梨形的厚垣孢子(图1B),说明印度梨形孢已成功定殖在百香果根系.
1.4 数据统计与分析
四要全面推进节水型社会建设,突出抓好工业、农业、城市生活等领域的节水防污,搞好废污水处理回用、雨水集蓄利用、海水直接利用与淡化利用。
2 结果与分析
2.1 印度梨形孢在百香果根系的定殖情况
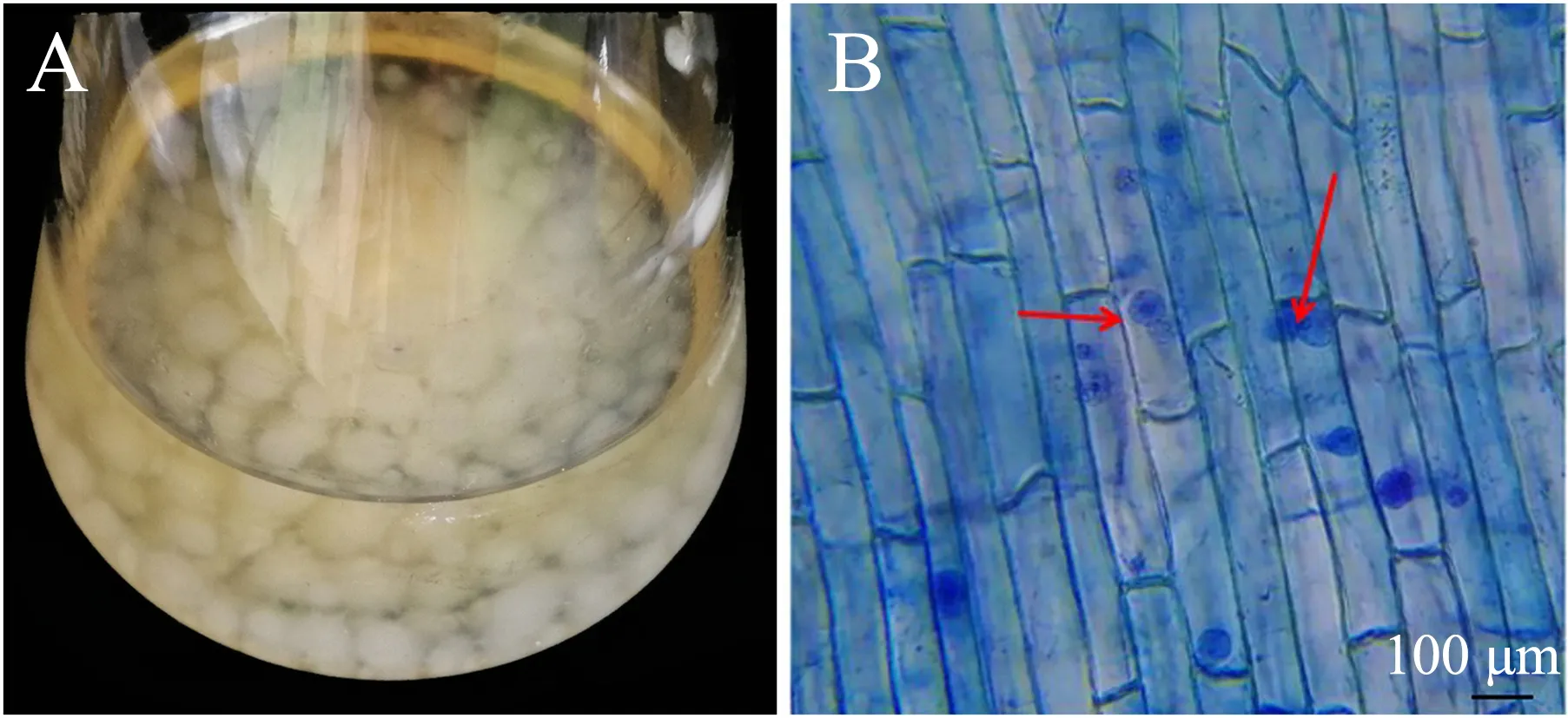
图1 印度梨形孢菌液(A)及其在百香果幼苗根系的定殖情况(B)Fig.1 Culture filtrate of P.indica (A) and its colonization in root system of passion fruit seedling (B)
使用Excel 2018软件统计数据,用IBM SPSS Statistics 22软件分析不同处理间在0.05水平上的差异显著性,使用GraphPad Prism7.0和Photoshop软件作图.
2.2 印度梨形孢对低温胁迫下百香果幼苗表型的影响
将百香果幼苗随机分成对照组(CK)和印度梨形孢处理组各30株.印度梨形孢菌液的制备参照Yan et al[11]的方法.将菌液用无菌水稀释至D600 nm=1.121,浇灌5 mL菌液于百香果幼苗根部附近,间隔15 d注射1次,共注射2次;CK组浇灌蒸馏水.将幼苗置于室温(25 ℃左右)下培养7 d后,分别置于0 ℃培养箱中(低温胁迫)处理0、6、12和24 h,记录不同处理的植株表型.取顶部真叶第2~3片叶用于生理生化指标测定,每个处理设5个生物学重复.
2.3 印度梨形孢对低温胁迫下百香果叶片细胞膜稳定性的影响
百香果叶片电导率随着低温胁迫时间的延长而上升,但根系定殖印度梨形孢的百香果叶片在低温胁迫12和24 h时相对电导率显著低于CK组(P<0.05),分别下降了21.51%和24.30%(图3A).
随着低温胁迫时间的延长,可溶性糖含量呈现上升趋势(图4C).印度梨形孢处理组的可溶性糖含量在低温胁迫6、12、24 h时显著高于CK组(P<0.05).
通过本底和测量效率的数据分析,最终选择道址范围为 100~350,在此范围内 FM值处于较高值,本底相对较低。在100~350的道址范围内进行淬灭—效率曲线绘制(见图2),拟合公式的 R2值都在 0.98以上。利用拟合公式,结合各点的SQP(E)值进行效率计算,测量效率与计算效率偏差都在±2%范围内(见表5)。

图2 印度梨形孢对百香果低温表型的影响Fig.2 Effect of P.indica on hypothermic phenotype of passion fruit
低温胁迫后百香果叶片的MDA浓度升高,但低温胁迫12和24 h时印度梨形孢处理组的MDA浓度显著低于CK组(P<0.05),分别降低了25.86%和18.65%(图3B).
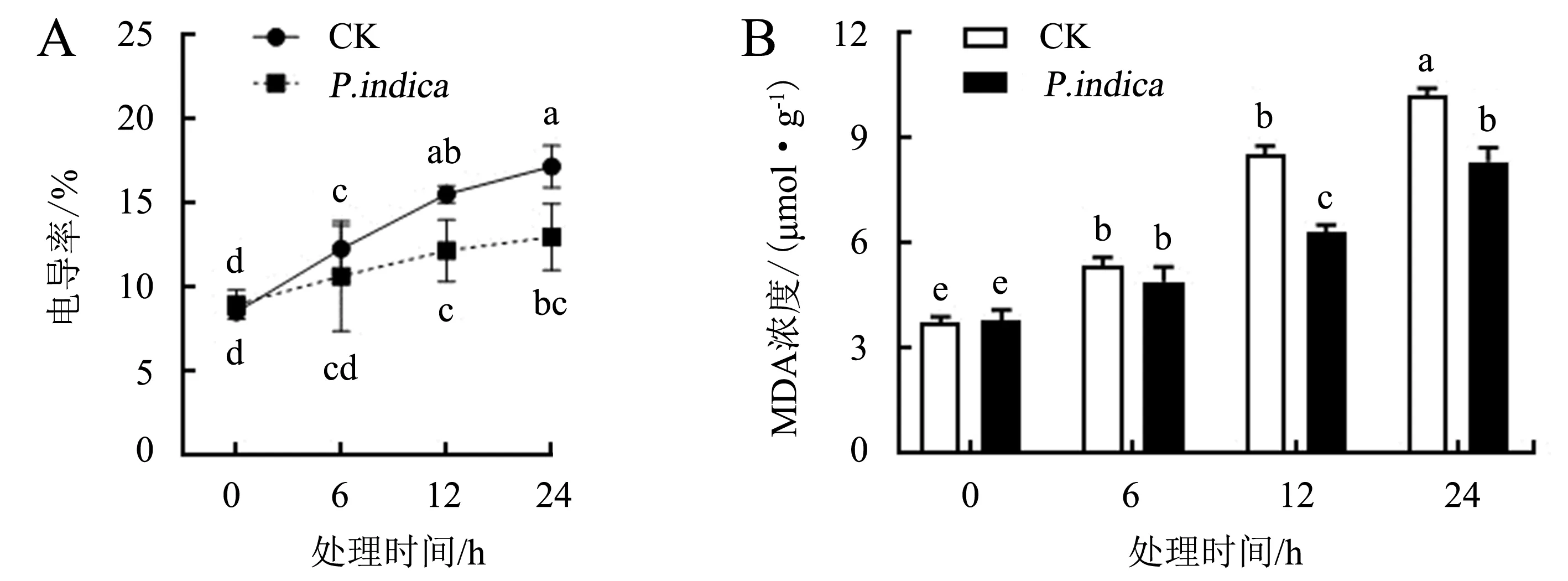
图上不同字母表示同一时间不同处理间差异显著(P<0.05).图3 印度梨形孢对低温胁迫下百香果叶片电导率(A)和MDA浓度(B)的影响Fig.3 Effect of P.indica on electrical conductivity (A) and MDA content (B) of passion fruit leaves under cold stress
2.4 印度梨形孢对低温胁迫下百香果叶片渗透调节物质的影响
随着低温胁迫时间的延长,Pro含量呈上升趋势(图4A).低温胁迫0和6 h时印度梨形孢处理组的Pro含量与CK组差异不显著(P>0.05);低温胁迫12和24 h时印度梨形孢处理组的Pro含量分别比CK组提高了35.72%和36.42%,差异显著(P<0.05); 低温胁迫24 h时印度梨形孢处理组的Pro含量与0 h相比升高了108.18%,差异显著(P<0.05).
随着低温胁迫时间的延长,两种处理的可溶性蛋白含量逐渐上升(图4B).低温胁迫0和6 h时两种处理的可溶性蛋白含量差异不显著(P>0.05),12和24 h时印度梨形孢处理组的可溶性蛋白含量比CK组升高了20.79%和38.51%.
3G手机是基于移动互联网技术的终端设备,除了能完成高质量的日常通信外,还能进行多媒体通信。用户可以在3G手机的触摸显示屏上直接写字、绘图,并将其传送给另一台手机,还可以用3G手机直接上网,查看电子邮件或浏览网页;有的3G手机自带摄像头,这将使用户可以利用手机进行电脑会议[2]。
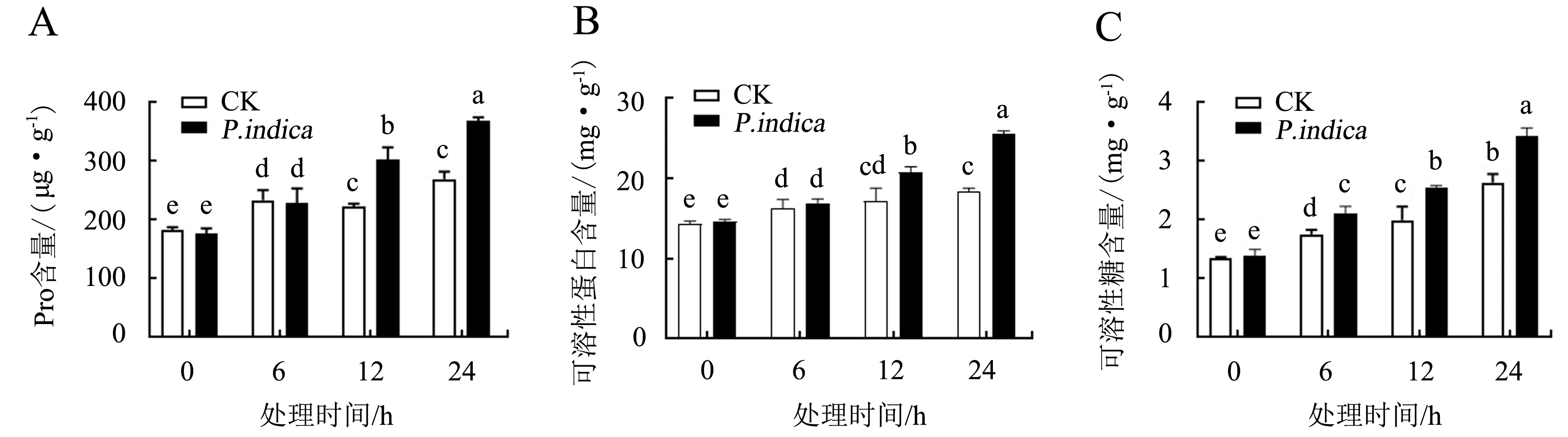
A.Pro含量;B.可溶性蛋白含量;C.可溶性糖含量.柱上不同字母表示同一时间不同处理间差异显著(P<0.05).图4 印度梨形孢对低温胁迫下百香果叶片渗透调节物质的影响Fig.4 Effect of P.indica on osmotic regulators in passion fruit leaves under cold stress
2.5 印度梨形孢对低温胁迫下百香果叶片抗氧化酶活性和活性氧浓度的影响
低温处理下印度梨形孢处理组的SOD活性呈现上升趋势(图5A).CK组低温胁迫初期SOD活性呈上升趋势,胁迫12 h时SOD活性达到峰值(604.32 U·g-1);印度梨形孢处理组的SOD活性在低温胁迫6和24 h时显著高于CK组(P<0.05).APX活性随低温胁迫时间的延长表现出上升趋势(图5B),印度梨形孢处理组的APX活性在6、12、24 h时分别比CK组升高了23.79%、28.27%和32.21%,差异显著(P<0.05).印度梨形孢处理组的CAT活性呈显著上升趋势(图5C),在胁迫12和24 h时分别比CK组提高了60.16%和49.10%.这说明低温胁迫下印度梨形孢增强了百香果叶片的SOD、APX和CAT活性.
图6A显示:低温胁迫0 h时印度梨形孢处理组的GSH含量与CK组差异不显著(P>0.05);胁迫6 h时印度梨形孢处理组的GSH含量比CK组升高了28.69%;胁迫12 h时印度梨形孢处理组的GSH含量达到最高(2.26 μmol·g-1),比CK组升高了23.23%.
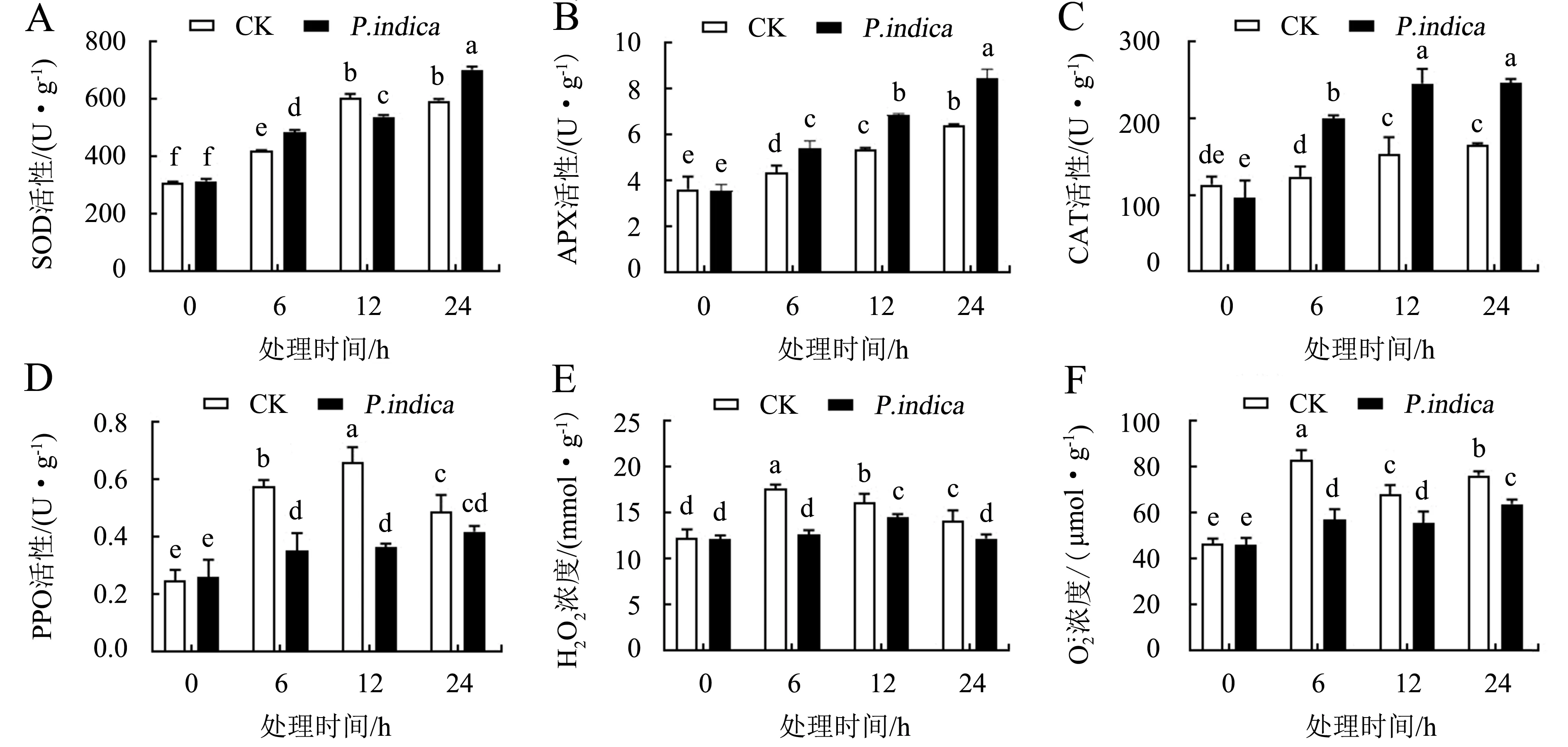
A.SOD活性;B.APX活性;C.CAT活性;D.PPO活性;E.H2O2浓度;浓度.柱上不同字母表示同一时间不同处理间差异显著(P<0.05).图5 印度梨形孢对低温胁迫下百香果叶片抗氧化酶活性和活性氧浓度的影响Fig.5 Effect of P.indica on antioxidant enzymes activities and reactive oxygen concentration in passion fruit leaves under cold stress
2.6 印度梨形孢对低温胁迫下百香果叶片抗氧化物活性的影响
图6B显示:随着低温胁迫时间的延长,两种处理的GR活性均呈先上升后下降的趋势,且均在12 h时达到峰值(162.71和197.38 nmol·min-1·g-1).低温胁迫0 h时两种处理的GR活性差异不显著(P>0.05);低温胁迫6和12 h时印度梨形孢处理组的GR活性显著高于CK组(P<0.05),分别升高了14.71%和21.31%;而胁迫24 h时印度梨形孢处理组的GR活性显著低于CK组(P<0.05).
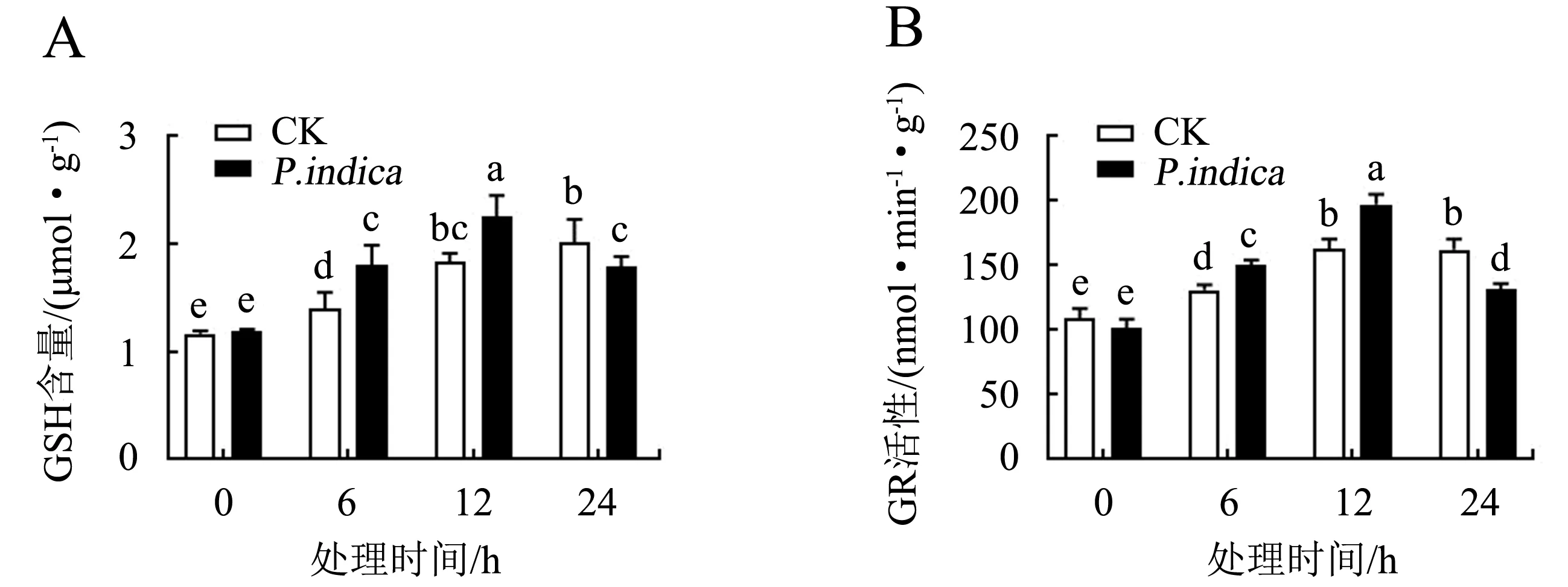
柱上不同字母表示同一时间不同处理间差异显著(P<0.05).图6 印度梨形孢对低温胁迫下百香果叶片GSH含量(A)和GR活性(B)的影响Fig.6 Effect of P.indica on reduced glutathione level (A) and glutathione reductase activity (B) in passion fruit leaves under cold stress
3 讨论
徐万茹[19]研究表明,印度梨形孢可增加逆境胁迫下白榆(UlmuspumilaL.)中可溶性糖等渗透调节物质的含量,维持细胞的正常代谢.本研究结果也表明:0 ℃胁迫12 h时印度梨形孢处理组的百香果叶片可溶性糖、可溶性蛋白和Pro含量均高于CK组.这说明印度梨形孢在一定程度上促进了细胞合成新的蛋白质以及糖类物质,降低了低温胁迫下百香果叶片的损伤程度.
电导率和MDA浓度反映细胞膜氧化损伤程度[20-21].印度梨形孢与百香果植株共生后,低温胁迫下叶片的MDA浓度和相对电导率均比CK组降低,这有利于减轻低温胁迫下膜脂过氧化对叶片细胞的损伤程度.在低温胁迫下,印度梨形孢通过提高抗氧化酶活性促进红掌[13]和大麦(HordeumvulgareL.)[22]的生长,说明印度梨形孢具有增强植物抗寒性的潜力.本研究结果显示,百香果接种印度梨形孢仍会出现冷害症状,但叶片卷曲程度明显轻于CK组,水渍面积更小,与 Li et al[23]的研究结果一致.这说明印度梨形孢提高了百香果的抗寒性.
吸附材料上还存在着3点不足:(1)重金属的吸附有限制条件,比如温度、pH值的不同,对重金属的吸附都有影响,中药材的水煎液大都为中性,会对材料的官能团有限制。(2)中药材里重金属的种类较多,且都是微量存在,但脱除材料对于金属的吸附有选择性,现有的天然材料已不能满足吸附效果,应针对不同的重金属加以结构修饰改造,以便提高重金属的吸附率。(3)中药材里的基质成分复杂,需要注意脱除过程中吸附材料对有效成分的影响,可以根据不同药物的性质及主要含量选用不同的材料。同时也可以将几种方法与吸附材料结合使用,相互补足。
综上所述,百香果根系定殖印度梨形孢能减轻叶片细胞膜的损伤程度,增强其抗氧化能力,进而提高百香果的抗寒性.

