基于高通量测序解析浓香型大曲真菌群落结构及其与质量指标的关联性分析
程伟,陈雪峰,陈兴杰,周端,付欢,薛锡佳,鹿静静,代森
1(陕西科技大学 食品与生物工程学院,陕西 西安,710021)2(安徽金种子酒业股份有限公司,安徽 阜阳,236023) 3(陕西农产品加工技术研究院,陕西 西安,710021)
中国白酒以大曲作为酿造的糖化、发酵、酒化与生香剂,大曲培养过程中富集的环境微生物是白酒酿造微生物的重要来源;同时,大曲质量对白酒的出酒率及品质具有重要影响[1-2]。微生物群落结构对大曲质量及原酒的风格和品质具有重要影响,研究大曲微生物及其与质量指标的关联,对明确白酒风格特点具有重要意义。大曲微生物主要包括细菌和真菌两大类,其中真菌在酿酒过程的产酒、产酶、产香等方面起到重要作用[3]。近年来,采用高通量测序对大曲微生物进行了较多研究。如施思等[4]利用高通量测序对浓香型大曲贮藏阶段的真菌多样性进行分析,结果表明贮藏阶段大曲的真菌群落结构不断变化,毕赤酵母属、根霉属和恒梗霉属为最终的优势菌群。关于大曲微生物群落结构与功能的研究也有报道,通过整合宏基因组学与宏蛋白质组学分析,并基于鉴定功能酶的物种注释分析,有助于建立大曲微生物组与酶系的关联[5]。如柳习月等[6]采用多组学解析酱香型大曲风味物质的形成,结果表明不同曲种中的微生物、酶和代谢产物之间存在相关性;其中,芽孢杆菌与糖化酶、蛋白酶和四甲基吡嗪等呈正相关。丝状真菌为大曲提供糖化动力,并对大曲培养起到关键作用;同时,大曲中的霉菌代谢产生糖化酶、蛋白酶、脂肪酶、淀粉酶等水解酶系,此类酶系对降解发酵原料和产生酒体风味物质具有重要贡献[7]。
当前,关于大曲微生物结构及其与质量指标的关联性研究逐渐增多[8-9]。如李丹宇[10]研究发现在制曲过程中,大曲的糖化力、液化力和蛋白分解力等指标与大曲中的真菌数量和种类呈正相关。然而,关于不同产区浓香型大曲的真菌群落结构及其与质量指标的关联研究还鲜有报道,尤其是曲皮及曲心的真菌群落结构与质量指标的关联分析较少。本实验通过高通量测序解析不同产区浓香型大曲的真菌群落结构,并与大曲质量指标进行关联分析,旨在为解析浓香型大曲的糖化生香机理及筛选优良酿造功能微生物提供依据,同时对大曲微生物组信息扩充具有一定的参考价值。
1 材料与方法
1.1 材料与试剂
大曲样品均为培养成熟刚入库贮存的浓香型大曲,分别取自四川宜宾(YB)、四川泸州(LZ)、山东济宁(JN)、安徽阜阳(FY)、安徽亳州(BZ)和安徽临泉(LQ)等地区。
氯化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯),天津市永大化学试剂有限公司;饱和酚、十二烷基硫酸钠、乙二胺四乙酸-Na2、十六烷基三甲基溴化铵(cetrimonium bromide,CTAB)(均为分析纯),北京索莱宝科技有限公司;三羟甲基氨基甲烷(分析纯),美国Sigma-Aldrich公司;AxyPrep DNA凝胶回收试剂盒,美国QIAGEN公司。
1.2 仪器与设备
TGL-20M高速冷冻离心机、超低温冰箱,上海卢湘仪离心机仪器有限公司;GeneAmp@9700型聚合酶链式反应PCPO仪,美国ABI公司;MX.S型可调式混匀仪,美国SCILOGEX公司;QuantiFluor型-ST蓝色荧光定量系统,美国Promega公司。
1.3 实验方法
1.3.1 取样方法
分别取大曲表层1~2 cm的曲料作为曲皮样品(S组),取曲块中心2~3 cm3区域的曲料作为曲心样品(I组),随机取3个平行样本,再分别平均分为2份;其中1份在无菌环境下将每个曲样的3个平行样品分别单独等量混合粉碎后,保存于无菌袋中,置于-80 ℃冰箱准备真菌群落结构分析;另1份将每个曲样的3个平行样品分别单独等量混合粉碎后,保存于普通样品袋中,置于4 ℃冰箱准备进行质量指标检测。
1.3.2 大曲真菌群落结构分析
大曲微生物DNA提取:采用改良的CTAB法[11]提取大曲微生物总DNA,最后向离心管中加入 200 μL 无菌双蒸水使DNA沉淀溶解,并贮于-20 ℃冰箱备用,利用琼脂糖凝胶电泳检测DNA的纯度和浓度。
聚合酶链式反应(polymerase chain reaction,PCR)扩增定量:以稀释后的基因组DNA为模板,选择测序区域并使用带Barcode的特异引物(Phusion®High-Fidelity PCR Master Mix with GC Buffer:New England Biolabs)和高效高保真酶进行PCR,以确保扩增效率和准确性;引物对应区域:ITS1区引物(ITS5-1737F和ITS2-2043R)。
PCR产物的混样和纯化:使用20 g/L的琼脂糖凝胶对PCR产物进行电泳检测;对检测合格的PCR产物进行磁珠纯化,采用酶标定量并根据PCR产物浓度进行等量混样,充分混匀后使用20 g/L的琼脂糖凝胶电泳检测PCR产物,对目的条带使用凝胶回收试剂盒回收产物。
文库构建和上机测试:采用TruSeq®DNA PCR- Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后使用NovaSeq6000进行上机测序。建库与测序在苏州帕诺米克生物医药科技有限公司完成。
数据统计与绘图:高通量测序完成后,进行数据分析与序列优化[12]。根据序列的相似性,将序列相似性大于等于97%分归为同一操作分类单元(opera- tional taxonomic units,OTU),将所有序列与Silva库(版本SILVA_138.1)比对得到序列的分类学信息;构建稀释曲线和Shannon曲线,判断取样的合理性和测序量、测序深度的有效性;利用生信云平台、R语言和AI作图工具绘制稀释曲线和堆积柱状图等[13]。
1.3.3 大曲质量指标检测
参照轻工行业大曲质量标准(QB/T 4257—2011《酿酒大曲通用分析方法》)的相关方法,分别检测各样品的水分、酸度、淀粉和还原糖等理化指标,以及发酵力、糖化力和酯化力等生化指标;其中,酯化力的测定采用酯化72 h作为反应时间,其单位是mg/(g·72 h);各样品的质量指标均分别检测3次取平均值。
1.4 大曲真菌群落结构与质量指标的Spearman相关性分析
利用SPSS软件对曲皮与曲心中的优势真菌属(相对丰度≥1%)及其质量指标进行Spearman相关性分析,以分析两者之间的关联性。
2 结果与分析
2.1 大曲真菌多样性分析
2.1.1 序列统计与有效性分析
对各样品的DNA进行测序,测序序列经质控过滤后分别得到71 295~91 030条真菌的有效序列,其平均长度为217~269 bp,聚类分析共产生3 379个OTU分类。稀释曲线通常用来比较测序数据量及物种丰富度,当曲线趋向平缓时,更多的数据量只会产生少量新的OTU,反之则表明继续测序还可能产生较多新的OTU[14]。由本实验的稀释曲线和Shannon曲线以及表1可知,覆盖率在99%相似度的OTU水平进行Chao1指数计算以估计物种总数,随着测序深度的增加,Chao1指数曲线逐步趋于平缓,表明本次实验的取样合理,结果能代表样本的真实情况。
2.1.2 Alpha多样性分析
通过样品的微生物多样性分析(Alpha多样性),可以反映微生物群落的丰度和多样性[15]。由表1可知,12个样品的覆盖率均大于0.999,表明各样品文库的覆盖率较高,样品序列基本被完全测出,本测序结果可靠。Shannon指数和Simpson指数均能表现出样品中物种的丰富度、均匀度及多样性。由表1可知,JNS的Shannon指数和Simpson指数均高于其他样品,表明JNS中的物种丰富度、均匀度及多样性均最高。Ace指数用于计算群落丰度,其值越大说明样品中微生物的丰度越高,由表1的Ace指数可知,BZS的群落丰度高于其他样品。Chao1指数能估算样品中的物种数目(即OTU数目),由表1的Chao1指数可知,BZS和JNI的物种总数在对应样品组中均高于其他样品。
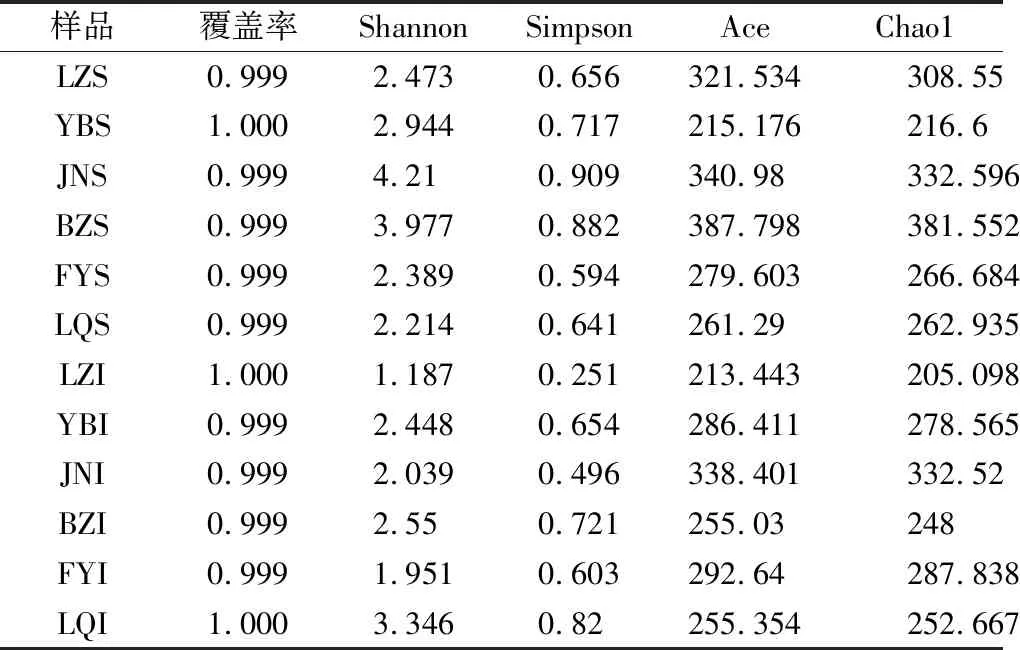
表1 不同大曲样品真菌Alpha多样性指数Table 1 Alpha diversity index of fungal in different Daqu samples
2.1.3 OTU分布的Venn分析
对获取的OTU进行统计分类,并对样品之间相对共有及独有的OTU数进行叠加,得到OTU分布Venn图,以比较OTU数目组成相似性及重叠情况[16]。如图1所示,S组的真菌OTU总数为651个,共有OTU数为43个,占OTU总数的6.6%;BZS的OTU数为150个,占OTU总数的6.6%。I组的真菌OTU总数为719个,共有OTU数为47个,占OTU总数的6.5%;LQI的OTU数为175个,占OTU总数的24.34%;JNI的OTU数为94个,占OTU总数的13.07%,LQI和JNI的OTU数占比均较高。
对S组而言,43个共有OTU数占FYS总OTU数的45.57%,其占比在S组中最高;43个共有OTU数占BZS总OTU数的28.67%,其占比在S组中最低。对I组而言,47个共有OTU数占BZI总OTU数的54.02%,其占比在I组中最高;47个共有OTU数占LQI总OTU数的26.86%,其占比在I组中最低。综上表明,FYS和BZI在对应样品组中的真菌多样性最高,BZS和LQI在对应样品组中的真菌多样性最低,也可以反映出不同地区的大曲真菌群落结构具有差异性。
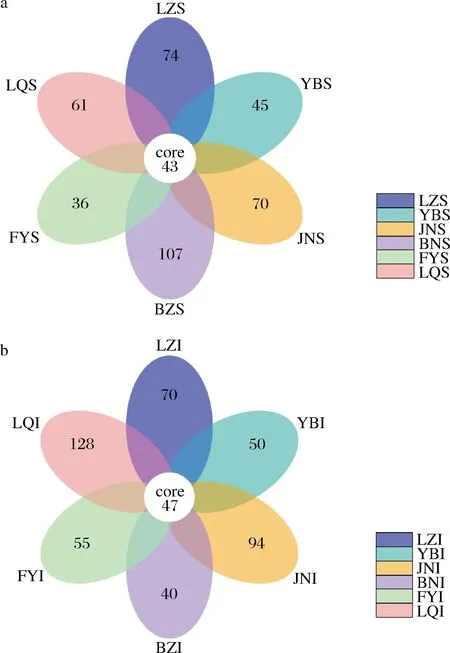
a-曲皮样品(S组);b-曲心样品(I组)图1 不同大曲样品真菌OTU的差异性(花瓣图)Fig.1 OTU variability of fungal in different Daqu samples(petal diagram)
2.2 大曲真菌群落结构分析
2.2.1 大曲微生物真菌门的分类
将各类OTU的代表序列与Unite的真菌数据库进行比对,得到每个OTU在不同分类水平的物种分类信息。如图2-a所示,S组和I组的真菌组成均可归为子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)和担子菌门(Basidiomycota)等3个菌门,其在S组的占比分别为52.52%、41.6%和0.6%,在I组的占比分别为87.41%、9.2%和0.9%;其中,两个样品组的优势菌门均为子囊菌门(Ascomycota),其丰度均在50%以上,同时子囊菌门(Ascomycota)在I组中占有绝对优势。张会敏等[17]利用ITS rDNA克隆文库法分析古井贡酒大曲(中温大曲)的真核群落结构,结果表明中温大曲的真菌组成可归子囊菌门(Ascomycota)、毛霉亚门(Mucoromycota)和担子菌门(Basidiomycota)等3个菌门,该研究结果与本实验的结果相似。
此外,如图2-b所示,在S组中,BZS和LQS中毛霉菌门(Mucoromycota)的占比分别为5.46%和7.21%,低于其他曲皮样品;而BZS和LQS中的子囊菌门(Ascomycota)占比分别为90.94%和82.45%,明显高于其他曲皮样。在I组中,LQI中子囊菌门(Ascomycota)的占比为63.3%,明显低于其他曲心样品;而LQI中毛霉菌门(Mucoromycota)的占比为44.48%,明显高于其他曲心样品。
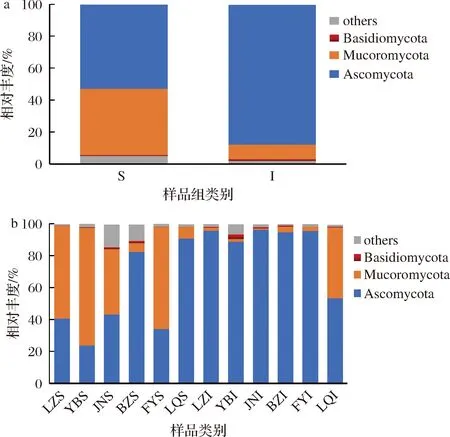
a-不同样品组;b-不同样品图2 不同大曲样品真菌门水平的相对丰度柱状图Fig.2 Column chart of relative abundance at fungal phyla level in different Daqu samples
2.2.2 大曲微生物真菌属的分类
如图3-a所示,S组中总体丰度较高的有根霉属(Rhizopus,19.91%)、根毛霉属(Rhizomucor,19.4%)、布氏白粉菌属(Blumeria,17.57%)和散囊菌属(Eurotium,12.8%),其中根霉属(Rhizopus)的占比最高;I组中总体丰度较高的有嗜热真菌属(Thermomyces,26.04%)、散囊菌属(Eurotium,21.69%)和嗜热子囊菌属(Thermoascus,19.37%),其中嗜热真菌属(Thermomyces)的占比最高。综上可知,S组中的霉菌占比较高,霉菌分泌淀粉酶、蛋白酶、脂肪酶等实现对制曲原料中大分子物质的降解,为其他微生物的生长提供可利用的小分子营养物质[18]。嗜热真菌属(Thermomyces)在I组中的占比明显高于S组,这可能是因为浓香型大曲培曲过程中的最高品温一般在50 ℃以上,且曲心的温度普遍高于曲皮的温度,而大多数真菌的最适生长温度在20~30 ℃左右,致死温度在50~60 ℃左右;同时,温度是影响大曲微生物菌群形成的内源性动力[19];因此,部分耐热和嗜热真菌属可以在曲心中存活。
此外,酵母菌属(Saccharomyces)在S组和I组中的占比分别为0.36%和0.05%,S组中酵母菌属(Saccharomyces)的占比明显高于I组,这可能与培曲过程中曲皮与曲心的温度差异有关;同时,培曲过程中曲皮与曲心在湿度、通风及含氧等方面均存在差异,也是导致酵母菌属(Saccharomyces)占比差异的重要因素。制曲过程可以富集酿酒酵母和生香酵母等多种类型的酵母菌,在白酒发酵过程中酵母菌代谢产生醇类和酯类等风味物质,酵母类群对白酒发酵具有重要作用[20]。
如图3-b所示,对S组而言,FYS中的根霉属(Rhizopus,62.77%)占比最高,其次是YBS中的根霉属(Rhizopus,24.2%)和JNS中的根霉属(Rhizopus,21.02%),这可能与阜阳地区大曲(LZ)的培曲温度低于其他5个地区有关,其温度适宜于根霉属(Rhi-zopus)等真菌的生长。根霉属(Rhizopus)具有重要的工业应用,如米根霉(R.oryzae)代谢产生的淀粉酶可用于制曲与酿酒,华根霉(R.chinensis)和少根根霉(R.arrhizus)等可代谢产生乳酸,匐枝根霉(R.stoloni-fer)还能转化甾族化合物,也可应用于甾体激素、延胡索酸和酶制剂的生产[21]。
值得注意的是,根毛霉属(Rhizomucor)在LZS、YBS和JNS中的占比分别是55.5%、48.86%和11.78%,高于其他曲皮样品。对I组而言,LZI中的嗜热真菌属(Thermomyces,86.66%)占比最高,其次是FYI中的嗜热真菌属(Thermomyces,44.61%)和BZI中的嗜热真菌属(Thermomyces,17.38%)。曲心中嗜热真菌属(Thermomyces)占比的差异可能是由于不同产区大曲的培曲过程中曲心顶温的差异,进而对嗜热真菌属(Thermomyces)的生长产生不同影响。同样,LZS中嗜热真菌属(Thermomyces,7.86%)的占比在S组中最高;因此,可以推断泸州地区大曲(LZ)的培曲温度高于其他5个地区。夏玙等[22]采用高通量测序分析泸州某企业大曲的真菌群落结构,结果表明嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、曲霉菌属(Aspergillus)等霉菌是大曲中的优势真菌类群,这与本实验的结果相似。
此外,酵母菌属(Saccharomyces)在FYS中的占比达到17.1%,而在JNS和BZS中的占比分别为2.12%和2.01%,在其他曲皮样品中的占比均低于1.00%;同时,酵母菌属(Saccharomyces)在LQI中的占比达到1.83%,而在其他曲心样品中占比均低于1.00%。综上可知,酵母菌属(Saccharomyces)在FYS中的占比明显高于其他样品,这可能与阜阳地区的曲样(FY)采用强化制曲工艺有关,其原因还有待于进一步分析。地域环境、制曲工艺和培曲环境等是造成酿酒微生物群落结构差异的重要原因[23-24],综上可知,不同地区浓香型大曲曲皮中的优势菌属为根霉属,曲心中的优势菌属为嗜热真菌属;同时,可以推断浓香型大曲培曲温度的控制和选择对大曲真菌群落结构具有重要影响。
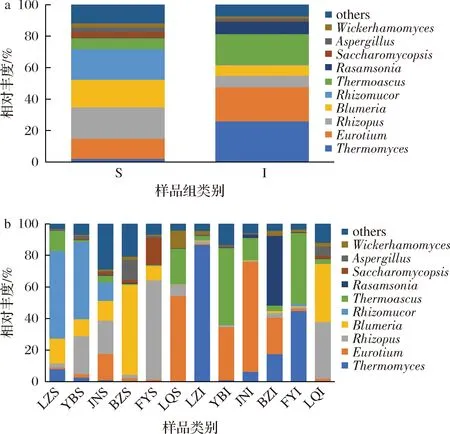
a-不同样品组;b-不同样品图3 不同大曲样品真菌属水平的相对丰度柱状图Fig.3 Column chart of relative abundance at fungal genus level in different Daqu samples
2.3 大曲质量指标分析
酒曲微生物代谢产生丰富的酶类,对白酒发酵过程的糖化和风味代谢具有重要影响[25]。大曲的水分、酸度等理化指标在一定程度上能够反映大曲的质量;同时,大曲的糖化力、酯化力等生化指标反映了大曲酶系的功能组成及微生物的生长代谢情况,也可作为大曲质量评价的重要依据。如表2所示,曲心样品的水分、酸度、还原糖和酯化力均普遍高于曲皮样品,曲皮样品的淀粉、发酵力和糖化力均普遍高于曲心样品。
糖化力反映了大曲中糖化酶的酶活力,其主要由霉菌和芽孢杆菌产生,研究表明丝状真菌能够提高大曲的糖化力[26]。由表2可知,JNS的糖化力最高[972 mg/(g·h)],可以推测JNS中丝状真菌的丰度占比可能也较高。由图3可知,JNS中的根霉属(Rhizopus)和根毛霉属(Rhizomucor)占比分别为21.02%和11.78%,其丰度占比均较高。酯化力反映了大曲中酯化酶催化酸类和醇类生成酯类物质的能力,发酵力则体现了大曲微生物发酵产酒的能力。由表2可知,BZI的发酵力和酯化力均最高,分别为0.22 U和13 mg/(g·72 h);FYS的发酵力和酯化力分别为0.21U和12 mg/(g·72 h),均处于较高水平,这可能与FYS中的酵母菌属(Saccharo-myces,17.1%)占比明显高于其他样品有关。综上可知,不同地区大曲的真菌群落组成与质量指标均存在差异。
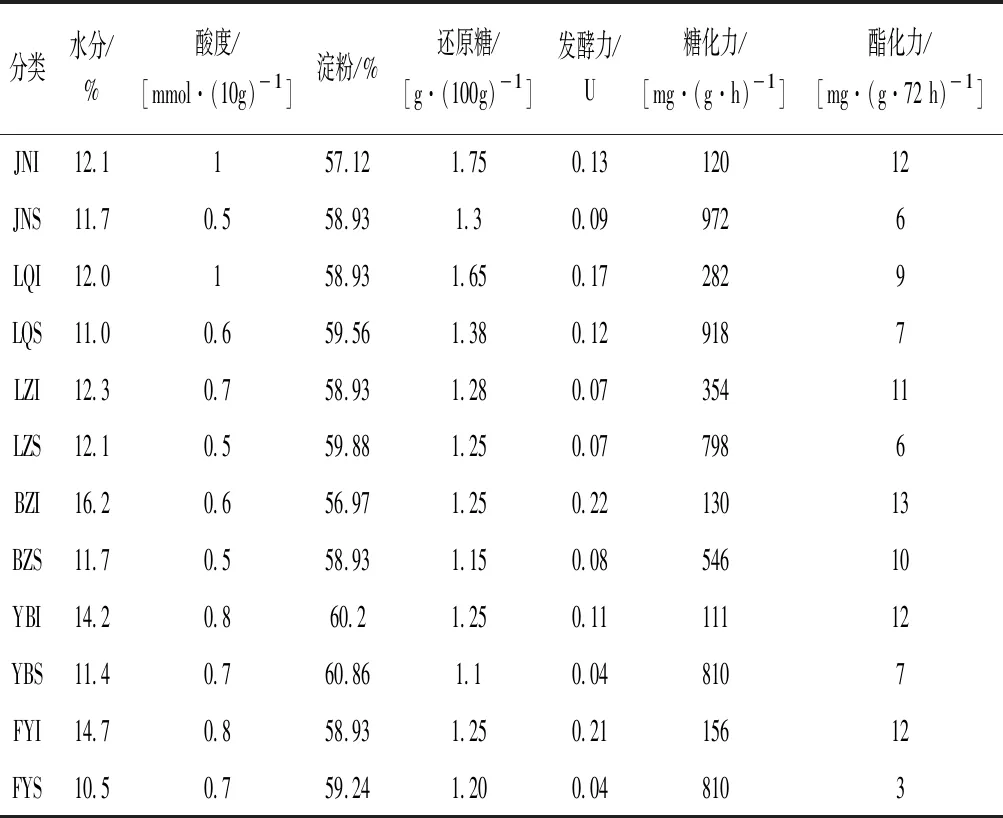
表2 不同大曲样品质量指标的检测结果Table 2 Detection results of quality indicators of different Daqu samples
2.4 大曲真菌群落结构与质量指标的关联分析
浓香型大曲培养过程中,其曲皮和曲心的微环境差异是导致微生物群落结构差异的重要原因,如曲心的温度高于曲皮可能导致嗜热菌在曲心中更具优势;同样,微生物的群落代谢也会影响环境因子,如水分、酸度、淀粉和还原糖等;同时,大曲的发酵力、糖化力和酯化力等生化指标也受到微生物群落代谢的影响。为解析大曲质量指标与真菌群落结构的关联,利用SPSS软件对曲皮与曲心的优势真菌属(相对丰度≥1%)及质量指标进行Spearman相关性分析(图4),采用Spearman秩相关研究质量指标与物种丰富度(Alpha多样性)之间的关系,得到两者之间的相关性和显著性P值[27]。
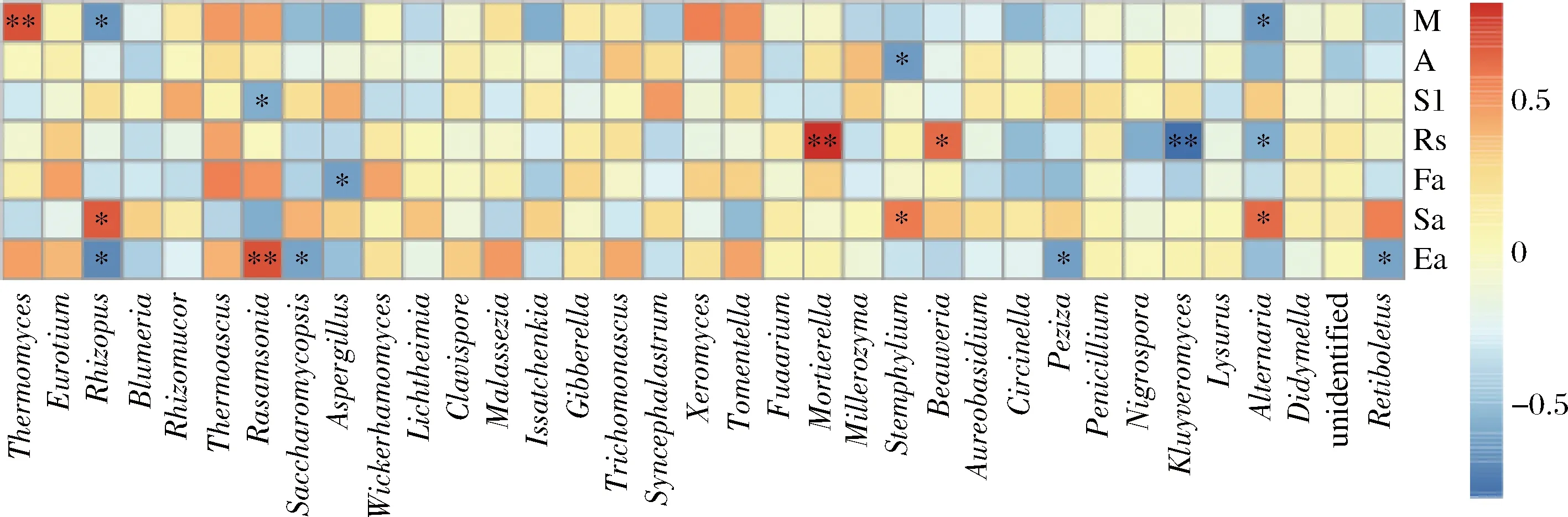
M-水分;A-酸度;S1-淀粉;Rs-还原糖;Fa-发酵力;Sa-糖化力;Ea-酯化力图4 基于属水平的大曲真菌群落结构与质量指标的Spearman相关性分析Fig.4 Spearman correlation analysis of fungal community structure and physicochemical indexes based on genus level注:纵向为环境因子信息,横向为物种信息,热图对应的值为Spearman相关系数r,-1
由图4可知,嗜热真菌属(Thermomyces)与水分呈极显著正相关,被孢霉属(Mortierella)与还原糖呈极显著正相关,根霉属(Rhizopus)、匍柄霉属(Stem-phylium)和链格孢属(Alternaria)与糖化力呈显著正相关,罗萨氏菌属(Rasamsonia)与酯化力呈极显著正相关。值得关注的是与质量指标呈负相关的真菌群落,如根霉属(Rhizopus)与水分呈显著负相关,匍柄霉属(Stemphylium)与酸度呈显著负相关,罗萨氏菌属(Rasamsonia)与淀粉呈显著负相关,克鲁维酵母属(Kluyveromyces)与还原糖呈显著负相关,曲霉属(As-peigillus)与发酵力呈显著负相关,根霉属(Rhizopus)、酵母菌属(Saccharomyces)、盘菌属(Peziza)和牛肝菌属(Retiboletus)与酯化力呈显著负相关。确定与大曲质量指标相关性显著的真菌菌属,并通过筛选纯化等技术获得单菌株,再应用于强化制曲过程中,对提高大曲质量具有重要意义,这也是未来的研究方向。
3 结论
本实验通过高通量测序解析不同地区浓香型大曲中的真菌群落结构,并采用Spearman相关性分析真菌群落结构及其与质量指标的关联,得到的结论有:(1)不同地区浓香型大曲的曲皮共有真菌OTU为43个、曲心共有真菌OTU为47个,曲皮主要真菌类群为子囊菌门(Ascomycota,52.52%),毛霉菌门(Mu- coromycota,41.60%),曲心主要真菌类群为子囊菌门(Ascomycota,87.41%);其中,曲皮中的根霉属(Rhi-zopus)、根毛霉属(Rhizomucor)、布氏白粉菌属(Blumeria)和散囊菌属(Eurotium)为优势菌属,曲心中的嗜热真菌属(Thermomyces),散囊菌属(Euroti-um)和嗜热子囊菌属(Thermoascus)为优势菌属,其丰度均在10%以上;(2)质量指标与真菌群落的Spearman相关性分析表明,嗜热真菌属(Thermomy-ces)与水分呈极显著正相关,被孢霉属(Mortierella)与还原糖呈极显著正相关,根霉属(Rhizopus)、匍柄霉属(Stemphylium)和链格孢属(Alternaria)与糖化力呈显著正相关,罗萨氏菌属(Rasamsonia)与酯化力呈极显著正相关。本研究为进一步解析浓香型大曲的糖化生香机理及筛选优良酿造功能微生物提供依据,同时对大曲微生物组信息扩充具有一定的参考价值。

