四种心脏保护药物对小鼠阿霉素诱导的心脏毒性的不同预防作用
陈怡帆,沈毅辉,程蕾蕾,林瑾仪,张 卉,汪雪君,许宇辰,张 健,葛均波
1.复旦大学附属中山医院心内科,上海 200032;2.上海市心血管病研究所,上海 200032;3.国家放射与治疗临床医学研究中心,上海 200032;4.复旦大学附属中山医院心脏超声诊断科,上海 200032;
尽管新一代靶向药物和免疫检查点抑制剂为肿瘤患者提供了更多的治疗选择,蒽环类药物仍是多种癌症治疗的基石[1]。但其心脏毒性也是临床应用中不可忽视的限制性因素,比如阿霉素(又称多柔比星)的剂量依赖性心脏毒性可能导致不可逆的扩张型心肌病和充血性心力衰竭[2-3]。阿霉素心脏毒性的分子机制涉及氧化应激、炎症和细胞凋亡等多个方面,特别是以活性氧(reactive oxygen species,ROS)损伤[4]和炎症标志物核因子κB(nuclear factor Kappa-B,NF-κB)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)升高为特征的全身炎症反应[5-6]。该二者也是阿霉素诱导的心肌细胞凋亡、进展性心肌病和心力衰竭不可或缺的因素[7-8]。
临床评估虽可发现早期蒽环类药物心脏毒性的征象,但缺乏针对性的防治方法[9]。目前唯一的心脏保护剂右雷佐生会增加继发恶性肿瘤的风险。为了满足防控心脏毒性的迫切需求,2016年ESC推荐将血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)或血管紧张素受体Ⅱ拮抗剂(angiotensin receptor Ⅱ blocker,ARB)和β受体阻滞剂用于有症状的心力衰竭或无症状的心功能不全者[10-11]。新型心脏保护药卡维地洛可阻断β1-、β2-和α1-肾上腺素能受体,能有效地抗氧化、抗炎和抗凋亡[11-12];阿托伐他汀通过调节、热激蛋白70(heat shock protein 70,HSP70)、蛋白激酶B(protein kinase B,AKT)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路,减轻阿霉素诱导的小鼠心脏毒性[13];血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)沙库巴曲缬沙坦降低心力衰竭死亡和住院风险的效果优于依那普利[14],可明显改善阿霉素诱导的扩张型心肌病的预后和心功能[15]。然而,暂无研究系统地比较过以上多种药物对阿霉素心脏毒性的疗效。因此,本研究具体对比了贝那普利、沙库巴曲缬沙坦、阿托伐他汀、卡维地洛对阿霉素诱导的心脏毒性的保护作用。
1 材料和方法
1.1 实验动物
90只成年雄性C57BL/6小鼠(8~ 10周龄,体重20~ 24 g),购自复旦大学上海实验动物中心,在特定的无病原体环境中饲养,用于阿霉素诱导的心脏毒性研究。年龄和性别匹配的 BALB/c 小鼠用于肿瘤研究。所有动物实验均按照相关指南进行,并经复旦大学附属中山医院医学伦理委员会批准。
1.2 材料与试剂
阿托伐他汀购自北京嘉林药业股份有限公司,贝那普利、沙库巴曲缬沙坦购自诺华(中国)生物医学研究有限公司,卡维地洛购自上海齐鲁制药研究中心有限公司。磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)购自美国Hyclone公司,苏木精-伊红(hematoxylineosin,H-E)和马松三色(Masson’s trichrome,Masson)染色试剂购自武汉赛维尔生物科技有限公司。蛋白酶和磷酸酶抑制剂购自美国Thermo Fisher Scientific公司,TUNEL试剂盒与Hoechst 33258购自上海碧云天生物技术有限公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)购自美国Merck公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白质测定试剂盒购自美国Thermo公司,牛血清白蛋白(bovine serum albumin,BSA)购自美国Sigma公司,洗膜缓冲液(tris-buffered saline Tween,TBST)购自生工生物工程(上海)股份有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)偶联抗体#7076S、#7074S(1∶3000)购自美国Cell Signaling Technology公司。实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自美国Applied Biosystems公司。4T1乳腺肿瘤细胞购自中国科学院典型培养物保藏委员会细胞库。
1.3 药物干预
阿霉素诱导心脏毒性研究:将C57BL/6小鼠编号并随机分为6组,每组15只,分为:生理盐水组(saline)、阿霉素组、阿霉素+阿托伐他汀组(atorvastatin)、阿霉素+贝那普利组(benazepril)、阿霉素+沙库巴曲缬沙坦组(sacubitril/valsartan)和阿霉素+卡维地洛组(carvedilol)。除生理盐水组外,小鼠腹膜内注射现配的阿霉素溶液(每周给药4 mg/ kg),共5周[16]。阿霉素溶液是将阿霉素溶解在0.9% NaCl中(浓度1 mL/kg)配成。生理盐水组每次给予与阿霉素组同等剂量的生理盐水腹腔注射。将每种心脏保护药物溶解在生理盐水中,每只分别以0.2 mL/d的现配溶液予小鼠灌胃,共6周。基于Bios配方、临床常用药物浓度和既往研究数据将本研究中阿托伐他汀、贝那普利、沙库巴曲缬沙坦和卡维地洛的每日灌胃剂量分别定为10、10和60 mg/kg(沙库巴曲28.8 mg/kg,缬沙坦31.2 mg/kg)和5 mg/kg[13,17-20]。第6周末处死小鼠取心脏标本(图1A)。
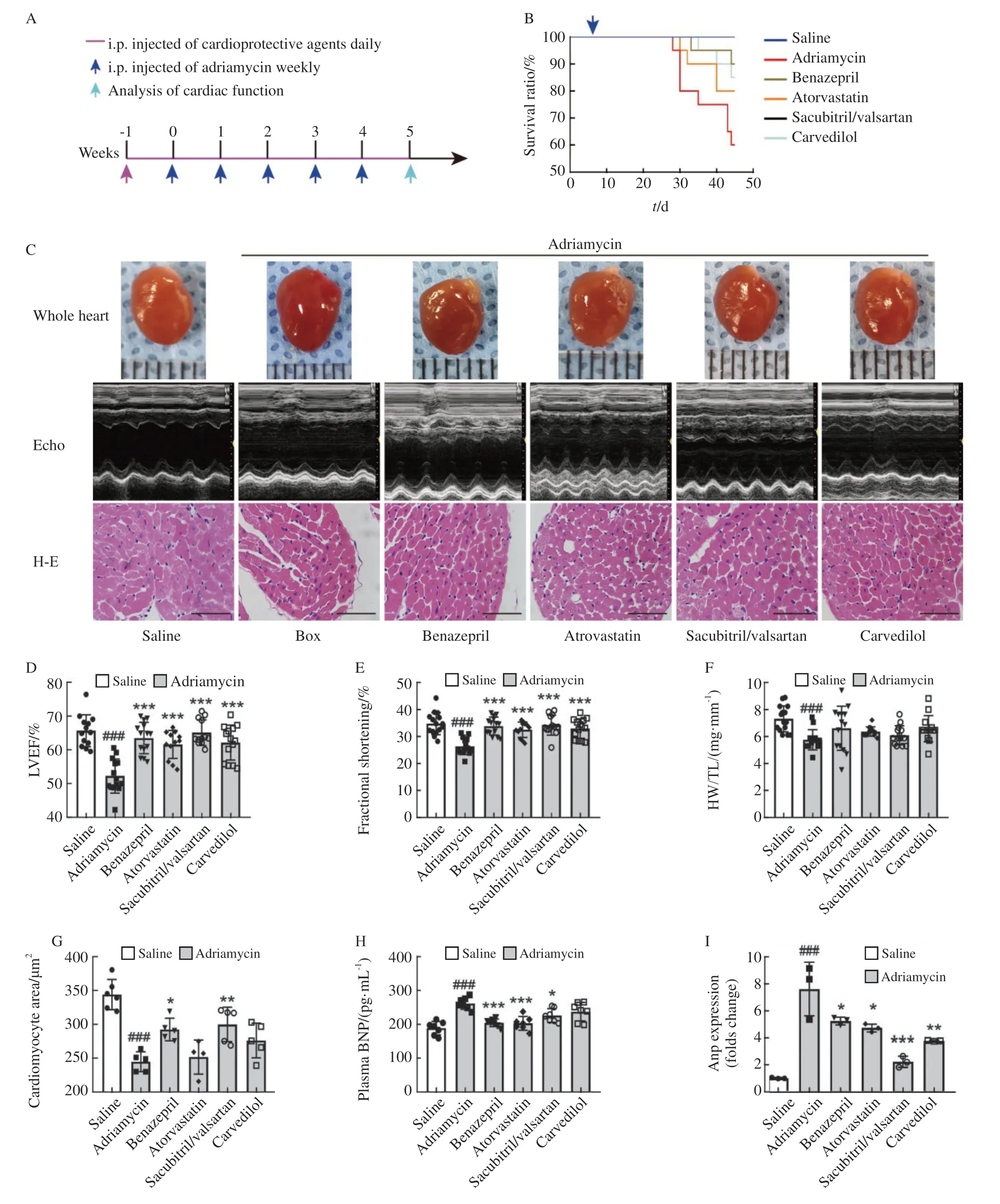
图1 4种药物对心脏形态、组织学和超声心动图的影响Fig.1 Effects of 4 agents on cardiac morphology,histology and echocardiography
1.4 二维超声心动图检查
在基线和第6周时用Vevo2100超声系统(购自加拿大VisualSonics公司)行二维超声心动图检查,30 MHz高频扫描探头采集图像。小鼠吸入异氟烷麻醉后平卧,胸前区备皮。在胸骨旁左心室长轴切面左心室内径最大处显示M型图像,分析心率(heart rate,HR)、左心室射血分数(left ventricular ejection fraction,LVEF)、心排血量(cardiac output,CO)、缩短分数(fractional shortening,FS)、左心室舒张末期尺寸(left ventricular end-diastolic dimension,LVEDD)和左心室收缩末期尺寸(left ventricular end-systolic dimension,LVESD)[21]。所有测量结果均取连续3个心动周期的平均值。
1.5 病理学检查
处死小鼠后用PBS心脏灌流,分离称重,再用4%的多聚甲醛固定24 h后石蜡包埋,然后制成厚5 μm的水平切片。采用H-E染色和Masson染色以分析心肌细胞肥大和纤维化。心脏的5个部分分别随机选取5张高分辨率图像,对H-E和Masson染色进行形态计量分析,计算心肌细胞的横截面积(cross-sectional area,CSA)和心脏纤维化面积。显微镜下观察标本;通过自动图像分析系统(Image-Pro Plus 5.0)测量图像。
1.6 蛋白质印迹法(Western blot)检测
采用Western blot检测细胞凋亡和Bcl-2及Bax蛋白的表达水平。裂解缓冲液中加入蛋白酶和磷酸酶抑制剂并预冷至4 ℃,加入左心室组织匀浆。用BCA蛋白质测定试剂盒进行蛋白质浓度定量。将蛋白质(30 μg/泳道)加到SDS-PAGE上电泳,后转移到PVDF膜上。用5%BSA室温封闭2 h,一抗4 ℃温育过夜后,以TBST洗涤,再将膜与HRP偶联抗体#7076S、# 7074S(1∶3000)室温温育1 h。使用#WBKLS0500 ECL Western blot检测系统曝光。用Image J量化分析条带。
1.7 RTFQ-PCR
使用RNAiso Plus#9109提取细胞或心脏组织的mRNA,并以PrimeScript™ 反转录试剂盒#RR036A反转录1 μg RNA使之成为cDNA。在ABI 7300检测系统中用SYBR Green PCR检测系统进行RTFQ-PCR。每20 µL RTFQ-PCR反应混合物包含:10 µL qPCR SYBR Green Master Mix、0.4 µL引物顺义链、0.4 µL引物反义链、1 µL cDNA模板和1 µL无菌去离子水。RTFQ-PCR反应循环条件为:95 ℃预变性30 s,之后95 ℃10 s、60 ℃ 30 s循环40次。
1.8 TUNEL标记的细胞凋亡分析
用TUNEL试剂盒,将石蜡包埋的载玻片与50 μL含有脱氧核糖核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)和生物素化的dUTP的混合物在37 ℃下反应1 h。用PBS洗涤3次,将Hoechst 33258滴加到载玻片上,室温温育5 min。荧光显微镜计算凋亡细胞数。
1.9 肿瘤研究
将BALB/c小鼠编号并随机分为5组,每组10只:生理盐水组、阿霉素+阿托伐他汀组、阿霉素+贝那普利组、阿霉素+沙库巴曲缬沙坦组和阿霉素+卡维地洛组。先予生理盐水或心脏保护药物灌胃1周,再于腋下皮下注射1×1054T1小鼠乳腺肿瘤细胞。细胞注射1周后,每周测量一次肿瘤大小,共4周。用以下公式计算肿瘤体积:V=4π/3×(L/2)×(W/2)×(H/2),其中V、L、W和H代表肿瘤的体积、长度、宽度和高度。4周时处死小鼠,称量肿瘤重量。
1.10 统计学处理
使用Prism 5.0(GraphPad Software)软件进行统计分析。所有数据均表示为。两组间分析采用Student’st检验,多组间分析采用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 对阿霉素诱导的左心室功能障碍的影响
分别使用4种心脏保护药物均可降低阿霉素引起的小鼠死亡率。沙库巴曲缬沙坦组和贝那普利组降低死亡率的作用最显著(图1B)。阿霉素给药5周后观察到小鼠心脏轻微扩大,4种药物均可在6周的治疗中改善心脏功能,使心脏恢复正常大小。左心室功能障碍采用心脏超声检查评估(图1C),阿霉素给药5周后LVEF显著下降,4种心脏保护药物均可改善LVEF,其中沙库巴曲缬沙坦疗效最突出(图1D)。心脏超声检查结果显示,阿霉素可致以FS减少为特点的心脏收缩功能下降,这4种药物均能有效地缓解该损伤(图1E)。LVESD在阿霉素组增加,4种药物治疗后均减少,以沙库巴曲缬沙坦组最明显(表1)。
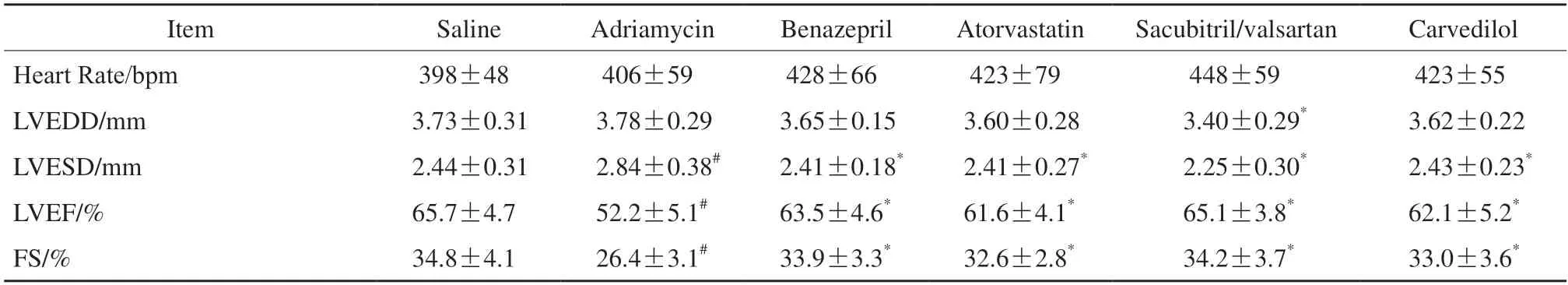
表1 阿霉素给药小鼠的左心室功能参数Tab.1 LV functional parameters in doxorubicin-treated mice
阿霉素相关心脏毒性以心脏萎缩和纤维化为关键标志。阿霉素给药5周后心脏与胫骨长度之比[心胫比(heart weight to tibia length,HW/TL)]整体下降(图1F)。贝那普利和沙库巴曲缬沙坦组改善了阿霉素诱导的单个心肌细胞横截面积(cross-sectional area,CSA)的减少情况(图1G)。阿霉素组BNP和ANP的水平皆升高,4种药物能降低血浆BNP浓度和心肌ANP mRNA水平而起保护作用(图1H、Ⅰ)。综上,4种心脏保护药物均能有效地抑制阿霉素所致的左心室功能障碍,沙库巴曲缬沙坦组对心脏收缩能力和功能的保护最强。
2.2 对阿霉素诱导的心肌纤维化的影响
纤维化是蒽环类药物相关心脏毒性的关键标志,Masson染色结果显示,贝那普利和沙库巴曲缬沙坦组显著减小阿霉素诱导的纤维化面积;阿托伐他汀和卡维地洛组也能通过降低转化生长因子β(transforming growth factor-β,TGF-β)、结缔组织生长因子(connective tissue growth factor,CTGF)、Ⅰ型胶原蛋白alpha-1(collagen type Ⅰ alpha-1,Col1α1)和 Ⅲ 型胶原蛋白alpha-1(collagen type Ⅲ alpha-1,Col3α1)等促纤维化基因的表达(图2C~ F)来有效减少阿霉素导致的心肌胶原沉积(图2A、B)。总之,4种心脏保护药物皆可改善阿霉素诱导的心肌损伤和纤维化。
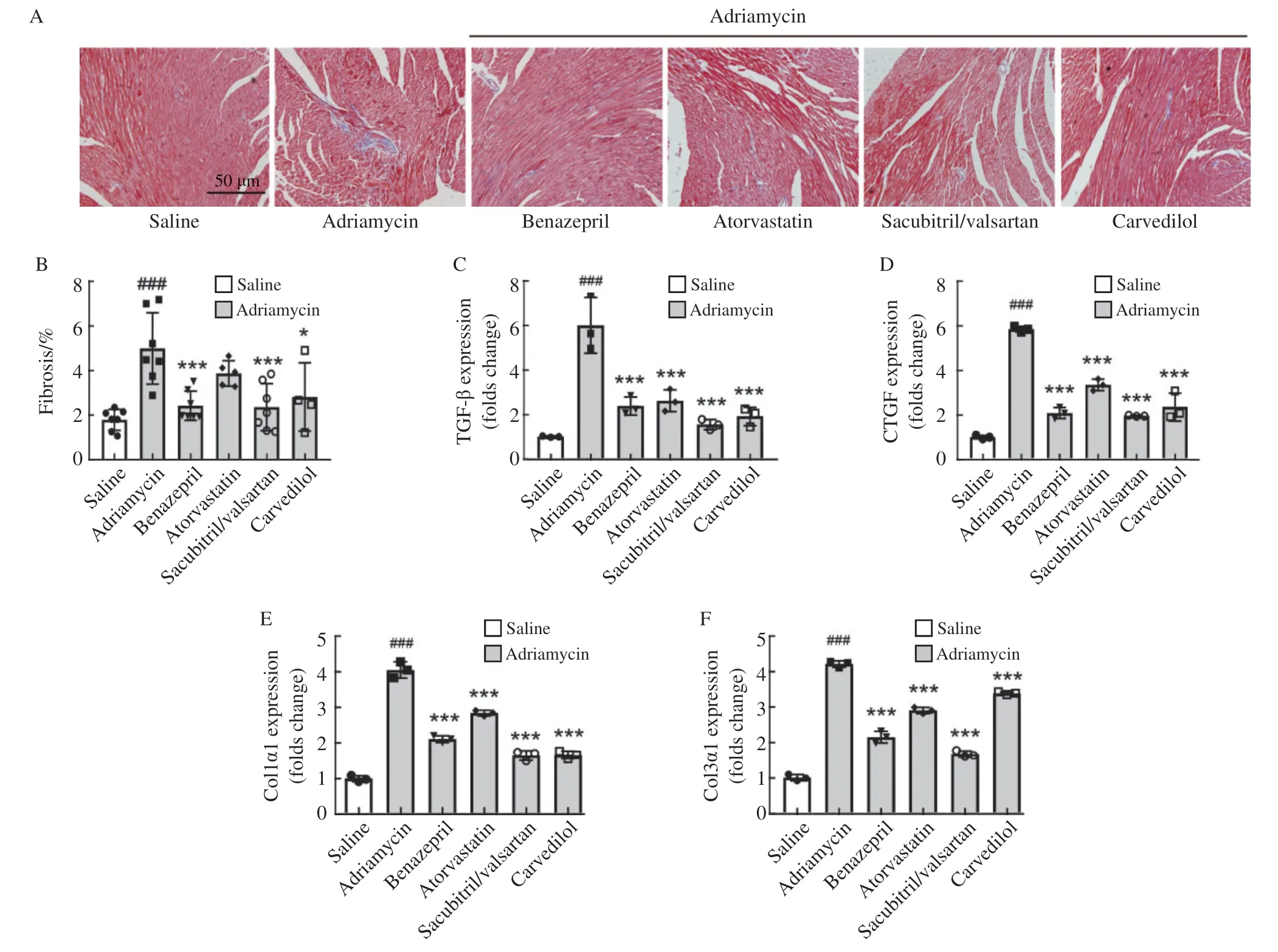
图2 4种药物对心脏纤维化的影响Fig.2 Effects of four agents on myocardial fibrosis
2.3 对阿霉素诱导的心肌细胞凋亡的影响
心肌细胞凋亡是阿霉素诱导进展性心功能障碍的重要过程。4种心脏保护药物能显著缓解阿霉素导致的细胞凋亡(图3A~E)。Western blot检测结果显示,阿霉素显著上调了促进心肌细胞凋亡的Bax表达水平,下调了抑制心肌细胞凋亡的Bcl-2表达水平,而保护药物均可下调Bax表达水平,其中贝那普利和沙库巴曲缬沙坦组下调Bax表达水平的效果优于阿托伐他汀和卡维地洛(图3C、D);沙库巴曲缬沙坦组和卡维地洛组较为明显地上调了Bcl-2的表达水平(图3E);沙库巴曲缬沙坦组显著下调了Bax/Bcl-2的比例(图3F),进一步佐证TUNEL检测中该药物对凋亡最明显的抑制作用。
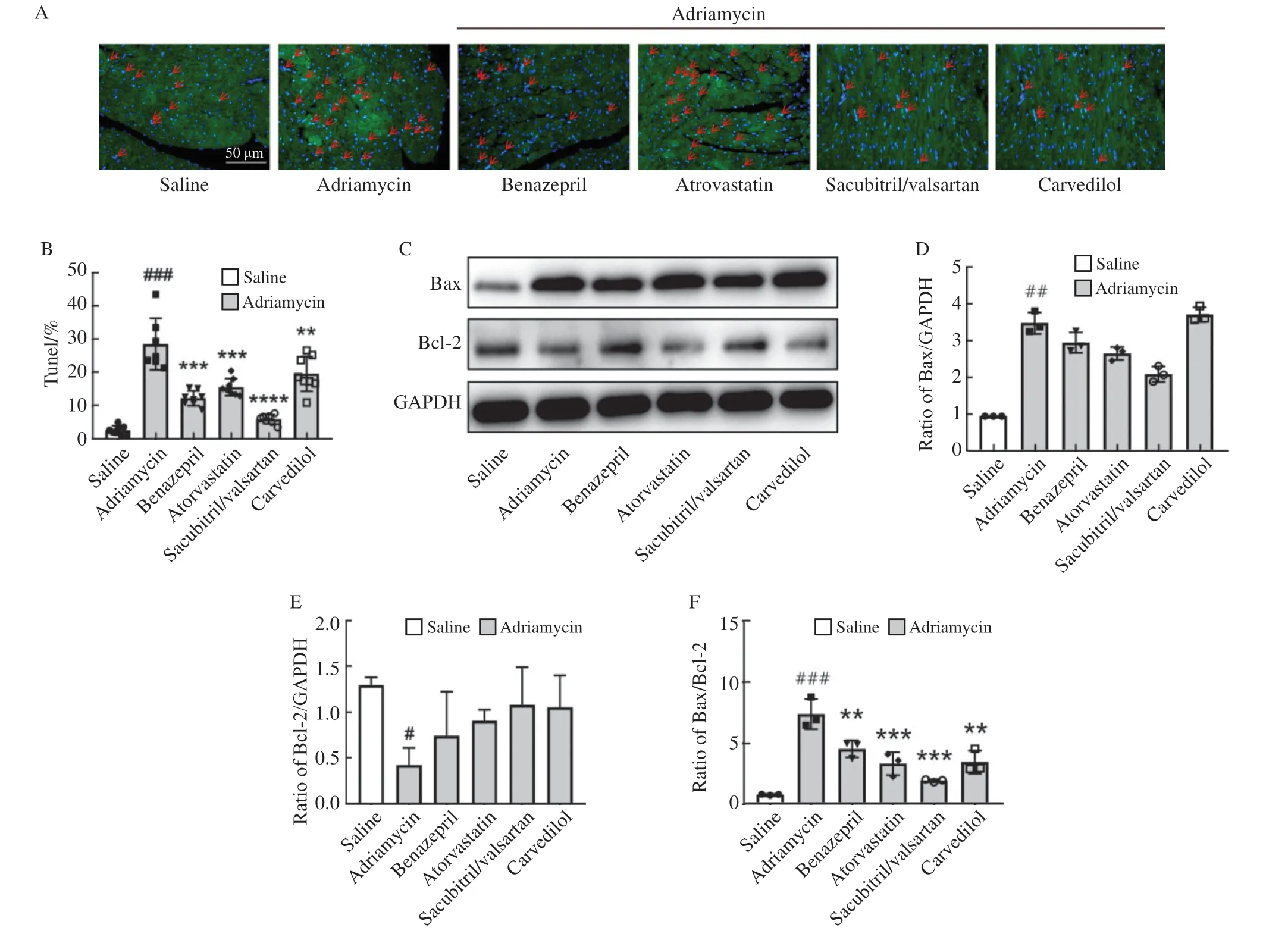
图3 4种药物逆转阿霉素诱导的心肌细胞凋亡Fig.3 Four agents attenuated adriamycin-induced cardiomyocyte apoptosis
2.4 对阿霉素诱导的心肌细胞炎症的影响
TNF-α、IL-1β、IL-6等都是经典的促炎细胞因子。阿霉素显著增加了TNF-α、IL-1β和IL-6的mRNA水平,且在小鼠心脏中被4种保护药物抑制(图4)。
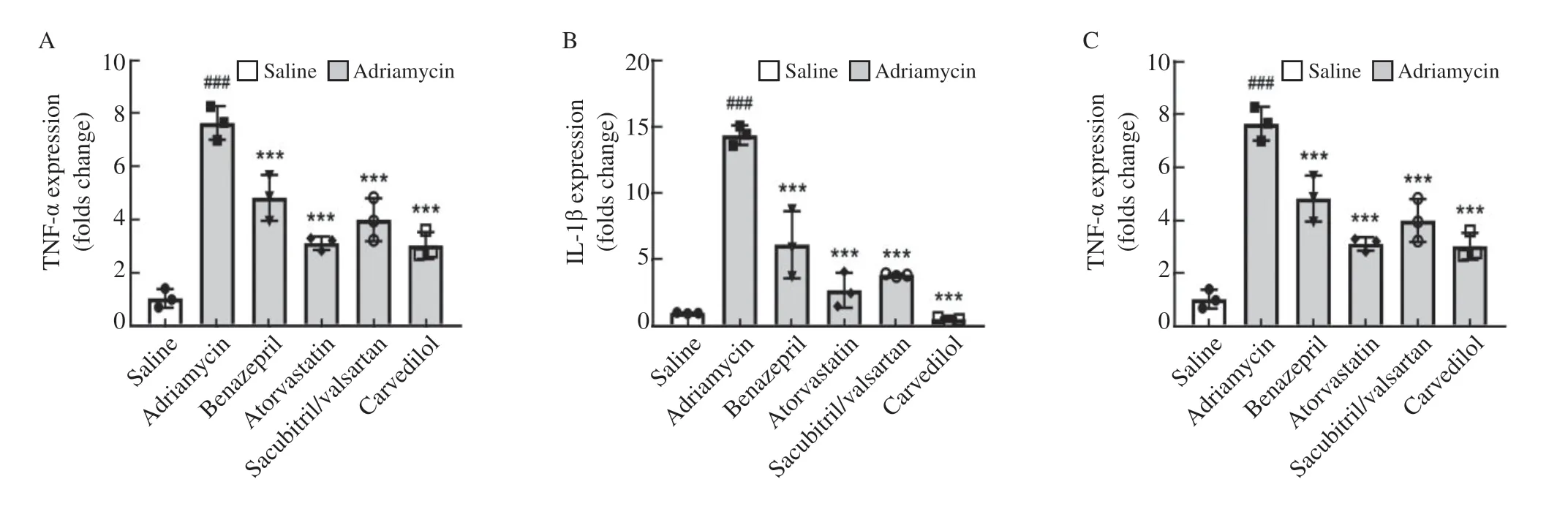
图4 4种药物逆转阿霉素诱导的心肌细胞炎症Fig.4 Four agents attenuated adriamycin-induced cardiomyocyte inflammation
2.5 对体内肿瘤生长的影响
心脏保护药物的癌症风险一直是争议的热点,在BALB/c小鼠的4T1细胞移植瘤模型中研究了使用这些药物后肿瘤的生长情况。随访28 d,其间平均肿瘤体积在生理盐水组和各用药组间差异无统计学意义(图5),提示这4种药物在短期治疗中未造成促进肿瘤增殖等不良反应。
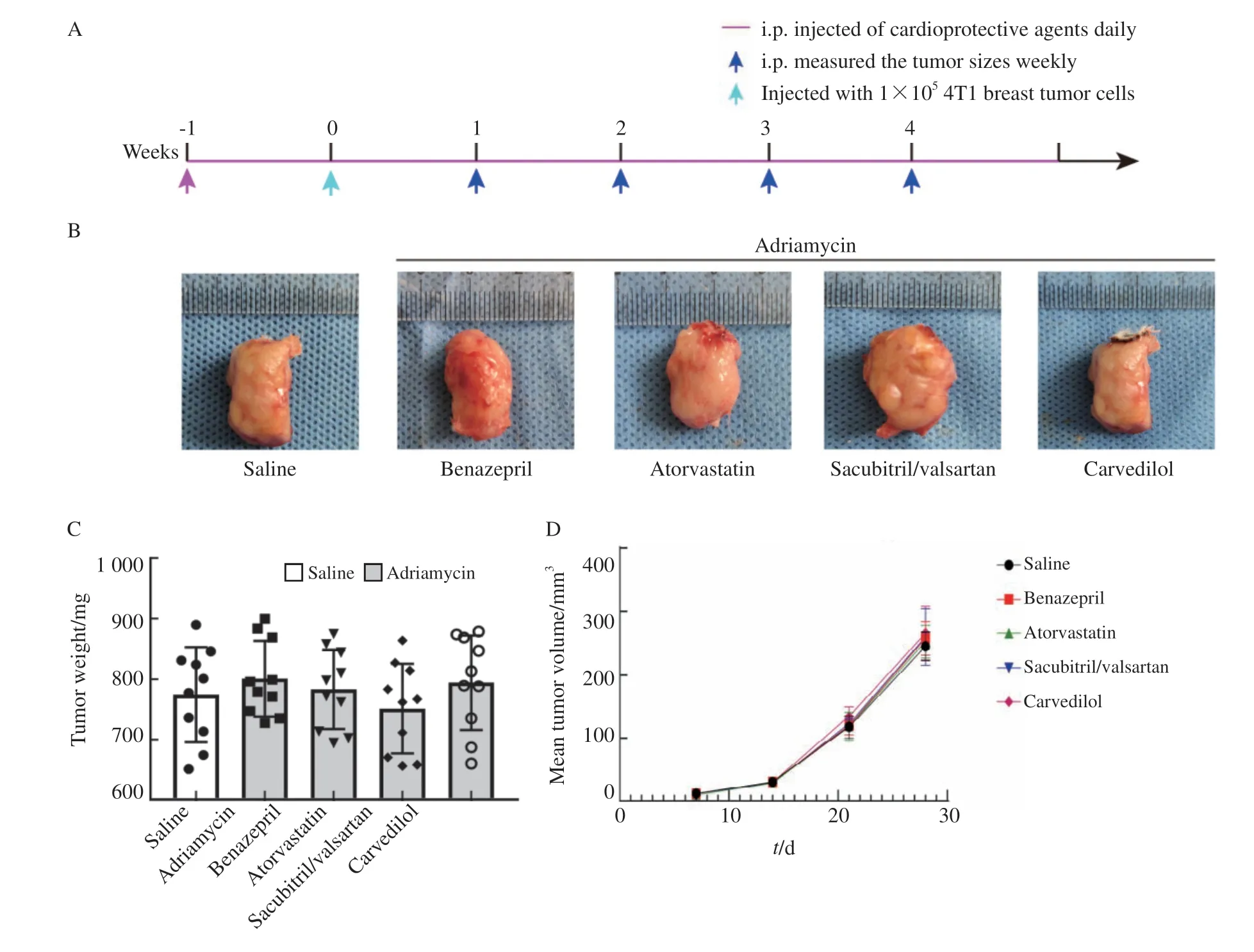
图5 4种药物均不促进肿瘤生长Fig.5 Four agents did not promote the tumor growth
3 讨 论
蒽环类药物引起的心脏毒性会导致不可逆的扩张型心肌病和充血性心力衰竭,但这些药物作为癌症治疗的基石仍然不可或缺[1]。其唯一的心脏保护剂右雷佐生可清除活性氧基团(reactive oxygen species,ROS)铁螯合物,却增加了发生继发性恶性肿瘤的风险[22],且不便与阿霉素同时静脉滴注。
我们迫切需要探究防控蒽环类药物相关心脏毒性的针对性药物。尽管心脏毒性已被证实与ROS、炎症和细胞凋亡等潜在机制相关,但其分子细节仍未明确。本研究评估了包括阿托伐他汀、贝那普利、沙库巴曲缬沙坦和卡维地洛在内4种心脏保护药物的效果。由于接受阿霉素治疗的癌症患者中心血管损害是典型的,这4种在临床实践中广泛使用的处方药可能在肿瘤心脏病学中发挥更重要的作用。
左心室功能障碍和利钠肽水平升高证实了阿霉素会引起心脏毒性[23]。本研究结果显示,与其他药物相比,血管紧张素受体脑啡肽酶抑制剂(angiotensin receptor neprilysin inhibitor,ARNI)沙库巴曲缬沙坦可显著改善LVEF和FS,逆转阿霉素诱导的心肌收缩力下降[24]。利钠肽的2个最重要的异构体,arial型利钠肽(arial-type natriuretic peptide,ANP)和B型利钠肽(B-type natriuretic peptide,BNP),主要分别由心房和心室产生和分泌[25]。本实验证明,ANP和BNP水平上升则心壁应变力上升,而贝那普利和阿托伐他汀则能明显降低血浆BNP和心脏ANP的mRNA水平。沙库巴曲缬沙坦能抑制利钠肽的降解,该组ANP和BNP水平高于其他保护性药物。尽管Moertl等[26]和2016年ESC急慢性心衰诊疗指南[27]均指出,使用沙库巴曲缬沙坦后,早期循环BNP水平可能显著增加。
心脏萎缩是阿霉素相关的心脏毒性关键表型之一,由心脏大小、HW/TL和CSA的变化来体现[28],我们的研究发现贝那普利和沙库巴曲缬沙坦均可改善阿霉素相关的心脏萎缩,这也印证了既往研究[28]中二者在组织和细胞水平缓解阿霉素相关的心脏毒性的作用。ACEI贝那普利能减少血管紧张素Ⅱ的产生,沙库巴曲缬沙坦具有脑啡肽酶抑制剂和ARB的双重效应,它们从不同机制抑制肾素-血管紧张素(renin-angiotensin system,RAS)系统,并均已证实对心脏萎缩、心室重构和改善心力衰竭患者的症状和心脏功能有良好的效果[29-30]。
阿霉素导致心肌中大量胶原纤维沉积,本研究心脏病理纤维化区域的增加以及纤维化基因上调的mRNA水平有力地证实了这一点。Ho等[31]的Ⅱ期临床研究以及Rurik等[32]提出的CAR-T治疗心衰的新疗法强调了纤维化对于心衰预后的关键影响。沙库巴曲缬沙坦能有效地减缓糖尿病性心肌病和心力衰竭心脏纤维化的疾病进展,在多项研究[24,33-34]中表现出比贝那普利更多的临床获益。
有证据提示心脏毒性是心肌细胞凋亡的重要原因[35]。阿霉素通过损害包括Bcl-2家族在内的一系列调节蛋白导致细胞凋亡[36]。Bcl-2蛋白家族在调节细胞凋亡的内源性途径中起关键作用。本研究中,Bax与Bcl-2比值的显著上调和TUNEL阳性细胞数量的增加均佐证了心肌细胞凋亡的发生。4种保护药物对凋亡均有抑制作用,我们的研究发现沙库巴曲缬沙坦的作用最为显著,这与近期关于ARNI类药物心脏保护机制的结论吻合[37-38]。2021年Jia等[39]提出,他汀类药物除了基本的血脂调节能力外,也兼具一定程度的抗凋亡功效。体内外TUNEL实验均证明他汀类药物的应用可以一定程度地降低促凋亡相关蛋白的表达水平,以减少心肌细胞凋亡。
阿霉素增加NF-κB的表达,刺激其下游多种促炎细胞因子释放,诱导心脏炎症级联反应[40]。本研究中阿霉素导致TNF-α、IL-1β和IL-6显著增加,卡维地洛下调这些促炎因子的效果最佳,可有效逆转心脏的炎症表型。卡维地洛是有α受体阻滞剂特性的非选择性β受体阻滞剂,最初用于高血压治疗,近期其强有力的抗炎、抗氧化应激、逆转心肌重塑和抑制钙依赖性肿瘤增殖的作用逐步受到关注[41-43],这和我们的实验结果相近。目前卡维地洛已成为肿瘤治疗相关心脏毒性、心力衰竭和冠状动脉疾病治疗领域颇具前景的新焦点[44]。阿托伐他汀的抗氧化和抗炎效果近来也逐步受到重视,有研究[39]报道,阿托伐他汀具有一定的抑制ROS相关氧化应激和限制NLRP3、caspase-1、IL-1β、TLR4和P-p65/p65等炎症相关蛋白表达的功效,能一定程度地逆转糖尿病性心肌病的心肌损害。
几种心脏保护药的癌症风险一直备受争议。Sipahi等[45]研究表明,ARB会增加患癌风险,随后的两项meta分析却提示没有这种关联[30,43]。本研究结果显示,短期给药时ARB类药物未明显增加肿瘤的质量与体积,佐证了临床研究中短期单独使用ARB类药物不增加癌症和癌症相关死亡的相对风险的结论[30,43]。
总之,沙库巴曲缬沙坦可显著改善阿霉素诱导的左心室功能障碍、纤维化和细胞凋亡,并通过降低TNF-α、IL-1β和IL-6适度减轻炎症水平。贝那普利对改善心脏萎缩和保护心室结构的作用较为明显。阿托伐他汀同时具备中等的下调凋亡水平和促炎因子水平的效果。尽管卡维地洛在改善心脏萎缩方面没有明显益处,但与其他药物相比,它可以显著降低细胞炎症因子水平。我们的细胞和动物实验数据支持早期给予心脏保护药物对缓解阿霉素诱导的心脏毒性的潜能。但临床中不同个体患者的适当药物组合与潜在获益仍不明确,亟待在未来大规模的随机对照临床试验(randomized control trial,RCT)中进行深入探索。
本研究比较了几种常用的心脏药物对阿霉素所致心肌病的保护作用,并对其潜在机制进行了初步探索。未来深入的临床试验有助于更好地探究阿霉素心脏毒性在肿瘤患者群中的机制,协助临床单独或联合药物方案的制订,以最大程度地保护患者。
利益冲突声明:本文作者均无利益冲突。

