长链非编码RNA LINC00671对肝细胞肝癌生物学行为的影响及机制
郭 涛,宋 宁,孙玉琪,田佳琪,唐 婕,孙榕婍,蒋英英,
1.潍坊医学院基础医学院病理生理学教研室,山东 潍坊 261053;2.潍坊医学院口腔医学院,山东 潍坊 261053;3.潍坊医学院临床医学院,山东 潍坊 261053;4.潍坊医学院附属医院口腔科,山东 潍坊 261035
肝细胞肝癌(hepatocellular carcinoma,HCC)是全球常见的肿瘤,也是主要的致死性肿瘤之一[1]。随着临床诊疗技术水平的不断提高,HCC的治疗和管理取得了显著进展,但其高复发率和低生存率的现状依然如故,且新增病例仍呈上升趋势[2]。对于HCC的病因,目前已知其与多种因素有关,包括乙肝病毒(hepatitis B virus,HBV)感染、非乙醇性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)、酗酒等引起的肝纤维化以及吸烟、黄曲霉素接触等饮食环境因素[3]。
另一方面,随着基础医学研究的深入,HCC进展过程中越来越多的分子失调事件被证实,从蛋白到核酸再到小分子化合物。这些物质的失调往往与HCC的发生、发展存在密不可分的关系,有些甚至直接参与HCC发生、发展的始终[4]。近年来,长链非编码RNA(long noncoding RNA,lncRNA)与肿瘤的关系逐渐成为新的研究热点。LncRNA是指长度大于200个核苷酸的链状RNA分子,其由基因组转录产生,但并不具备蛋白翻译潜能[5]。在HCC中,人们已经发现多种lncRNA失调表达并行使多种分子功能来调控HCC的发生、发展[6]。其作用涉及基因生命周期的各个方面,包括转录、剪接、RNA衰变和翻译;同时参与肿瘤细胞的增殖、迁移、侵袭、凋亡、血管生成和耐药性调节[7]。
有研究报道,作为一种功能性的lncRNA,长基因间非蛋白编码RNA 671(long intergenic non-protein coding RNA 671,LINC00671)在肿瘤中具有抑癌潜能,但其对HCC的具体影响和作用机制尚未见报道。本项目拟探讨LINC00671对HCC体外肿瘤生物学行为的影响并初步了解其作用机制,旨在为HCC患者寻找新的治疗靶点。
1 材料和方法
1.1 材料与试剂
HCC相关细胞系购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,10%的胎牛血清购自美国Gibco公司,细胞培养箱和LipofectamineTM2000购自美国ThermoFisher公司,反义寡核苷酸(antisense oligonucleotide,ASO)、过表达质粒及LINC00671探针均购自广州市锐博生物科技有限公司,碘化丙啶购自国药(上海)国际医药卫生有限公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜和transwell小室购自美国Millipore公司,ECM550基质胶购自美国Chemicon公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本Dojindo公司。
所有细胞均采用高糖DMEM加10%的胎牛血清组成的完全培养基,置于37 ℃、CO2体积分数为5%的培养箱中培养。细胞转染试剂采用无血清DMEM混合LipofectamineTM2000进行ASO及LINC00671过表达质粒转染。
1.2 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
使用TRIzol试剂(美国ThermoFisher公司)进行细胞总RNA分离提取,并用反转录试剂盒[宝生物工程(大连)有限公司]在体外进行R N A 反转录反应将R N A 反转录成cDNA。PCR反应采用2 μL反应模板的20 μL反应体系,预变性参数:95 ℃、5 min;循环参数:94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,并进行35个循环。整个反应在Bio-rad 3.0 PCR仪上进行,引物如下:LINC00671上游引物5'-CCTGGGCTTCCTGCTGAGAC-3',LINC00671下游引物5'-CGTCCACACCTCTG CTCCTTC -3 ';c-myc上游引物5'-CAAGAGGCGAACACACAACGTCT-3',c-myc下游引物5'-AACTGTTCTCGTCGTTT CCGCAA-3';选择GAPDH为内参,其上游引物5'-GGTATCGTGGAAGGACTCAT-3',下游引物为5'-CCTTGCCCACAGCCTTG-3';实验结果取2-ΔΔCT进行比较。
1.3 蛋白质印迹法(Western blot)检测
将提取的细胞总蛋白加入蛋白缓冲液(美国Sigma-Aldrich公司),95 ℃变性10 min。蛋白样品用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离,并转移到PVDF膜上。加入4 ℃一抗(c-myc、GAPDH为1∶2000,武汉三鹰生物技术有限公司)温育过夜,加入对应二抗(1∶2000,武汉三鹰生物技术有限公司)。暗室中用ECL发光液(美国MedChemExpress公司)显影条带并压片曝光。
1.4 RNA荧光原位杂交(fluorescence in situ hybridization,FISH)
细胞在预杂交缓冲液处理后,杂交缓冲液中稀释LINC00671探针混合,并在37 ℃下培养温育过夜。DNA在密封前用DAPI染色10 min。在相同的光学强度条件下,用激光共聚焦成像系统(日本Olympus公司)观察LINC00671亚细胞定位。
1.5 细胞增殖实验
采用CCK-8转染细胞并接种在24孔板中,每孔2×104~5×104个细胞,常规环境中培养,在0、24、48和72 h于450 nm波长的D值下评估细胞增殖情况。实验重复3次。
1.6 细胞凋亡实验
对于凋亡实验,选择流式细胞术分析进行定量比较。细胞进行转染处理后,利用膜联蛋白Ⅴ和碘化丙啶对培养物进行30 min的双重染色。收集培养物,并通过配备CellQuest 3.3计算机程序的流式细胞仪检查细胞凋亡情况,凋亡率以早期凋亡加晚期凋亡计算。
1.7 细胞划痕实验
细胞转染处理后,通过在培养板(1×106)中使用100 μL塑料移液管尖端进行垂直划痕。划痕后,继续培养24 h,观察划痕大小并在光学显微镜下拍照。以(0~24 h)/0 h为愈合百分比定量,测量虚线区域之间的细胞垂直迁移宽度比来评估肿瘤细胞迁移情况。
1.8 细胞侵袭实验
将转染处理后的细胞接种于带有8 μm孔径聚碳酸酯过滤器的transwell小室内,并在此之前于底部铺上ECM550基质胶。将装有无血清培养基的小室置于含完全培养基的24孔板中培养24 h后,取出小室,细胞固定并染色拍照。
1.9 在线生物信息学分析系统
LINC00671在HCC及正常肝组织中的表达、预后及相关性分析在GEPIA(Gene Expression Profiling Interactive Analysis;http://gepia2.cancerpku.cn/#index)及starBase 3.0(Encyclopedia of RNA Interactomes,ENCORI;https://starbase.sysu.edu.cn/)数据库中进行[8-10];LINC00671的亚细胞定位通过lncAtlas网站(https://lncatlas.crg.eu/)进行预测[11];此外,LINC00671下游Hoogsteen碱基配对DNA则通过LongTarget网站(http://lncrna.smu.edu.cn/show/DNATriplex)进行[12];同时通过UCSC网站(http://genome.ucsc.edu/)调取并查询下游基因c-myc启动子序列信息[13]。
1.10 甲基化DNA免疫共沉淀PCR(methylated DNA immunoprecipitation-PCR,MeDIPPCR)
将细胞转染处理后,提取基因组DNA,超声碎裂至0.3-1.0 kb长度。使用5-甲基胞嘧啶抗体(比利时Eurogentec公司)进行甲基化沉淀,并在VⅡA 7 real-time PCR系统(美国Applied Biosystems公司)分析纯化的DNA。对应启动子甲基化的变化可通过测量免疫沉淀DNA的数量,其PCR所需的c-myc上游引物为5'-CCCATATTCTCCCGTCTAGCAC-3',下游引物为5'-CCAATTTCTCAGCCAGGTTTCA-3';将该值与总input DNA的数量(MeDIP/input)进行比较来确定。
1.11 统计学处理
采用SPSS 22.0统计软件进行数据分析,计数资料采用表示。采用t检验分析各组之间的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 组织及细胞间LINC00671表达差异及亚细胞定位
我们利用GEPIA数据库分析了LINC00671在HCC组织中的表达情况,结果显示,与正常肝组织相比,LINC00671在HCC组织中的表达显著下调(图1A)。随后我们在starBase数据库中分析了LINC00671对生存预后的影响,我们发现LINC00671高表达可能预示着较好的预后(P<0.05,图1B)。而在体外细胞系中,我们对比了正常肝细胞L02细胞系与HCC细胞系中LINC00671的表达差异。RTFQ-PCR检测发现LINC00671在HCC细胞系中显著下调,同时在不同的HCC细胞系中,LINC00671表达水平存在差异。其在Huh7细胞中表达相对较高,而在HepG2细胞中表达水平较低(图1C)。随后通过lncAtlas数据库在线预测发现LINC00671主要分布于细胞核内(图1D)。为了进一步证实这一预测,我们通过RNA FISH实验对LINC00671亚细胞定位进行了分析,结果提示LINC00671确实主要集中于细胞核中(图1E)。

图1 LINC00671在HCC组织及细胞系中的表达和亚细胞定位Fig.1 Expression and subcellular localization of LINC00671 in HCC tissues and hepatoma cell lines
2.2 LINC00671可以抑制HCC细胞增殖并促进凋亡
以上结果证实了LINC00671在Huh7细胞中表达较高而在HepG2细胞中表达水平较低,由此我们选取Huh7细胞系进行敲减实验并选取HepG2细胞进行过表达实验。我们首先在体外对Huh7进行了ASO转染,RTFQ-PCR结果发现ASO对LINC00671敲低效果较好(图2A)。同时,在HepG2细胞中转染LINC00671过表达质粒后,RTFQ-PCR结果提示过表达效果明显(图2A)。在此基础上,我们分别观察了Huh7和HepG2细胞的增殖情况,结果证实当LINC00671敲低后,Huh7细胞增殖增加(图2B);而LINC00671过表达后,HepG2细胞增殖明显受到抑制(图2C)。此外,流式细胞式术实验结果显示,LINC00671被敲低后,Huh7细胞凋亡显著减少(图2D);而在HepG2细胞中过表达LINC00671后,其凋亡率显著增加(图2E)。

图2 LINC00671能够影响HCC增殖和凋亡Fig.2 The regulation of LINC00671 on proliferation and apoptosis in hepatoma cells
2.3 LINC00671抑制HCC迁移和侵袭
为了进一步验证LINC00671对HCC迁移和侵袭的影响,我们在Huh7细胞中转染了ASO并在HepG2细胞中过表达了LINC00671,随后进行细胞划痕及transwell实验观察细胞迁移和侵袭能力的变化。结果显示,LINC00671敲低后,Huh7细胞的迁移能力明显增强(图3A);而LINC00671表达增加后,HepG2细胞迁移能力明显受到抑制(图3B)。此外,LINC00671敲降后,Huh7细胞侵袭能力明显增加(图3C);而过表达LINC00671后,其可以明显抑制HepG2细胞侵袭(图3D)。
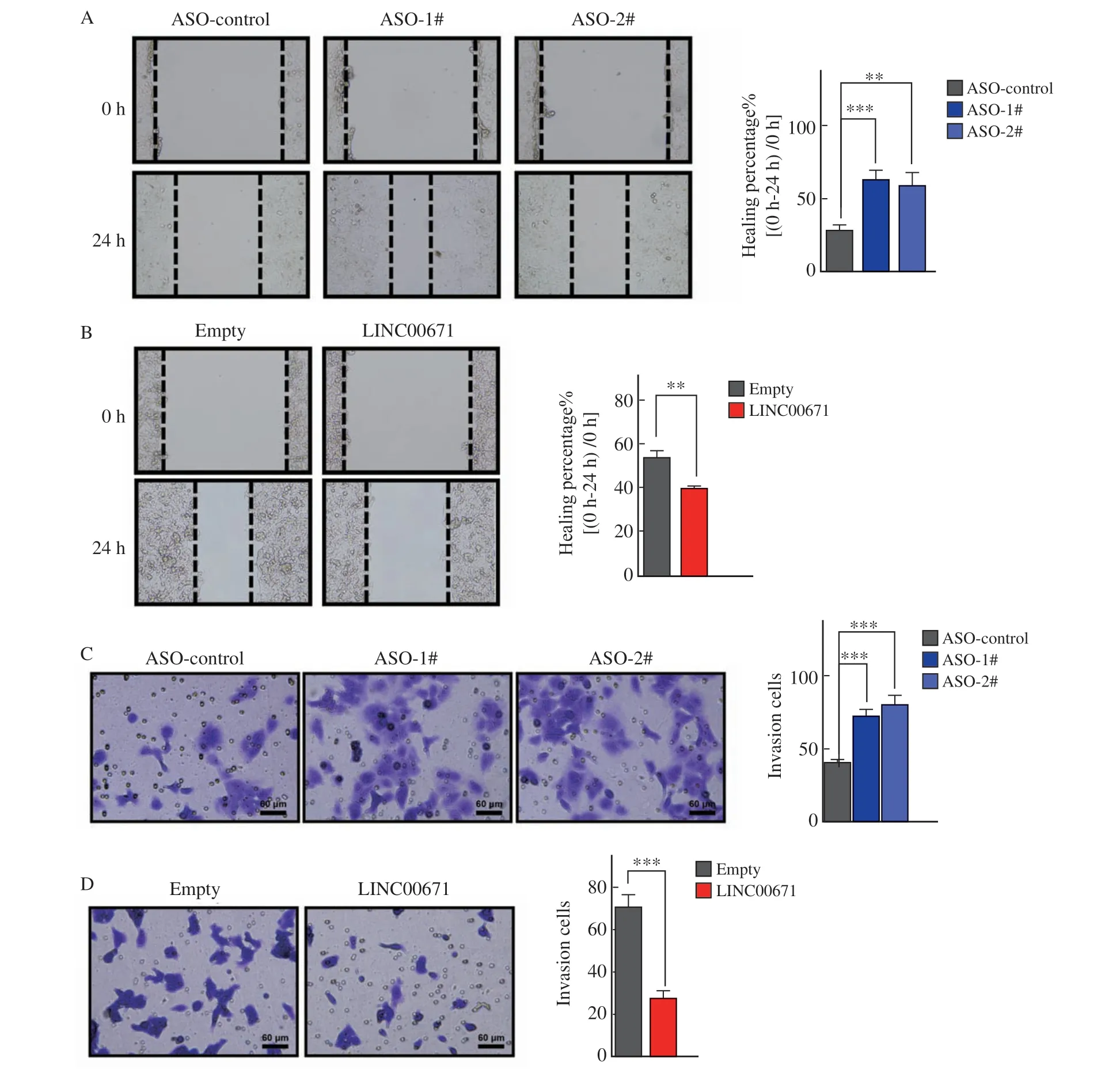
图3 LINC00671抑制HCC迁移和侵袭Fig.3 LINC00671 inhibits migration and invasion of hepatoma cells
2.4 LINC00671可以通过介导启动子甲基化下调c-myc表达
通过生物信息学预测,我们发现LINC00671与癌基因c-myc启动子区可能存在Hoogsteen配对结合(图4A)。这一结果提示c-myc可能是LINC00671的下游靶基因。我们随后在以上数据库中分析了LINC00671与c-myc表达的相关性,Spearman分析提示LINC00671与c-myc在HCC组织中的表达呈现显著负相关(图4B~4C)。这一结果提示c-myc可能是LINC00671的靶基因且可能被LINC00671负向调控。为了明确c-myc是否是LINC00671下游靶基因,我们在Huh7细胞中敲低了LINC00671并在HepG2细胞中过表达了LINC00671。随后通过RTFQ-PCR及Western blot检测发现LINC00671确实可以下调c-myc的表达(图4D~4E)。已有研究[14-15]指出,核内lncRNA可以介导下游靶基因启动子区甲基化修饰从而调控靶基因的表达。因此,我们用同样的方法转染上述细胞后,利用MeDIP-PCR检测了c-myc启动子区甲基化水平变化。结果提示LINC00671可以显著升高c-myc启动子甲基化水平(图4F)。由此可见,LINC00671可能在细胞核内通过介导c-myc启动子甲基化抑制c-myc表达,从而抑制了HCC的生物学行为。
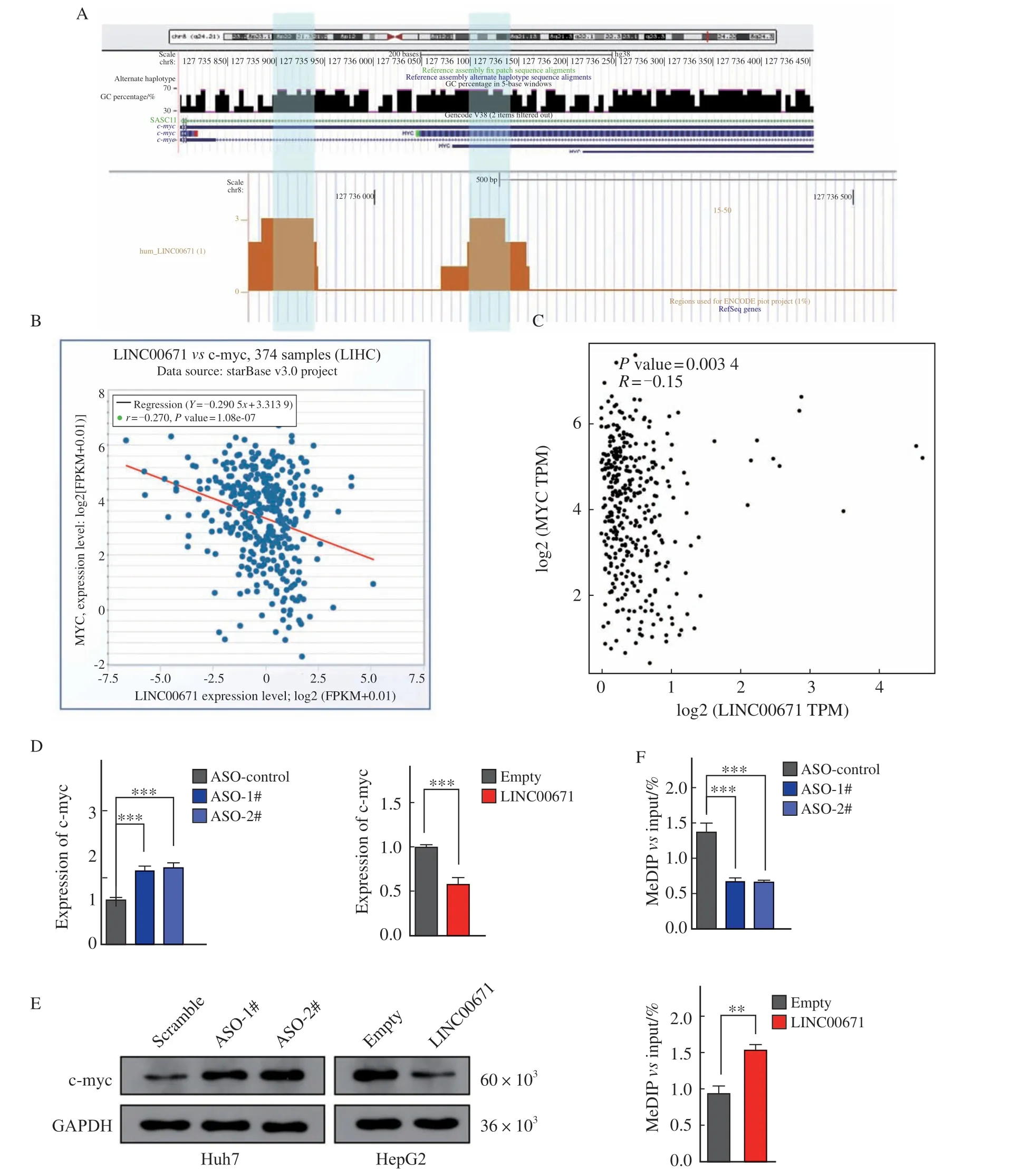
图4 LINC00671对c-myc的调控Fig.4 The regualtion of LINC00671 on c-myc
3 讨 论
随着测序技术的进步和研究的逐渐深入,越来越多的lncRNA分子被证明在肿瘤发生、发展中扮演着重要角色。虽然目前有关lncRNA的文章越来越多,但仍有许多lncRNA的生物功能未知,并且同一lncRNA在不同肿瘤中的作用和机制可能也不尽相同。因此对于这类分子的研究将为未来肿瘤的分子诊断和分子治疗提供理论证据。
LINC00671定位于人体第17号染色体,目前已知仅有一个转录本,成熟体由1844个核苷酸组成。当前对于LINC00671的报道并不多,在胰腺癌中,LINC00671被证明可能作为临床分子标志与胰腺癌患者预后相关[16]。在本研究中,我们同样发现GEPIA数据库提示LINC00671在HCC组织中出现下调,并且starBase数据库发现其可能与HCC患者预后生存有关,即LINC00671高表达可能预示着较好的预后。机制上,其被证明能够通过发挥内源竞争性RNA(competing endogenous RNA,ceRNA)作用吸附miRNA分子从而通过多个信号转导通路抑制胰腺癌进展[17-18]。在甲状腺癌中,LINC00671受到转录因子STAT3的调控,同时通过抑制糖酵解抑制甲状腺癌进展[19]。近期还有研究[20]报道了LINC00671在肾癌中同样通过ceRNA作用抑制了肾癌的进展。以上几项研究虽然从不同癌种揭示了LINC00671的作用,但仅有一项研究进行了LINC00671的亚细胞定位验证[19]。本研究证明了LINC00671可以显著抑制HCC的生物学行为,这与先前的几篇报道一致。不同于其他肿瘤,LINC00671在HCC中虽然也发挥抑癌效应,但其主要定位于细胞核内。因此,其可能有着与之前完全不同的分子机制。
通过生物信息学预测,我们发现LINC00671可能与癌基因c-myc启动子区存在Hoogsteen配对从而介导后者启动子甲基化修饰,这提示c-myc可能是LINC00671的靶基因。而数据库分析同样发现LINC00671与c-myc在HCC组织中的表达呈显著负相关。进一步实验也证实:LINC00671可以通过介导c-myc启动子甲基化从而下调后者表达。C-myc基因(又称MYC)是一个公认的癌基因,其在不同肿瘤中均可扮演促癌基因的角色。从调控靶基因转录到影响染色体稳定性[21],c-myc几乎在所有肿瘤中均存在促癌作用而被称为肿瘤的主宰基因之一[22]。在HCC中,c-myc同样可以在肿瘤细胞生长、增殖、迁移及侵袭等多方面影响HCC的生物学行为[23]。而本研究发现LINC00671可以在细胞核内介导c-myc启动子甲基化从而下调c-myc基因的表达,而这直接导致了LINC00671抑制HCC的生物学行为,即LINC00671抑制HCC进展的分子机制。
本研究揭示了LINC00671在HCC中发挥的作用,初步探讨了其抑制HCC进展的分子机制。此外,本研究发现LINC00671在肿瘤中可以发挥核RNA的作用并可能通过介导启动子甲基化修饰从而下调靶基因的表达。
本研究也存在部分不足之处:首先,从临床角度,虽然我们证明了LINC00671在HCC细胞系中有明显下调,但数据库纳入的样本量依旧有限并且其纳入病例可能均存在潜在偏倚。因此,关于LINC00671的临床意义仍需要大样本临床数据深入探究。其次,LINC00671对HCC的影响,包括生长与转移,仍缺乏体内动物实验的进一步验证;最后,在机制方面,我们虽然发现LINC00671可能通过调控c-myc来抑制HCC的生物学行为,但其调控的深入机制,包括具体结合位点、互作的甲基化酶及组蛋白甲基化位点均仍有待未来进一步研究。
综上所述,LINC00671可以显著影响HCC的生物学行为,即其可以在体外显著抑制HCC进展;同时,其可以介导癌基因c-myc启动子甲基化修饰从而导致后者下调表达,这可能是LINC00671抑制HCC的重要分子机制。
利益冲突声明:所有作者声明均不存在利益冲突。

