含去甲基化药物方案治疗中高危骨髓增生异常综合征/骨髓增殖性肿瘤29例疗效观察
曹蓝,江兆清,刘文洁,孙倩,李建勇,钱思轩,洪鸣
南京医科大学第一附属医院血液科,江苏 南京 210029
骨髓增生异常综合征/骨髓增殖性肿瘤(myelo⁃dysplastic/myeloproliferative neoplasms,MDS/MPN)是一组罕见的血液系统恶性肿瘤,兼具MDS和MPN的特征,通常发生于老年人,具有显著的形态学、细胞遗传学、分子学和临床异质性,以及向急性髓系白血病(acute myeloid leukemia,AML)转化的固有风险[1]。根据世界卫生组织(world health organization,WHO)2016年修订的MDS/MPN分类,本组疾病包括慢性粒单核细胞白血病(chronic myelomonocytic leukemia,CMML)、不典型慢性髓系白血病(atypical chronic myeloid leukemia,aCML)、幼年型粒单核细胞白血病(juvenile myelomonocytic leukemia,JMML)、MDS/MPN伴环形铁粒幼红细胞及血小板增多(myelodys⁃plastic/myeloproliferative neoplasms with ringedsidero⁃blasts and thrombocytosis,MDS/MPN⁃RS⁃T)及不能分型MDS/MPN(myelodysplastic/myeloproliferative neo⁃plasms⁃unclassifiable,MDS/MPN⁃U)5 个亚型[2]。目前该类疾病尚无标准治疗方案,大多数药物仅在CMML 患者中研究[3-4]。去甲基化药物(hypomethy⁃lating agent,HMA)被广泛用于CMML 患者,是目前唯一被美国食品和药物管理局(food and drug admin⁃istration,FDA)批准用于CMML 患者的药物,此外,研究报道HMA 在MDS/MPN⁃U 和aCML 患者中也表现出一定的临床疗效[5]。HMA 的主要作用是通过表观遗传机制恢复造血功能,但并不能改变疾病的自然进程,因此大多数患者最终病情复发或恶化[6]。异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo⁃HSCT)目前仍是唯一具有治愈可能的治疗手段,但患者年龄普遍偏大、合并症多、移植相关并发症发病率和死亡率以及疾病复发风险限制了其应用。最近以HMA 为基础的联合治疗方案在CMML患者中已显示出初步疗效[7-8],本研究回顾性分析含HMA方案治疗MDS/MPN患者的临床疗效及安全性。
1 对象和方法
1.1 对象
回顾性分析南京医科大学第一附属医院血液科2012年11月—2022年1月予含HMA方案治疗的29例初诊MDS/MPN患者。诊断依据WHO 2016年造血和淋巴组织肿瘤分类标准,其中CMML 23例,aCML 4例,MDS/MPN⁃U 1 例。因大部分患者缺乏初诊时的基因突变检测结果,因此根据CMML 诊断与治疗中国指南(2021年版),危险分层采用CMML特异性预后积分系统(CMML specific prognostic scoring sys⁃tem,CPSS)进行评估。中危⁃1型9例,中危⁃2型17例,高危3例。经评估,患者均有治疗指征,如严重的血细胞减少、明显骨髓增殖迹象(如白细胞升高、有症状的脾大)、骨髓原始细胞≥5%等,根据医生的治疗建议,16 例患者接受单用HMA 治疗[地西他滨(decitabine,DAC)12例,阿扎胞苷4 例],13 例患者接受DAC联合小剂量化疗(D⁃CAG)治疗,两组患者初诊时的临床特征差异均无统计学意义(表1)。本研究经医院伦理委员会批准,所有患者知情同意。
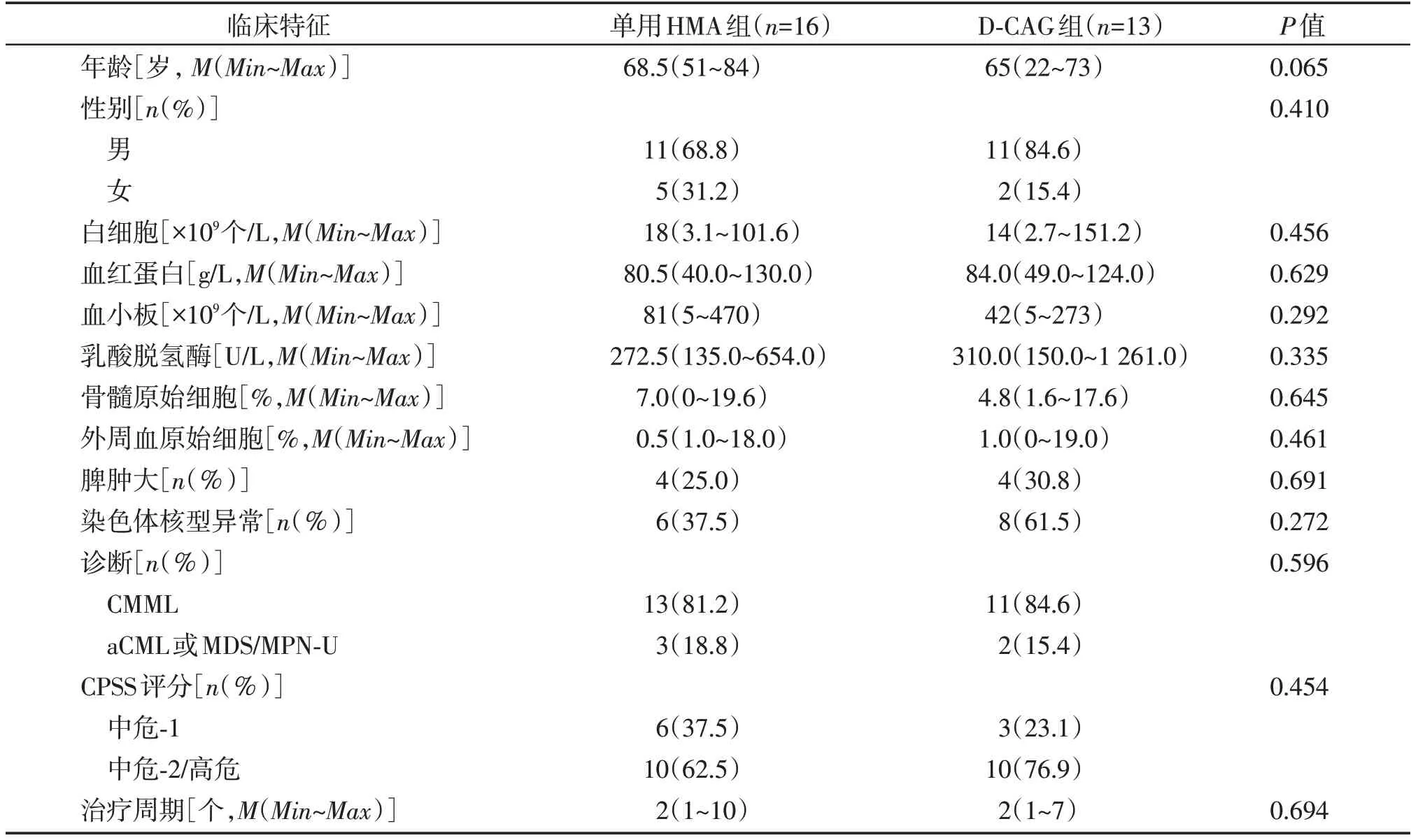
表1 29例MDS/MPN患者的临床特征
1.2 方案
1.2.1 治疗方案
单用HMA方案患者16例,DAC 20 mg/(m2·d),第1~5 天;阿扎胞苷75 mg/(m2·d),第1~7 天。D⁃CAG方案患者13例,DAC 15 mg/(m2·d),第1~5 天;阿柔比星8 mg/(m2·d),第3~6 天;阿糖胞苷(cytarabine,Ara⁃C)10 mg/(m2·d),皮下注射,每12 h 1次,第3~9天;G⁃CSF 300 μg/d,皮下注射,白细胞计数(white blood cell,WBC)>20×109个/L时停用[9]。
符合移植适应证的患者予以allo⁃HSCT。单用HMA 患者若疾病进展,采用D⁃CAG 方案继续治疗,D⁃CAG 方案治疗患者若疾病进展采用IA[伊达比星10~12 mg/(m2·d),第1~3天+Ara⁃C 100 mg/(m2·d),第1~7天]、HA[高三尖杉酯碱2 mg/(m2·d),第1~7天+Ara⁃C 100 mg/(m2·d),第1~7天]等方案治疗。
1.2.2 疗效评估
疗效评估根据2015MDS/MPN 标准进行评估。MDS/MPN 标准分为完全缓解(complete response,CR)、细胞遗传学缓解、部分缓解(partial remission,PR)、骨髓完全缓解(optimal marrow response,OMR)、骨髓部分缓解(partial marrow response,PMR)、临床获益(clinical benefit,CB)、疾病进展(progression disease,PD)。本研究中,不包含于上述标准的疾病状态定义为疾病稳定(stable disease,SD)。客观缓解率(objective response rate,ORR)定义为CR、PR、OMR、PMR 与CB 之和。由于回顾性资料的限制,本研究未评估患者MPN相关体质性症状及脾肿大缓解情况。
1.2.3 随访
通过电话、医院登记系统等方式对所有29例患者进行随访,随访截至2022 年1 月1 日。总生存期(overall survival,OS)为从确诊开始至末次随访或死亡的时间。无白血病生存期(leukemia⁃free survival,LFS)为从确诊开始至转化为急性白血病、死亡或末次随访的时间。
1.3 统计学方法
采用SPSS 26.0 软件进行统计分析。Kaplan⁃Meier 法分析OS 及LFS,组间比较采用Log⁃rank 检验。定量资料采用秩和检验进行组间比较,定性资料采用Fisher精确检验进行组间比较。单因素及多因素分析采用Cox 比例风险回归模型分析,单因素分析中P<0.1 的变量纳入多因素分析。双侧P<0.05为差异有统计学意义。
2 结果
2.1 疗效评价
中位随访时间12.7(2~105.6)个月,单用HMA组患者与D⁃CAG 组患者ORR(50.0%vs.61.5%,P=0.711)、CR 率(12.4%vs.15.4%,P=1.000)、OMR 率(37.5%vs.38.5%,P=1.000)、CB 率(0%vs.7%,P=1.000)、SD 率(25.0%vs.15.4%,P=0.663)、PD 率(25.0%vs.18.8%,P=1.000)差异均无统计学意义。本研究中4 例aCML(单用HMA 3例,D⁃CAG 方案1 例),仅1例单用HMA 治疗的患者获得OMR,唯一的MDS/MPN⁃U 患者在使用D⁃CAG 方案后获得CR,并在后续行allo⁃HSCT。初诊时染色体核型异常者共14 例(单用HMA 方案6例,D⁃CAG 方案8 例),经治疗2 例单用HMA 患者及3 例D⁃CAG 方案患者获得细胞遗传学缓解(33.3%vs.37.5%,P=1.000)。单用HMA 组及D⁃CAG 组分别有1 例及2 例患者行allo⁃HSCT。
2.2 生存分析
截至2022 年1 月1日,29 例患者中死亡21例,失访2例,存活6例。D⁃CAG 组患者中位OS较单用HMA组明显延长(26.3个月vs.13.5个月,P=0.009 5)。且与单用HMA 组患者相比,D⁃CAG 组患者有较长的中位LFS(24.2个月vs.8.7个月,P=0.045 5,图1)。3例移植患者仅有1例存活(D⁃CAG组),其余2例患者均因疾病进展为急性白血病死亡,3 例移植患者的OS 分别为17.5、23.7、45.0 个月(存活并持续缓解)。将患者年龄、性别、白细胞(≥13×109个/Lvs.<13×109/L)、血红蛋白(≥70 g/Lvs.<70 g/L)、血小板、乳酸脱氢酶、治疗方案(单用HMAvs.D⁃CAG 方案)、染色体核型异常(有vs.无)、外周血原始细胞(有vs.无)、骨髓原始细胞(≥10%vs.<10%)、脾肿大(是vs.否)、CPSS 危险分层(中危⁃1vs.中危⁃2vs.高危)、ORR(是vs.否)等因素纳入单因素分析,将P<0.1 的因素纳入Cox 回归多因素分析模型,结果表明仅有治疗方案是影响患者OS的独立预后因素,表明D⁃CAG方案有助于改善患者的生存情况(表2)。
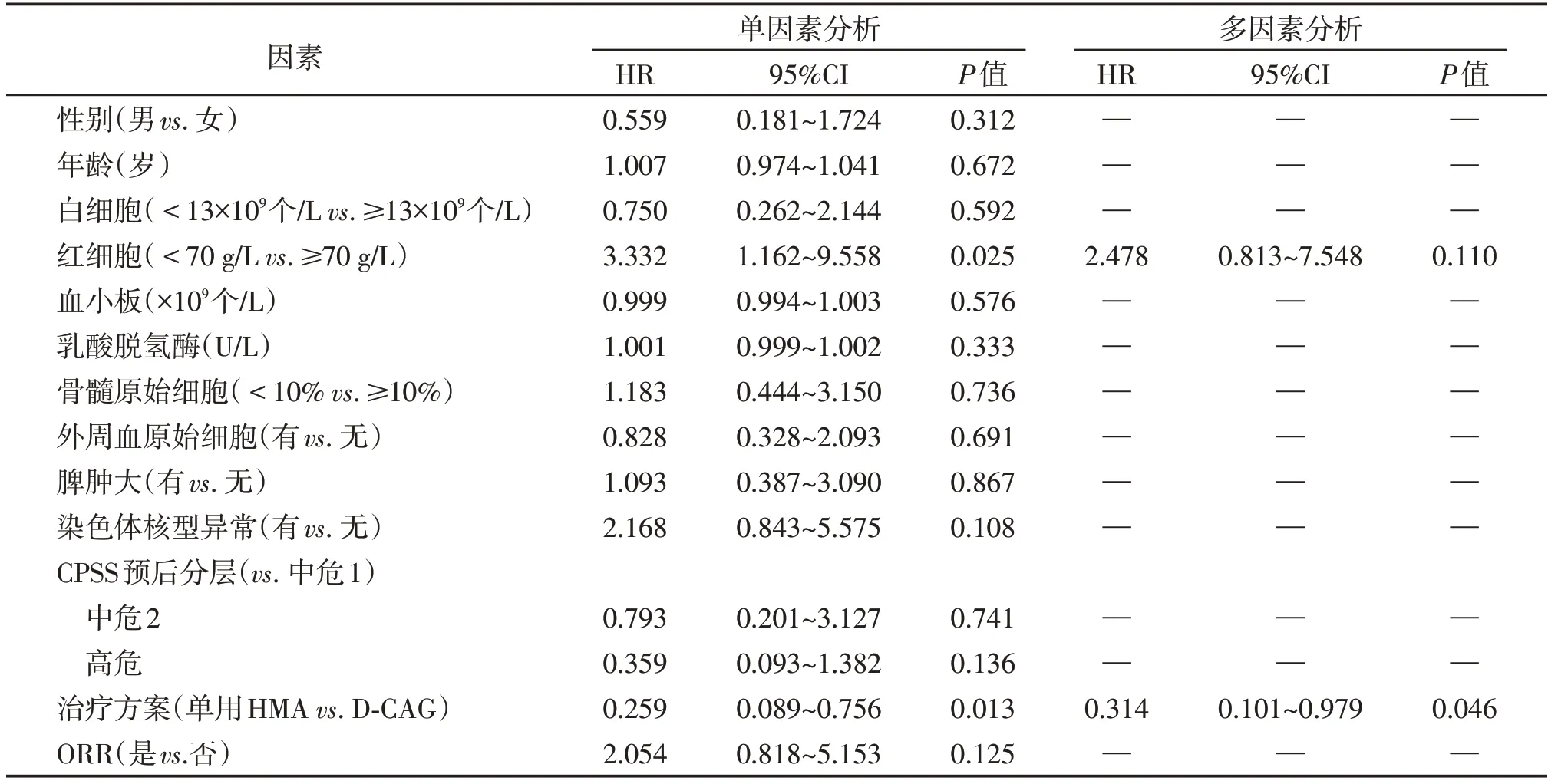
表2 29例MDS/MPN患者生存影响因素的单因素及多因素分析
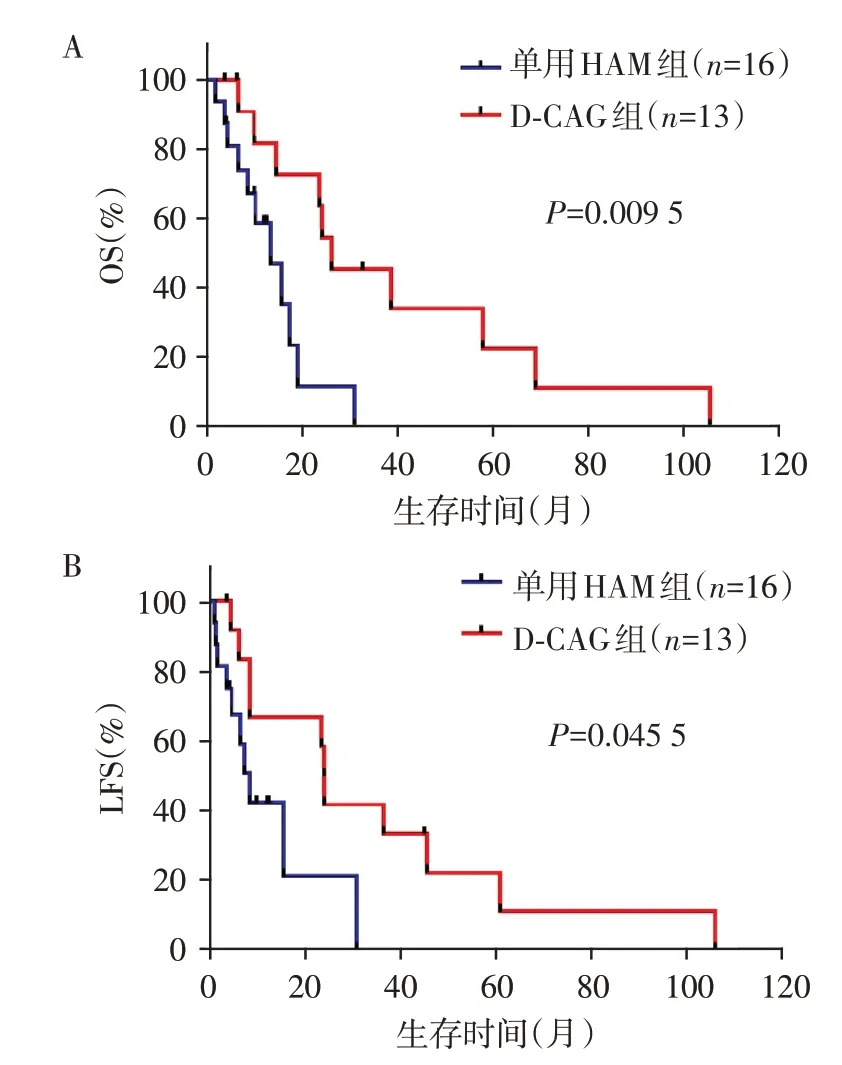
图1 单用HAM 组与D⁃CAG 组患者总生存(A)和无白血病生存(B)比较
2.3 不良反应
主要不良反应为骨髓抑制、发热、肺部感染等。单用HMA 组患者出现3~4 级骨髓抑制2例,发热2例,肺部感染1 例。D⁃CAG 组13 例患者均发生3~4 级骨髓抑制,7 例患者出现发热,2 例肺部感染,1 例肠道感染(表3)。这些患者经过成分输血、抗感染等积极的对症支持治疗后均好转,单用HMA 组中2 例患者因疾病进展而脑出血死亡。两组患者均无早期死亡(定义为治疗开始后30 d内的死亡)。
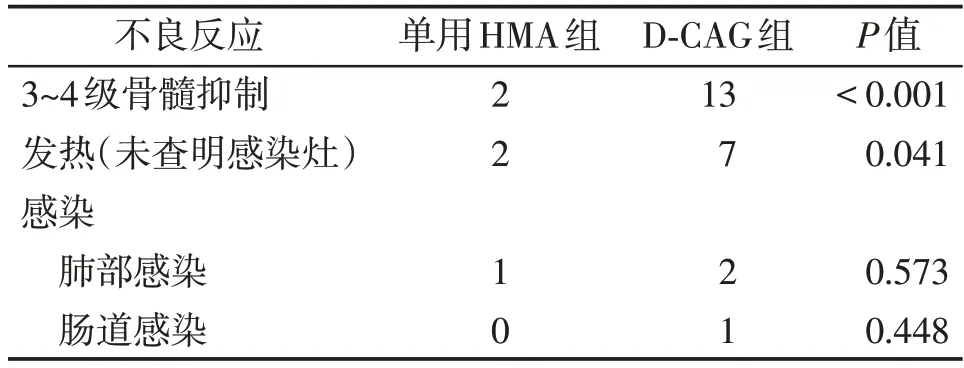
表3 两组不良反应比较
3 讨论
大量研究已证实HMA对于MDS/MPN患者有一定的临床疗效,其ORR 为40%~50%,CR 率不超过20%[3,10]。与既往研究类似,本研究中单用HMA 患者ORR 为50%,CR 率为12.4%。近期Pleyer等[11]发表了首个HMA、羟基脲及强化化疗治疗CMML患者的回顾性分析,该研究共纳入949例CMML患者,结果显示HAM组患者中位OS明显长于羟基脲组及强化化疗组(20.7 个月vs.15.6 个月vs.14.0 个月,P<0.05)。同时发现骨髓增殖性CMML(MPN⁃CMML)、骨髓原始细胞≥10%、WHO 亚型为CMML⁃1 或更高以及高风险CPSS 的患者使用HMA 疗效更好。相反,对于骨髓增生异常CMML(MDS⁃CMML)、骨髓原始细胞<10%、WHO 亚型为CMML⁃0 以及低风险CPSS 的CMML 患者,与羟基脲或强化化疗相比,使用HMA 并没有明显获益。本研究中CMML 患者均为CPSS 中危或高危患者,通过单因素及多因素分析,本研究并未发现白细胞≥13×109个/L、骨髓原始细胞≥10%及高风险CPSS 的患者有更好的生存获益,可能与本研究病例数较少有关,同时D⁃CAG 方案可能改善了中高危患者的生存。
随着疾病分子机制研究的深入及MDS/MPN 患者治疗需求的增加,相应的临床试验逐渐丰富,更多的新疗法也在探索之中。芦可替尼是一种JAK1/2抑制剂,Assi等[7]将芦可替尼联合阿扎胞苷应用于35 例MDS/MPN 患者,其ORR 为57%,64%(9/14)的患者在24 周时可触及脾肿大降低50%以上,与非ORR 患者相比,ORR 患者多表现为JAK2 突变及脾肿大。同时芦可替尼对CSF3R T618I突变也有效[12],但JAK2 V617F 及CSF3R T618I 突变在MDS/MPN 患者中并不常见,因此该药受益群体有限。同时FLT3⁃ITD受体抑制剂、IDH1/2受体抑制剂等也可应用于有相应基因突变的MDS/MPN 患者[13]。维奈克拉(Venetoclax,VEN)是选择性的、口服可吸收的BCL⁃2小分子抑制剂,Montalban⁃bravo等[14]回顾性评估了含VEN 方案治疗27 例CMML 患者的疗效,其ORR为67%,CR率为4%,其中初治的CMML患者均有效。目前关于VEN联合阿扎胞苷治疗CMML患者的临床试验正在进行(NCT04160052、NCT03404193)。本研究患者均未使用上述新型药物,因这些药物尚未被批准用于MDS/MPN患者。
强化化疗不推荐常规用于MDS/MPN 患者,其死亡率高且有效率低,欧洲专家仅推荐其用于桥接allo⁃HSCT治疗[15]。Hunter等[16]研究表明与CMML⁃0/CMML⁃1 患者相比,CMML⁃2 具有向AML转化的风险,且转化为AML 的时间更短,因此对于此类患者可予AML方案治疗。由于MDS/MPN患者多为老年人,中位发病年龄约70岁,大多数老年患者无法耐受AML样强化化疗,而D⁃CAG方案是一种低强度化疗方案,本中心既往研究已证实该方案在老年AML患者中安全有效[9,17⁃18]。本研究发现D⁃CAG组患者的临床疗效与单用HMA 组的差异无统计学意义,虽然CR率小于20%,但生存分析发现D⁃CAG组患者的中位OS 明显长于单用HMA 组患者,且D⁃CAG 组患者有较长的中位LFS,推测D⁃CAG 方案可能通过延长患者的LFS来提高生存获益。同时多因素分析也发现治疗方案是影响患者OS 的独立预后因素,因此选择合适的治疗方式有助于提高患者的OS。既往研究表明,CPSS 预后评分系统根据OS能够将患者分为4个不同的风险组[19⁃20],而本研究通过单因素分析并未发现中危、高危患者的OS差异有统计学意义,可能与本研究样本量小或D⁃CAG方案可能改善较高危患者的预后有关。与既往研究[20⁃21]不同,本研究尚未发现高龄、白细胞、乳酸脱氢酶等因素是影响患者OS的预后因素,可能与本研究病例数较少有关。虽然与单用HMA 方案相比,D⁃CAG方案更容易导致3~4 级骨髓抑制,但由于积极的支持治疗,并未增加患者感染的风险。
本研究仍有回顾性研究的固有局限性,样本量较少,数据跨度时间较大,且无基因突变数据等。但本研究初步证实了D⁃CAG 方案应用于MDS/MPN患者是安全有效的,并可能带来生存获益,这将为临床治疗提供参考。

