物理变化与化学变化辨识探析
温州大学化学与材料工程学院(325035)牛芙荣 王稼国
物理变化与化学变化这一对概念一直是化学教学的重要内容之一,也是中考和高考的重点和难点。然而,在一些文献中对这对概念的内涵和外延的解析不够准确,甚至存在偏差,常常给学生带来困扰。初中教材中,将化学变化定义为有新物质生成的变化,但对新物质并没有明确的界定。也有从化学键的角度[1]来判断的,但换个情境来理解时容易产生偏差。本文分析了不同学习阶段物理变化与化学变化的判据,侧重从分子的角度来做出判断,并列举了物理变化与化学变化的常见类型,修正了学生的理解偏差。
一、判据
初中阶段,判断一个变化过程是物理变化还是化学变化,其依据是有没有新物质生成。但这对刚接触化学的学生来说并不容易,如单斜硫与斜方硫之间的转化、石墨与石墨烯之间的转化等;又如水和冰明明是不同的物质,为什么它们之间的转化属于物理变化?而借用初中所学的模型,包括比例模型、球棍模型等,都能较好地帮助学生理解和判断物理变化与化学变化。
高中阶段,学生学习了一部分结构知识,包括原子结构、分子结构和化学层次的作用力,具备了一定的从微观角度分析物质性质及其变化的能力。此阶段部分教师引导学生用化学键是否改变来判断变化的性质,但容易引起理解偏差。如有观点认为,只有同时发生旧化学键的断裂和新化学键的形成的过程才能称为化学变化,而只发生化学键的形成或化学键的断裂的过程不属于化学变化。
大学阶段,对分子的定义是,分子是保持物质化学性质的最小微粒。只要物质的化学性质发生了变化,即可以确定该过程涉及化学变化。
有观点认为,构成物质的微粒可以是分子,也可以是原子或离子,那么离子和原子也是保持物质化学性质的最小微粒。持此观点的人显然对分子的理解出现了偏差,将直接用元素符号表示的单质看成了单原子,但事实上在中学化学中有部分分子就是直接用元素符号来表示的。单质包括稀有气体单原子分子,单原子金属分子和单原子非金属分子,如Na(g)、C(g)、Cl(g)等;多原子分子如S8、P4、C60分别用S、P、C 简化表示;不确定原子数的原子结合体,如红磷、石墨、硅,分别属于一维、二维和三维结构,每颗晶粒分属于原子数量不确定的巨型分子(以下的巨型分子都特指这一类),分别用P、C和Si简化表示。
同理,由离子构成的物质,如NaCl,每颗晶粒也分属于离子数量不等的巨型分子,用最简式表示其组成。带电荷的原子或原子团,如Cl−、CH4+等,包括溶剂化的离子,如[Na(H2O)6]+等,都是带电分子。因此,保持物质化学性质的最小微粒仍是分子,而离子和原子只是构成分子的一部分。
用化学性质的保持者分子来判断变化过程是物理变化还是化学变化优势明显,且应用面广、准确性高,只要比较变化过程中物质的化学性质是否发生了变化,就可以判断出是物理变化还是化学变化了。
二、应用
(一)物质的气、液、固三相间的变化
物质的状态变化通常被认为是物理变化,最常见的如水的气态变液态、液态变固态,是公认的物理变化,因为变化过程中物质都是以H2O 分子的形式存在,其化学性质自始至终没有发生变化。大多数稳定的小分子化合物的状态变化也大都具有这一特点,因此发生的多是物理变化。但例外总是存在的,如NO2、SO3、PCl5,它们在气态时都是小分子,NO2和SO3液化后发生了聚合,详见过程(1)和(2),这是典型的化学变化;PCl5在形成晶体时离子化为[PCl4]+和[PCl6]+,详见过程(3),也是典型的化学变化。它们状态变化前后,分子的化学性质发生了变化。

NaCl、Fe 单质、金刚石分别属于典型的离子晶体、金属晶体和原子晶体,它们的每颗晶粒就相当于一个分子。这些物质发生状态变化时,传统观点认为是物理变化,持此观点的依据是它们由固态变为液态或由液态变为气态时只发生旧化学键的断裂,并没有形成新的化学键。用分子的概念来判断时会得到完全不同的答案。先看固态的NaCl 在熔化时破坏或削弱了部分离子键,形成(NaCl)mNa+和(NaCl)nCl−(其中m和n是正整数,且随温度升高而变小),即可以自由移动的阴阳离子;气化时形成NaCl(g)双原子分子[2],分别见过程(4)和过程(5);不管是自由移动的阴阳离子团,还是气态分子,它们的化学性质都与固态时的NaCl 巨型分子明显不同,因此过程(4)和过程(5)均是化学变化,也就是说,典型的离子化合物的状态变化都是化学变化。再看Fe 单质的熔化,在此过程中破坏了一部分金属键,形成可自由移动的Fem原子团;气化时则形成单原子分子Fe(g),详见过程(6);显然,不管是原子团,还是单原子分子,其化学性质与固态的金属铁都有明显的不同,如常温、常压下的固态铁不可能与水蒸气反应,而液态铁和气态铁都可以与水蒸气反应,见过程(7)。

因此,大多数金属晶体的状态变化也是化学变化,判断的依据是其化学性质发生了显著变化。同理可以推出,原子晶体的状态变化也是化学变化。这一结论还可以推广到一维、二维结构的单质和化合物,即绝大多数一维、二维和三维结构的物质,在发生状态变化时多属于化学变化。而常温、常压下为零维结构的小分子发生状态变化时,虽然大多数属于物理变化,但仍然有少数属于化学变化,需要具体分析变化过程中物质的化学性质有没有发生变化。
(二)物质的溶解
溶解过程通常被认为是物理变化过程,但实际上溶解过程会因溶质和溶剂的不同而存在差异。如乙醇在水中的溶解过程是典型的物理变化,溶解过程中溶质和溶剂分子都没有发生变化。绝大多数有机小分子在水或有机溶剂中的溶解都属于物理变化。如果考虑在小分子液态溶剂中的溶解,则不论溶质如何,根据相似相溶原理,溶质的存在形式往往是作用力与溶剂分子间作用力相近的小分子。如FeCl3在苯中的溶解,FeCl3是具有层状结构的巨型分子,在苯中不会以巨型分子的形式存在,而是离解成二聚物Fe2Cl6甚至单分子FeCl3这类小分子,只有这样其作用力才会与苯接近,才能溶解形成溶液。又如NaCl 在水中的溶解,NaCl 属于三维巨型分子,在水中通过形成水合阳离子和水合阴离子而小分子化,详见过程(8),这些离子型小分子与水的作用力相近。由此可以总结出规律:能在小分子溶剂中溶解的通常都是小分子或小分子化的溶质,如果溶质是一维(如BeCl2)、二维(如MgCl2)或三维(如BaCl2)结构的巨型分子,其溶解过程往往涉及小分子化,因此这类巨型分子溶质的小分子化溶解过程必然属于化学变化。还有一些无机小分子,包括各种强酸类和共价性盐类,如H2SO4、TiCl4等,在水中溶解时会被水分子诱导而形成溶剂化离子,其溶解过程也属于化学变化,详见过程(9)和过程(10)。
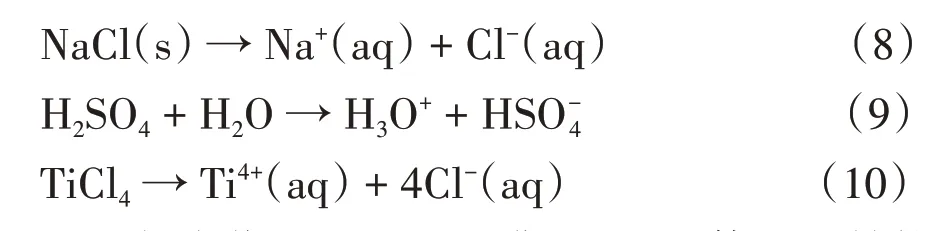
硫酸与水作用的过程很典型,从晶体硫酸结构可以看出所发生的变化是化学变化,实际上硫酸与水可以形成一系列的水合物。在纯硫酸中,H 全部连接在与S 成键的O 原子上,即(HO)2SO2;在一水合硫酸(H2SO4·H2O)晶体中(实际上是[H3O]+[HSO4]−),硫酸上的一个H 转移到了H2O 上形成H3O+,且H3O+和HSO−4两个微粒不在共价键的作用距离之内;在二水合硫酸(H2SO4·2H2O)晶体中,不存在,而是形成了[(H3O)2]SO4;在四水合硫酸(H2SO4·4H2O)晶体中,每两个H2O 共用一个H+,形成的是[H5O2]2SO4,即其中H2SO4上的每个H 都同时与2 个O 作用,作用距离在共价键的范围内;在八水合硫酸(H2SO4·8H2O)晶体中,每4 个H2O 与1 个H+作用,导致与H+结合的四个H2O 中的O 不可区分,H+在四个O 之间振动传递,可近似看成[H9O4]+。总之,在各类硫酸水合物中不再存在H2SO4分子。因此,硫酸干燥或稀释过程都属于化学变化,HNO3、HCl、HBr、HI 等强酸分子溶于水也都发生了化学变化。作为强电解质的酸、碱和盐溶于水,都属于化学变化。
离子晶体、原子晶体和金属晶体之间的固态高温互溶,如合金(Al−Hg)、离子晶体(NaCl−AlCl3)的固溶体等的形成过程,都发生了化学键的重新组合,生成的产物在化学性质上与反应物明显不同,因此属于化学变化。
(三)同素异形体之间的转化
同素异形体之间的转化既有物理变化,又有化学变化,只有从分子角度去分析才能找到正确的答案。如金刚石与石墨,前者是三维网状结构,而后者是层状结构,二者的化学性质有显著差异,因此它们之间的转化属于化学变化。石墨转化为碳纳米管、富勒烯也属于化学变化。石墨转为石墨烯要看具体情况,如果用胶带将石墨层剥离,仍然保持原有分子,则属于物理变化,而用化学剪裁裁成小分子石墨烯,则属于化学变化。单斜硫与斜方硫之间的转化过程,只是分子的空间姿态有所不同,而化学性质未变,所以属于物理变化;而单斜硫或斜方硫转化为一维结构的弹性硫,化学性质有一定的变化,所以属于化学变化。氧有四种较常见的同素异形体后三者都是双原子分子,但是分子的电子结构不同[3],能量不同,化学性质也明显不同,因此这四种氧的同素异形体之间无论是哪两种的相互转化过程都属于化学变化。
(四)切割变小
对于一维、二维和三维结构的物质,若将宏观上的大块等分切割成两份,虽然涉及化学键的断裂,但切割前后,决定化学性质的表面微粒的比例都很低,其化学性质几乎没有改变,即保持原有的化学性质,所以属于物理变化。因此,有维结构的巨型分子在进行宏观上的有限切割时,切割前后物质的化学性质几乎不变,都属于物理变化。但若进行深度切割,就会由量变转为质变,也就是发生了化学变化。如将1012个Fe原子形成的原子团(约为2μm),切成2 块均为5×1011个Fe 原子的微米铁,则切割前后化学性质几乎不变,属于物理变化;若切割成等分的由106个Fe 原子形成的原子团(约20 nm),切割前后化学性质发生了显著变化,属于化学变化。如果从微米铁上切割下1个Fe原子,脱离母体的Fe 原子的化学性质变化更加显著,微米Fe在空气中相当稳定,而纳米Fe可在空气中自燃,单个Fe 原子体现了更强的还原性。相似地,从NaCl宏观晶粒上取下1个Na+离子或1个Cl−离子或1 个NaCl 分子,母体的化学性质变化很小;而脱离母体的小分子的化学性质与母体明显不同,均可认为发生了化学变化。涉及化学键变化的宏观颗粒变成纳米颗粒甚至单原子分子的过程以及它们的逆过程,都应该视为化学变化。
(五)模糊性处理
在有些情况下,尽管变化过程中涉及化学键的断裂或形成,但物质的化学性质几乎没有变化,因此可以认为是物理变化。有观点认为,涉及化学键变化的过程,物质的化学性质会产生细微差异,但这种差异有时甚至比同位素效应产生的差异还小。如D2O 和H2O,普遍认为它们的化学性质相同,其实它们的化学性质是存在差异的,至少在化学反应速率上H+比D+快不少,所以,当变化过程中物质化学性质几乎没有差异时,视为物理变化是合理的。具体包括如下过程:
(1)宏观上的切割与粉碎,在许多情况下涉及化学键的断裂,但物质的化学性质几乎没有改变,因此可视为物理变化。组成相同的宏观粉体的烧结,虽然伴随化学键的形成,但烧结前后其化学性质几乎不变,也可视为物理变化。
(2)弱电解质的溶解和稀释,由于解离比例很小,在不涉及解离后的离子性质时,物质的化学性质也可以看作几乎没有改变,可视为物理变化。典型的例子就是醋酸溶于水,在水中有很弱的解离,可忽略,因此可视为物理变化。
(3)胶体的表面电荷中和,尽管涉及离子键的强弱变化,由于中和的电荷很少,且这些表面离子键是可逆调变的,因此可视为物理变化。
(4)物质的颜色往往是由部分分子吸收可见光发生电子跃迁引起的,这部分分子的活性显著不同于未发生电子跃迁的分子,但由于发生电子跃迁的分子占比很小,因此物质的颜色变化多属于物理变化。但有些颜色的产生,如原子吸收光谱或原子发射光谱(焰色反应),它们都需要在极高的温度下将原料中的金属元素原子化,此时的显色过程属于化学变化,因为原料在高温下发生了质变。
(5)体现金属延展性的宏观变形过程虽然也涉及金属键的断裂和形成,但金属变形前后的化学性质几乎不变,因此可视为物理变化。
(6)金属的固态相变,由于金属常见的三种密堆积之间的化学性质差异很小,因此可视为物理变化。
三、总结
“分子”一词在初中化学中就已广泛提及,高中化学则要求学生对分子有较深入的理解。用保持物质化学性质的最小微粒——分子来作为物理变化与化学变化的判断依据相对更加合理,适用面也更广,可有效帮助更多的学生修正认知和理解偏差。本文列举了物理变化与化学变化的基本类型,特别对物理变化与化学变化的判断依据进行了分析。主要包括:(1)物质状态的变化。有维结构的巨型分子的三态变化一般都是化学变化,小分子的三态变化绝大多数是物理变化,但也有些例外,要格外注意。(2)物质的溶解。强电解质在水中的溶解都是化学变化,弱电解质的溶解在不考虑解离出的离子性质时,属于物理变化。离子晶体、原子晶体和金属晶体之间的固态高温互溶均属于化学变化。而非电解质的水溶或相互溶解,若不发生化学反应,则是物理变化。(3)同素异形体之间的转化绝大多数是化学变化,但也有少数例外,比如典型的单斜硫与斜方硫之间的转化以及金属晶体不同结构间的转化属于物理变化。(4)宏观切割和形变均属于物理变化。

