医用多孔支架材料的制备及缓释性能分析
王 培,牛丽丽,李静宇,耿红梅
(衡水学院应用化学系,河北 衡水 053000)
0 前言
随着对组织工程研究的深入[1⁃2],各类生物支架材料方面研究也越来越得到广大研究者重视[3⁃4]。其中,PCL属于合成高分子材料,易加工、具有优异的生物相容性、可吸收且降解速率和强度可调节,成为生物支架材料的理想之选。在结构方面,生物支架材料需为细胞迁移、分化、增殖,即组织再生提供空间,以引导组织的修复或重建[5⁃6],因此,在结构上需要具有适宜的孔隙率。
在人体内放置生物支架的手术后,会出现一定比例的术后感染,这已成为临床上必须解决的问题。而在支架材料上负载药物,可以起到术后减少或避免致病性感染的作用,同时还可对组织修复起到积极作用。CUR是1种天然产物,毒性低、副作用小,具有抗炎、抗癌、抗氧化等作用,这使其在医药方面的应用和研究越来越受到广泛关注[7⁃8],现阶段已制备出了CUR纳米晶胶囊、CUR纳米颗粒等并进行了体内外评价[9⁃10],尤其是CUR在肿瘤预防和治疗方面表现出很好的应用前景[11⁃12]。因此,本论文尝试选用CUR作为药物模型,制备负载CUR的支架材料,拓宽CUR在组织工程领域的应用范围、同时为该类支架材料在组织工程领域的潜在应用提供参考,以期“天然药物+可降解医用聚合物”组合模式在组织工程领域深入发展。
1 实验部分
1.1 主要原料
PCL,CAPA⁃6800,瑞典Perstorp公司;
CUR,优级纯,上海博湖生物科技有限公司;
冰醋酸,分析纯,天津市大茂化学试剂厂;
壳聚糖,生化试剂,天津市大茂化学试剂厂;
磷酸盐(PBS)缓冲溶液,99.5%,上海伊卡生化试剂厂。
1.2 主要设备及仪器
SEM,SU8000,日本日立公司;
TG,TGA4000,美国PerkinElmer公司;
可见分光光度计,722G,上海仪电分析仪器有限公司;
超声波清洗机,KQ⁃200KDE,昆明市超声波仪器有限公司;
恒温水浴锅,HW.SY11⁃K122,北京市长风仪器仪表公司;
电子天平,NVL5D11B,奥豪斯(常州)有限公司。
1.3 样品制备
将适量PCL、CUR和壳聚糖溶于冰醋酸中,超声溶解4 h至全溶后,加入戊二醛并摇匀,多次水洗后45℃干燥过夜,制得多孔支架。
1.4 性能测试及结构表征
形貌分析:试样放入液氮中冷却30 s,取出脆断,进行喷金处理,然后采用SEM表征支架材料的形貌;
热重分析:采用TG分析,称取5~8 mg试样,以氮气为保护气体,流速为50 mL/min,升温速率为10℃/min,升温范围为30~550℃;
孔隙率测定:用比重瓶法测量材料的孔隙率,将支架质量设定为m0(单位为g);比重瓶装满蒸馏水25℃恒温至少10 min,测量质量为m1(单位为g);支架浸入蒸馏水后,25℃恒温至少10 min后,排出多余蒸馏水后质量为m2(单位为g);将支架材料从蒸馏水中取出,剩余比重瓶及蒸馏水质量为m3(单位为g);25℃下蒸馏水密度为ρ(单位为g/mL);支架体积V支(单位为 mL)=(m1+m0-m2)/ρ,支架孔体积V孔(单位为mL)=(m2-m3-m0)/ρ,孔隙率ε(单位为%)=V孔×100%/(V支+V孔)=(m2-m3-m0)×100%/(m1-m3)。
载药量测定:(1)标准曲线的绘制;称取50 mg CUR溶于乙醇⁃PBS缓冲液(pH=7.4,乙醇含量30%)中,稀释至 100 mL;分别取 0.50、1.00、2.00、3.00、4.00、5.00 mL溶液,稀释至50 mL,取适量溶液在426 nm处测定吸光度,得到CUR溶液的浓度(X,g/L)与吸光度(Y)的标准曲线Y=8.076 9X-0.007 4;(2)载药量测定;称取适量支架材料溶于乙醇中,溶解充分后用缓冲溶液稀释,在426 nm处测吸光度,再通过标准曲线方程计算CUR的浓度,载药量(z,%)按式(1)计算:

式中a——溶解出的CUR的质量,g
b——溶解前支架材料质量,g
体外缓释测试:称取适量PCL⁃CUR支架材料,置于一定体积PBS(pH=7.4)模拟体液中,37℃恒温,在426 nm处测定吸光度,再通过标准曲线计算CUR浓度,平行测定3组样品取平均值,计算累计释药量。
2 结果与讨论
2.1 支架材料形貌分析
图1 PCL浓度为10%、CUR在支架材料中质量分数为2%、壳聚糖在支架材料中质量分数为2.86%的支架材料的SEM照片。图1(a)中可明显看到CUR药物颗粒附着在具有孔洞结构的骨架上。如图1(b)~(c)所示,在不同比例尺下较清晰观察到材料的孔洞结构,表明本实验制备的支架材料成功负载上了CUR且有明显孔洞。

图1 PCL⁃CUR支架的SEM照片Fig.1 SEM images of PCL⁃CUR scaffold
2.2 热重分析
如图2所示,300~350℃时支架材料开始失重,PCL浓度和壳聚糖含量一定时,随着CUR含量从1%到2%,最大失重温度几乎没有变化,都在393℃附近,这说明CUR含量对热稳定性几乎没有影响。PCL浓度和CUR含量均相同时,壳聚糖含量从2.86%到5.71%时,最大质量损失温度从393℃降到387℃,这可能是因为孔隙率的增大会降低材料的力学性能和稳定性,从而导致热稳定性降低。壳聚糖含量为2.86%、CUR含量为2%,PCL浓度由8%到10%时,最大质量损失温度从395℃变化到393℃,热稳定性有降低趋势,同时可发现PCL浓度对热稳定性的影响不如壳聚糖含量变化大。

图2 样品的DTG曲线Fig.2 DTG curves of the samples
2.3 孔隙率分析
如表1所示,其他组分不变而PCL浓度由8%增大到10%时,材料孔隙率由96.42%降低到95.33%,这是因为当PCL浓度增大时溶液黏度增大,材料致密度增大。其他组分不变,随着CUR含量由1%增大到2%孔隙率也稍有下降,这是因为CUR填充了部分孔隙,使孔隙率降低。其他组分不变,壳聚糖含量为零时,支架也存在一定孔隙率,但孔隙率很低(19.09%),这可能是因为溶剂蒸发导致材料有一定的孔隙率。当壳聚糖含量为2.86%时,孔隙率为95.07%;当壳聚糖含量为5.71%时,孔隙率为98.07%。可见壳聚糖在体系中对材料孔隙结构有显著影响,且随壳聚糖含量的增加孔隙率增大,这是可能因为CS在混合过程中占据更大空间,当材料干燥后吸水溶胀的壳聚糖脱水收缩,其原来占有的体积形成了孔隙,故而支架孔隙率更大。从而可以发现,壳聚糖含量对材料的孔隙率影响最大。

表1 支架材料的孔隙率Tab.1 Porosities of the scaffold materials
2.4 载药量的影响因素分析
2.4.1 CUR含量对支架载药量的影响
如图3所示,其他组分一定时,随着CUR含量增加,载药量有明显增加趋势,这是因为只有CUR投药量大支架才能有更多CUR可以负载。但随着CUR含量超过2%,支架材料载药量变化不大,这可能是由于支架材料负载的CUR达到饱和。
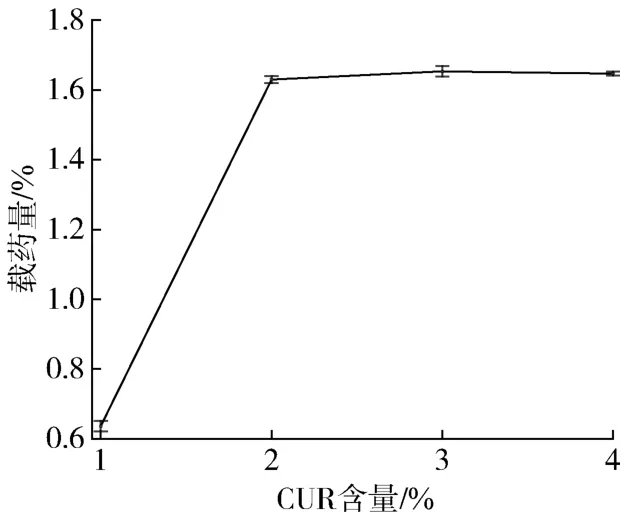
图3 CUR含量对支架载药量的影响Fig.3 Effect of CUR content on drug loading capacity of the scaffold
2.4.2 壳聚糖含量对支架载药量的影响
从图4中可见,载药量误差较小,实验数据可信度高。PCL浓度、CUR含量一定时,随壳聚糖含量从1.43%增加到2.86%,载药量显著上升,这可能是因为孔隙率随之变大,与CUR接触的表面积变大,进而可以负载更多的CUR药物。壳聚糖含量超过2.86%后,载药量变化不明显,因此本实验的其他配方采用壳聚糖含量为2.86%。
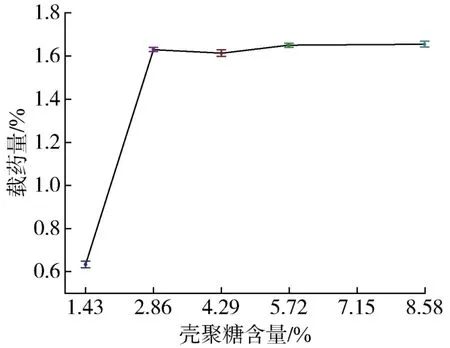
图4 壳聚糖含量对支架载药量的影响Fig.4 Effect of chitosan content on drug loading capacity of the scaffold
2.5 体外药物缓释影响因素分析
在30%乙醇PBS溶液(pH=7.4)的释放介质中,药物释放率如图5和图6所示。支架药物缓释中的存在2个阶段,第一阶段为前60 h,存在一定的突释现象,药物释放较快;第二阶段为60~90 h,曲线趋向平缓,药物释放减慢。这是因为支架外表面的药品最先和缓冲液接触,比较易于释放,而缓冲液不易进入支架内部故而药物在后期释放减慢。
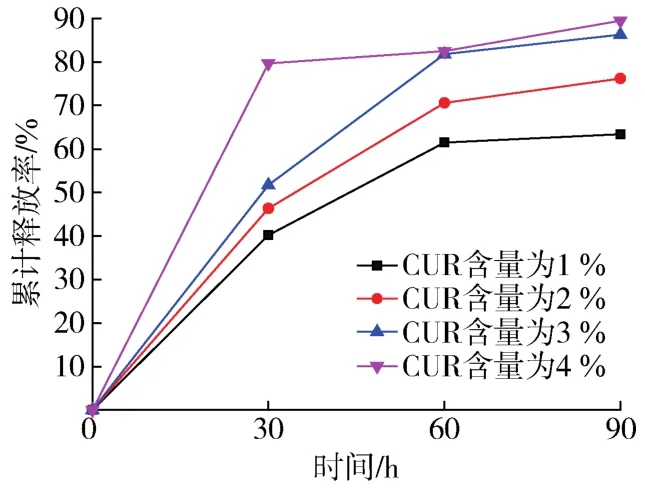
图5 CUR含量对药物累计缓释率的影响Fig.5 Effect of CUR content on cumulative drug release rate

图6 药物累计释放率与壳聚糖含量的关系Fig.6 Relationship between cumulative drug release rate and chitosan content
2.5.1 CUR含量
通过图5可以看出,CUR含量对药物缓释性能有显著影响,随着CUR含量的增加,药物的累积释放率增大而且释放速率也更快。当CUR含量为1%时,药物的释放速率相对于其他试样来说比较平稳缓慢,缓释性能最好。当CUR含量为2%、3%时释放速率相对于1%有明显加快,这是因为随着CUR添加量的增加,载药量增加,药物与缓冲液接触面积增大会使CUR的释放速率逐渐增大,同时累积释放率也得到了明显的提高。
2.5.2 PCL浓度及壳聚糖含量
从图7中我们可以发现,随着PCL浓度降低,药物的累积释放率和释放速率有增大趋势,这是因为PCL浓度降低,材料的致密度降低、孔隙率增大,导致CUR药物颗粒的束缚减小,向外扩散溶出的量增大。如图6所示,随壳聚糖含量的增加药物的累积释放率和释放速率均有所增大,这是因为随着壳聚糖含量增加,体系交联结构增多,可能导致材料孔隙率变大,表现为CUR药物在体系的累计释放率有增大趋势。同时也可以发现,PCL浓度在4%~10%变化时,90 h的累计释放率从76.2%到80.5%变化,对支架材料的缓释性影响不显著。壳聚糖含量在1.43%~8.57%变化时,90 h的累计释放率从76.2%到85.1%,跨度更大,表现出对缓释性具有更明显的影响,如图6所示。这可能是因为壳聚糖含量相对PCL浓度对支架材料孔隙率影响更大,这一结果与表1所示的孔隙率影响因素分析保持了一致性,也为调整体系的缓释性能提供了新策略。

图7 药物累计释放率与PCL浓度的关系Fig.7 Relationship between cumulative drug release rate and PCL concentration
2.6 体外释药模型分析
通过上述因素分析发现PCL在醋酸中浓度为10%、CUR在支架材料中含量为2%、壳聚糖在支架材料中含量为2.86%时,载药量和缓释性最佳。因此,该体系释药模型以此配方为例进行体外释药模型拟合。根据《中国药典》第二部分[13]进行了3种拟合,如表2所示。该体系的释药模型采用origin软件进行拟合,如图8~10所示。以R2数值判断,1级模型拟合后的R2数值最接近1,因此该体系的释药行为接近1级方程,即释药方程为Mt=84.42(1-e-0.03t),其中Mt为t时间(单位为s)的累计释放率,单位为%,拟合度为R2=0.996 6,表明该体系的CUR药物释放以扩散为主[14],药物释放的扩散机制是指药物和载体间以物理方式结合,通过扩散的方式到达指定部位而发挥药效[15]。

表2 体外释药模型Tab.2 In vitro drug release model
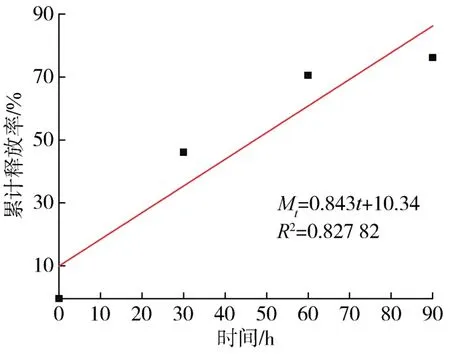
图8 零级模型拟合结果Fig.8 Zero⁃order model fitting results
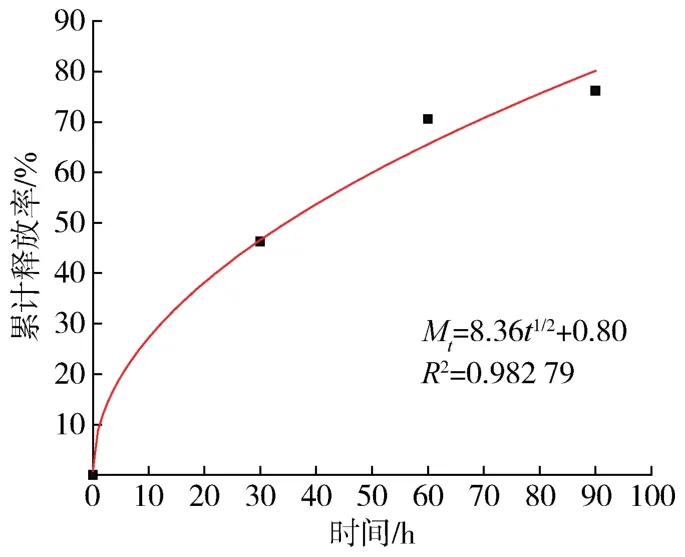
图9 Higuchi模型拟合结果Fig.9 Higuchi model fitting results

图10 1级模型拟合结果Fig.10 One⁃order model fitting results
3 结论
(1)CUR和壳聚糖的含量对PCL⁃CUR多孔支架材料的缓释性能具有较明显的影响,因此在制备该类材料时,可通过调节CUR、壳聚糖含量来调控药物释放性能;根据释药模型拟合研究表明,该体系接近1级释药模型,以扩散为主,同时可根据拟合方程直观观察释放量的变化趋势,为后续临床应用提供参考;
(2)该类支架材料距离应用于临床还有很多工作需深入开展,如大量动物模型实验需完成、支架材料结构的精确控制等,但随着人们对健康生活的重视和生物医疗器械的迅猛发展,可预见具有抗菌性的PCL⁃CUR类多孔支架材料在药物缓释和组织工程领域具有光明的应用前景。

