miR-203a-5p 调节Bcl-2/beclin-1 通路对瘢痕疙瘩成纤维细胞增殖、迁移和凋亡的影响
朱韬 陈巧玲 陶革方 黄卫平
1.台州市中心医院(台州学院附属医院)整形美容外科,浙江台州 318000;2.浙江省台州医院特需病房,浙江台州 317000
瘢痕疙瘩又称结缔组织增生,是创面愈合过程中胶原合成代谢持续活跃导致成纤维细胞和胶原过度增生的结果,呈肿瘤样侵袭性生长[1]。手术切除、放疗和激素是常用的治疗方法,但治疗效果差且常伴有复发[2]。由于瘢痕疙瘩的发病病因尚不清楚,因此,迫切需要了解瘢痕疙瘩形成的潜在机制,以探讨新的治疗靶点。微小RNA(microRNA,miRNA)在细胞增殖、分化等多种生物学过程中发挥关键作用。目前,已经发现多个miRNA 参与瘢痕疙瘩的形成和生长[3]。此外,miRNA 也被认为是一种新型的细胞过程调控因子,参与成纤维细胞增生和细胞外基质(extracellular matrix,ECM)沉积,这些均与伤口愈合有关[4]。例如,过表达miR-21-5p 可促进瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFs)的增生和迁移[5]。因此miRNA 在瘢痕疙瘩纤维化中发挥重要作用,可能成为基因治疗的新靶点。miR-203a-5p是一种肿瘤抑制因子,与肿瘤细胞增生、迁移和侵袭有关[6]。但关于miR-203a-5p 在瘢痕疙瘩中的作用和确切分子机制报道较少。B 细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)/beclin-1 通路是调控细胞自噬凋亡的重要通路,且被证明与KFs的生长有关[7]。本研究拟检测miR-203a-5p 对KFs细胞增生、迁移和凋亡的影响,并探讨Bcl-2/beclin-1通路在此过程中的作用,旨在为瘢痕疙瘩的治疗提供新靶点。
1 材料与方法
1.1 主要试剂与仪器
KFs 细胞(中国科学院上海细胞库);DMEM培养基和胎牛血清(天津灏洋生物有限公司PM1900429);Lipofectamine 2000 转染试剂盒、miRNA 阴性对照(miR negative control,miR-NC)(5'-UUCUCCGAACGAACGUGUCAC-3')、miR-203a-5p 抑制剂(5'-CCCUCCUCCUUGCUUGGGUUG-3')和miR-203a-5p 模拟(5'-GUGAGGACUCGGGAG GUGGC-3')(上海吉凯生物公司);Trizol(美国Invitrogen 公司);cDNA 反转录试剂盒和实时荧光反转录聚合酶链反应(real-time fluorescence-PCR,反转录聚合酶链反应)试剂盒(瑞士Roche 公司,SC-3187、SC-5490);双荧光素酶检测试剂盒(美国Promega公司);细胞计数试剂盒8(cell count kit 8,CCK-8)(美国Amresco 公司);Annexin V-FITC 细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);RIPA 裂解液(北京索莱宝生物技术公司);B 细胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 related X protein,Bax)、半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase-3,Caspase-3)、beclin-1、自噬相关蛋白微管相关蛋白1 轻链3Ⅱ(autophagy related protein light chain 3 Ⅱ microtubule associated protein 1,LC3Ⅱ)、胶原蛋白Ⅰ(CollagenⅠ)、β-actin和HRP 标记山羊抗鼠二抗(武汉博士德生物工程公司,批号:A2140、A0325、A1427、A0208、A1937、A0356、A1358、A2456);Thermo CO2细胞培养箱和NanoDrop2000c 型蛋白核酸检测仪(美国Thermo公司);HBS-1096B 酶标仪(南京德铁实验设备有限公司);Real-time PCR 扩增仪(美国ABI 公司);基质胶和24 孔Transwell 小室(美国CORNING 科技有限公司);BD 流式细胞仪和BIO-RAD 垂直电泳仪(美国BIO-RAD 公司)。
1.2 组织来源
因外伤导致肩部瘢痕疙瘩需手术切除的10 例瘢痕疙瘩组织离体标本及周围少许正常皮肤组织(购自上海芯超生物科技有限公司),其中男8 例,女2例,年龄22~43 岁,平均(29.25±18.61)岁,所有标本取材后立即放入液氮保存。
1.3 实验方法
1.3.1 反转录聚合酶链反应检测组织中miR-203a-5p和Bcl-2mRNA 表达 取瘢痕疙瘩组织和正常皮肤组织,剪碎后加入1ml Trizol 进行总RNA 的提取,根据cDNA 反转录试剂盒说明书将总RNA 转化为cDNA,根据荧光定量PCR 试剂盒说明制备20μl 反应体系,Real-time PCR 扩增仪中进行扩增:预变性95℃ 5s、预变性95℃ 30s、扩增60℃ 44s、40 个循环、采集荧光61℃,采用2-△△Ct法计算miR-203a-5p和Bcl-2 mRNA 的相对表达量(以U6 作为内对照)。引物为miR-203a-5p 上游引物:5'-GCGAGCACAGA ATTAATACGAAC-3',下游引物:5'-GCGAGCACAG AATTAATACGAAC-3';Bcl-2 上游引物:5'-GACTTC GCCGAGATGTCCAG-3',下游引物:5'-GTGCAGGT GCCGGCAGG-3';U6 上游引物:5'-CTCGCTTCGGC AGCACA-3',下游引物:5'-AACGCTTCACGAATTT GCGT-3'。
1.3.2 细胞转染及组别 常规细胞培养条件下培养KFs 细胞,实验分为对照组、miR-NC 组、miR-203a-5p 抑制剂组和miR-203a-5p 模拟组。对照组细胞不进行处理;miR-NC 组、miR-203a-5p 抑制剂组和miR-203a-5p 模拟组按lipofectamine 2000 说明书方法分别将miR-NC、miR-203a-5p 抑制剂和miR-203a-5p 模拟转染到KFs 细胞,48h 后进行检测。
1.3.3 荧光素酶报告基因检测 将Bcl-2 野生型/突变型(WT/MUT)与miR-203a-5p NC/抑制剂/模拟转染到对数生长期KFs 细胞,转染48h 后用双荧光素酶检测试剂分析荧光素酶活性。
1.3.4 CCK-8法检测细胞增殖率 按照1.3.1方法转染KFs 细胞后接种于96 孔板中,在实验结束前4h向培养板中加入CCK-8(10μl/孔),继续培养4h,测定吸光度值,计算细胞增生率[细胞增生率=(实验组A值-空白孔A值)/(空白对照组A值-空白组A值)。
1.3.5 Transwell 法检测细胞迁移能力 按照1.3.1 方法转染KFs 细胞后接种于Transwell 小室中,小室加入10%胎牛血清的DMEM 培养液,48h 后取出小室,用甲醛固定10min,然后用结晶紫染色30min,冲洗干净后计数紫色染色的细胞数。
1.3.6 流式细胞术检测细胞凋亡率 按照1.3.1 方法转染KFs 细胞后接种于6 孔板中,48h 后收获细胞,离心弃上清,分别加入5μl 膜联蛋白(Annexin V-FITC)与碘化丙啶,充分混匀后室温避光孵育20min,应用流式细胞仪检测细胞凋亡率。
1.3.7 Western blot 法检测细胞Bcl-2、Bax、Caspase-3、beclin-1、LC3Ⅱ和collagen Ⅰ蛋白表达 转染KFs细胞后接种于6 孔板中,48h 后收获细胞,离心弃上清,加入RIPA 裂解液100μl,冰上裂解30min 进行细胞总蛋白提取,采用BIO-RAD 湿转系统SDS-PAGE胶进行电泳(20μg/孔),切胶、转膜、封膜后将膜与Bcl-2(1:200)、Bax(1:200)、Caspase-3(1:400)、beclin-1(1:300)、LC3Ⅱ(1:500)、collagenⅠ(1:400)和β-actin(1:500)进行孵育,4℃过夜,用HRP 标记山羊抗小鼠IgG 二抗(1:5000)在室温下孵育30min,滴加电化学发光剂,进行显色,采集图像进行分析(以β-actin 作为内对照)。
1.4 统计学方法
采用SPSS 24.0 统计学软件对数据进行处理分析,其中计量资料以均数±标准差()表示,组间比较采用t检验,多组间比较采用单因素方差分析,多重比较采用SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-203a-5p 对Bcl-2 的靶向调节作用
通过生物信息学网站(www.Targetscan.org)检索发现,miR-203a-5p 与Bcl-2 有潜在的结合位点;同时,荧光素酶报告显示,转染miR-203a-5p-模拟可明显降低Bcl-2-WT 的荧光素酶活性,对Bcl-2-MUT 没有影响,而miR-203a-5p-抑制剂则表现出相反作用,表明miR-203a-5p 与Bcl-2 存在靶向调节作用,见图1、表1。

图1 Targetscan 预测miR-203a-5p 与Bcl-2 mRNA 的互补配对系列
表1 荧光素酶报告基因实验结果(,n=9)
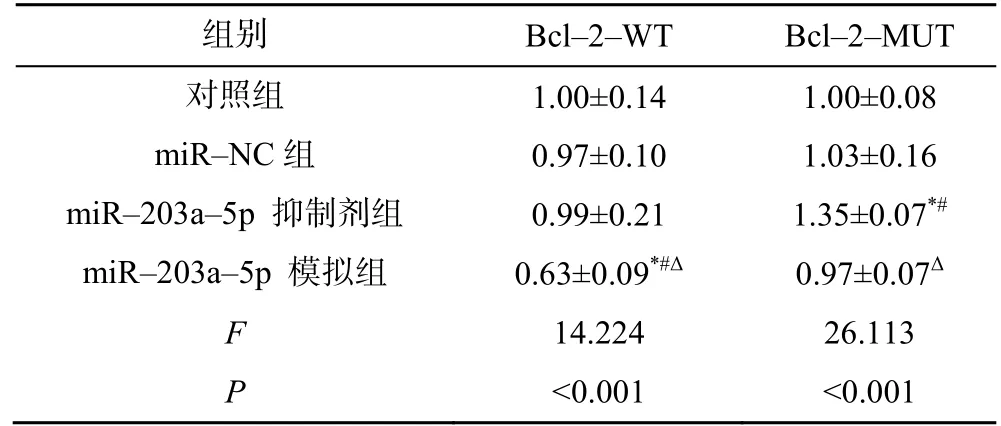
表1 荧光素酶报告基因实验结果(,n=9)
注:与对照组比较,*P<0.05;与miR-NC 组比较,#P<0.05;与miR-203a-5p 抑制剂组比较,ΔP<0.05
2.2 miR-203a-5p 和Bcl-2 mRNA 在组织中的表达
瘢痕疙瘩中 miR-203a-5p 表达低于正常皮肤[(0.54±0.05)vs.(0.89±0.15)](t=6.641,P<0.001);瘢痕疙瘩中 Bcl-2 mRNA 表达高于正常皮肤[(1.02±0.17)vs.(0.73±0.08)](t=4.567,P<0.001)。
2.3 转染miR-203a-5p 对KFs 细胞增殖、迁移和凋亡的影响
与对照组和miR-NC 组比较,miR-203a-5p 抑制剂组增殖率和迁移细胞数增加,细胞凋亡率降低(P<0.05);与对照组、miR-NC 组和miR-203a-5p抑制剂组比较,miR-203a-5p 模拟组增殖率和迁移细胞数降低,细胞凋亡率增加(P<0.05),见表2。
表2 转染miR-203a-5p 对KFs 细胞增殖、迁移和凋亡的影响(,n=9)
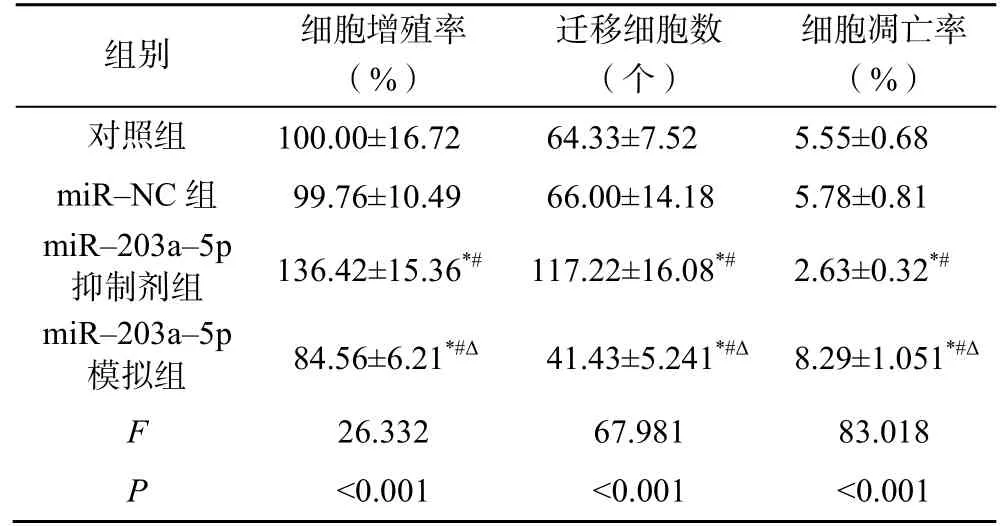
表2 转染miR-203a-5p 对KFs 细胞增殖、迁移和凋亡的影响(,n=9)
注:与对照组比较,*P<0.05;与miR-NC 组比较,#P<0.05;与miR-203a-5p 抑制剂组比较,ΔP<0.05
2.4 转染miR-203a-5p 对KFs 细胞Bcl-2、Bax 和Caspase-3 蛋白表达的影响
与对照组和miR-NC 组比较,miR-203a-5p 抑制剂组Bcl-2 蛋白表达升高,Bax 和Caspase-3 蛋白表达降低(P<0.05);与对照组、miR-NC 组和miR-203a-5p抑制剂组比较,miR-203a-5p 模拟组Bcl-2 蛋白表达降低,Bax 和Caspase-3 蛋白表达升高(P<0.05),见表3。
表3 转染miR-203a-5p 对KFs 细胞Bcl-2、Bax 和Caspase-3 蛋白的影响(,n=9)
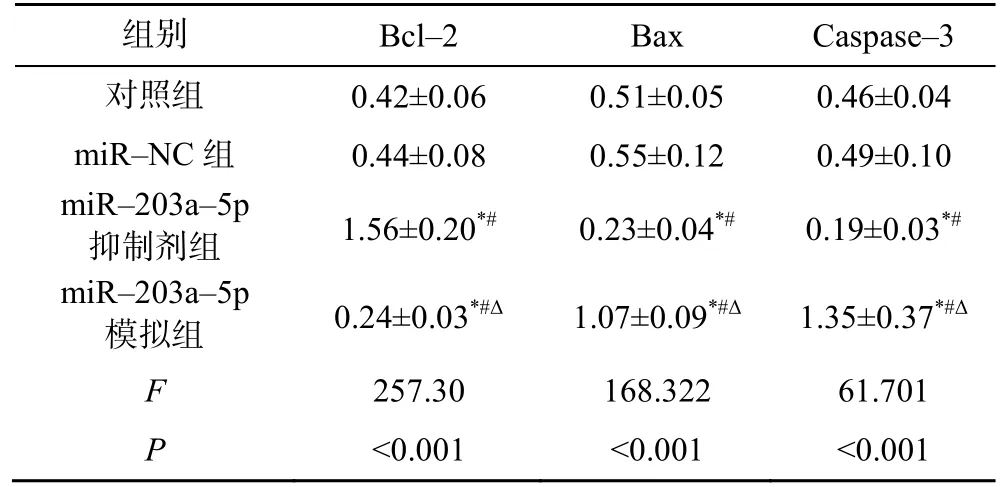
表3 转染miR-203a-5p 对KFs 细胞Bcl-2、Bax 和Caspase-3 蛋白的影响(,n=9)
注:与对照组比较,*P<0.05;与miR-NC 组比较,#P<0.05;与miR-203a-5p 抑制剂组比较,ΔP<0.05
2.5 转染miR-203a-5p 对KFs 细胞beclin-1、LC3Ⅱ和CollagenⅠ蛋白表达的影响
与对照组和miR-NC 比较,miR-203a-5p 抑制剂组beclin-1、LC3Ⅱ和collagen Ⅰ蛋白表达升高(P<0.05);与对照组、miR-NC 组和miR-203a-5p 抑制剂组比较,miR-203a-5p 模拟组beclin-1、LC3Ⅱ和Collagen Ⅰ蛋白表达降低(P<0.05),见表4 和图2。
表4 转染miR-203a-5p 对KFs 细胞beclin-1、LC3Ⅱ和CollagenⅠ蛋白的影响(,n=9)

表4 转染miR-203a-5p 对KFs 细胞beclin-1、LC3Ⅱ和CollagenⅠ蛋白的影响(,n=9)
注:与对照组比较,*P<0.05;与miR-NC 组比较,#P<0.05;与miR-203a-5p 抑制剂组比较,ΔP<0.05

图2 转染miR-203a-5p 对KFs 细胞beclin-1、LC3Ⅱ和collagenⅠ蛋白的影响
3 讨论
近年来研究发现,在瘢痕疙瘩形成过程中,miRNA 可调控成纤维细胞增生、迁移、凋亡和上皮-间充质转化(epithelial-mesenchymal transformation,EMT)。例如,下调miR-637 可通过靶向瘢痕疙瘩中的smad3 促进增生和转移[8]。瘢痕疙瘩中过量的ECM 成分,如胶原蛋白、纤维凝集素、弹性蛋白及蛋白酶抑制剂,是由KFs 积累所致。KFs 在病理性瘢痕中起重要作用,其增生促进颗粒组织形成,导致胶原合成增加[9]。过多的KFs 细胞增生和KFs细胞凋亡不足导致瘢痕疙瘩,但其发病机制尚不清楚。因此,进一步研究瘢痕疙瘩的细胞和分子机制可能对改善瘢痕疙瘩的临床治疗策略至关重要。MiR-152-5p 通过调控人KFs 细胞中smad3 的表达,抑制增生、迁移,促进凋亡[10]。本研究发现miR-203a-5p可能作为一种纤维化抑制因子,在瘢痕疙瘩组织中显著下调。此外,KFs 细胞参与了瘢痕疙瘩中ECM(如Collagen)沉积[11]。同时,通过转染miR-203a-5p发现,过表达的miR-203a-5p 能显著降低KFs 细胞中Collagen Ⅰ表达,提示miR-203a-5p 过表达能抑制瘢痕疙瘩的形成,随后的功能性实验也证实了上述结果,miR-203a-5p 过表达能抑制KFs 细胞增生和迁移,促进KFs 细胞凋亡,抑制miR-203a-5p 表达则作用相反。然后通过targetscan 分析确定Bcl-2为miR-203a-5p 的潜在靶标,荧光素酶报告证实了miR-203a-5p 与Bcl-2 存在靶向调节作用。
凋亡调控已被证明在伤口愈合过程中起重要作用,且主要与增生细胞清除有关。在瘢痕疙瘩和增生性瘢痕标本中均发现了凋亡抑制蛋白Bcl-2 的过表达,加之抗凋亡蛋白Bax 表达的缺失,可导致瘢痕疙瘩源性KFs 细胞增生和细胞存活时间延长[12]。Bcl-2拮抗剂的使用部分阻止了肠道KFs细胞的纤维形成,并降低了转化生子因子-β(transforming growth factor-β,TGF-β)诱导的KFs 细胞分化相关因子的表达,成为克罗恩病相关纤维化潜在治疗的选择[13]。同时,miR-30a-5p 过表达可通过靶向Bcl-2 诱导KFs细胞凋亡[14]。本研究在瘢痕疙瘩组织中检测到Bcl-2 mRNA 表达显著上调,通过转染miR-203a-5p 模拟后抑制Bcl-2 表达,促进Bax 和Caspase-3 表达,诱导KFs 细胞凋亡。
细胞自噬和细胞凋亡常发生在同一细胞中,决定细胞命运,KFs 细胞抗凋亡能力的增强是瘢痕疙瘩复发和侵袭的重要致病机制[15]。然而,目前关于KFs细胞自噬的相关报道较少。目前,beclin 1 在自噬领域的研究越来越广泛。在人类乳腺癌细胞中,beclin 1随着自噬体的增加而表达降低,促进细胞增生。此外,促进beclin-1 基因表达可抑制体外细胞自噬水平,抑制细胞增生[16]。最近的研究表明,凋亡相关蛋白Bcl-2 可以抑制自噬,通过BH3 结构域,Bcl-2与beclin 1 结合形成复合体,在自噬过程中被破坏[17]。同时,具有BH3 结构域的Bcl-2 家族成员之间(如Bax)通过与beclin 1 结合,抑制Bcl-2 与beclin 1结合,促进细胞自噬[18]。自噬过程中,LC3 结合体系的形成负责囊泡的延伸。LC3 通常由泛素产生,其残基经自噬相关基因4A(autophagy associated gene 4A,ATG4A)同源物催化作用暴露在囊泡膜表面,并在细胞质中形成LC3Ⅰ[19]。LC3Ⅰ可特异性结合磷脂酰乙醇胺在囊泡膜表面,最终形成LC3Ⅱ,并与自噬水平呈正相关。辐射通过下调自噬相关诱导因子beclin-1 和阻止LC3Ⅱ的形成来抑制自噬[20]。本研究中,通过转染miR-203a-5p 模拟后抑制KFs 细胞中beclin-1、LC3Ⅱ和CollagenⅠ蛋白表达。
综上所述,miR-203a-5p 在瘢痕疙瘩组织中低表达,通过基因干扰技术促进miR-203a-5p 表达能靶向抑制Bcl-2/beclin-1 通路的激活,抑制KFs 细胞增生和迁移,同时促进KFs 细胞凋亡。

