尿道致病性大肠杆菌毒力因子与其抗生素耐药性之间的关系
王景雨,周春雷,王猛,江雁,董贺楠,穆红
(天津市第一中心医院检验科,天津 300192)
尿道感染(UTI)是泌尿系统和肾脏疾病中最常见的细菌感染性疾病,也是非常严重的公共卫生问题,其发病率仅次于呼吸道感染,其高发病率和死亡率也导致了高昂的医疗费用[1-3]。尿道致病性大肠杆菌(UPEC)是造成尿道感染的主要原因[4-6]。由于泌尿系统生理结构的不同,UPEC更容易感染女性,在年轻女性中约90%的尿道感染是由UPEC引起的[7]。UPEC是一种大肠杆菌,它从肠道菌群的共生状态转移到尿道中生长并持续存在,在尿道中其表现出多种毒力因子并在尿道中定植,因此毒力因子在UPEC感染尿道过程中发挥关键的作用[2,8]。
大肠杆菌的重要毒力因子大致可分为细菌细胞表面毒力因子和分泌型毒力因子两大类。细菌细胞表面的毒力因子主要包括菌毛,主要是1型菌毛和P型菌毛。这些菌毛有助于UPEC黏附宿主细胞表面、侵袭组织、生物膜形成和细胞因子诱导。此外,细菌表面毒力因子还包括鞭毛、荚膜脂多糖和外膜蛋白。CNF1、HlyA和铁载体则是其分泌型的毒力因子[9-10]。FimH是大肠杆菌中1型菌毛中发挥黏附功能的部分[11]。尽管宿主的防御机制在有效运作,但是这些毒力因子使细菌在泌尿道定植并持续存在方面发挥着重要的作用[12]。
近些年来由于广谱抗生素在临床上的广泛应用,导致临床上出现越来越多的细菌耐药情况,并且这一情况受到了广泛的关注和重视[13-14]。耐药细菌中以检出率不断上升的耐药革兰阴性杆菌为代表,例如UPEC,这类细菌的出现以及快速繁殖,严重地影响了临床的抗感染治疗[15-16],也成为医院感染控制的重点和难点[17]。UPEC中耐药菌株的出现,尤其是多药耐药菌株的出现,加剧了其对全球人类身体健康的威胁[13-14,18]。然而,UPEC毒力因子的表达与其耐药性之间的关系仍需深入的探究。因此,进一步了解UPEC的毒力因子基因表达情况和抗生素耐药性情况以及二者之间的相关性对本地区UTI患者的管理和治疗至关重要。因此,本研究旨在检测UTI患者尿液中UPEC分离株不同毒力标志因子的表达情况,并探究毒力基因与抗菌药物耐药性之间的相关性。
1 资料与方法
本研究是一项前瞻性研究,于2020年10月—2021年9月在天津市第一中心医院临床科室的配合下完成。在此期间,收集84例被诊断为由E.coli引起UTI的患者尿液样本,并从中分离出相应的UPEC。在医生或护士的指导下,清洁患者外阴并采集早晨7:00-8:00中段尿液,用无菌采样管送检。对患者尿液标本进行培养和细菌分离,并采用标准微生物学方法鉴定为E.coli,然后对分离菌株进行药敏分析。入组标准:UTI诊断标准参照《医院感染诊断标准》[19],入选所有患者均符合UTI诊断标准[20]。样本排除标准:(1)样本污染。(2)尿液培养结果中出现3种或3种以上病原菌生长。(3)剔除来自同一患者分离的重复菌株及药敏试验结果,将同一患者尿液样本培养分离的第一株UPEC及其药敏试验结果纳入统计分析。
1.1 细菌的培养鉴定和药物敏感性检测 尿液样本中细菌的培养分离、细菌鉴定均严格按照《全国临床检验操作规程》第3版[21]操作,药敏试验根据临床和实验室标准协会(CLSI)的指南进行操作。使用10 μL定量接种环进行标本的接种培养,取中段尿液在血平板和中国蓝培养基表面分区画线接种,于35℃条件下培养24~48 h后观察细菌生长情况,并进行菌落计数、涂片和革兰染色。单克隆革兰阴性杆菌≥105CFU/mL,即初步认定为是有临床意义的阳性尿液培养。从中国蓝平板挑选单个菌落采用法国梅里埃公司VITEK®MS全自动微生物质谱检测系统或全自动微生物分析仪VITEK 2 compact及配套的鉴定卡和药物敏感卡进行菌种鉴定和药物敏感试验。质控菌株是大肠埃希菌ATCC25922。
1.2 毒力基因检测 收集过夜培养的细菌培养物2 mL,使用细菌DNA提取试剂盒(DP302,TIANGEN,北京)提取细菌基因组DNA。提取的基因组DNA溶解在无菌水中,使用Nanodrop分光光度计(Thermo Fisher,Waltham,MA,USA)测量浓度,并于-20℃保存。通过PCR实验,利用特异性引物对所有分离的UPEC菌株进行cnf1、hlyA、fimH 3种毒力标志因子基因的检测。PCR产物在2%琼脂糖凝胶上进行凝胶电泳分析,使用琼脂糖凝胶成像系统(Bio-Rad,USA)观察PCR实验结果。引物序列以及PCR扩增条件见表1。

表1 PCR检测的引物和循环条件Tab 1 Primers and cycling conditions for the PCR assays
1.3 统计学处理 使用Microsoft Excel 2016收集数据并录入数据库,计数资料以例数或百分比表示。采用SPSS 16.0软件进行统计分析,分类变量比较采用χ2检验。计算关系强度及其95%置信区间。P<0.05为差异有统计学意义。
2 结果
2.1 毒力标志基因表达情况分析 通过PCR分别扩增cnf1、hlyA和fimH毒力标志基因,扩增片段分别为498、1 177和508 bp。部分代表性UPEC菌株的基因组PCR产物琼脂糖凝胶结果如图1所示。在分离的84例UPEC菌株中,fimH是最普遍的毒力标志基因(n=69,82.14%),其次是cnf1(n=10,11.90%)和hlyA(n=9,10.71%)。
图1 部分代表性大肠杆菌分离株中cnf1(a)、hlyA(b)和fimH(c)基因的检测Fig 1 Detection of cnf1(a),hlyA(b)and fimH(c)gens in some representative E.coli isolates
2.2 抗菌药物敏感情况分析 除厄他培南、亚胺培南和美罗培南外,所有分离的UPEC对其他抗菌药物均有不同程度耐药性,其中对头孢呋辛(58.33%)、头孢呋辛酯(61.90%)、头孢曲松(52.38%)、左氧氟沙星(89.29%)、复方新诺明(65.48%)耐药性较高,耐药率均>50%;对哌拉西林/他唑巴坦(9.52%)、头孢哌酮/舒巴坦(5.95%)、厄他培南(0.00%)、亚胺培南(0.00%)、阿米卡星(1.19%)、替加环素(3.57%)、美罗培南(0.00%)敏感性较高,耐药率均<10%,见表2。

表2 UPEC对抗菌药物的敏感率和耐药率(%)Tab 2 Sensitivity rate and resistance rate of UPEC to antibiotics(%)
2.3 ESBL产生情况分析ESBL是一类能水解青霉素类、头孢菌素类以及单环类抗生素的β-内酰胺酶,其活性能被某些β-内酰胺酶抑制剂抑制。产生ESBL的细菌可对上述多种抗生素产生耐药。本研究中分析了ESBL在UPEC中的产生情况,结果如表3所示,84例UPEC菌株中ESBL阳性率为53.57%(n=45)。进一步分析了毒力基因阳性UPEC分离株与相应阴性UPEC分离株的ESBL产生情况(表3),结果显示cnf1+UPEC分离株ESBL阳性率为60.00%(n=6),cnf1-UPEC分离株ESBL阳性率为52.70%(n=39)(P=0.666);hlyA+UPEC分离株ESBL阳性率为77.78%(n=7),hlyA-UPEC分离株ESBL阳 性 率 为50.67%(n=38)(P=0.123);fimH+UPEC分离株ESBL阳性率为55.07%(n=38),fimH-UPEC分离株ESBL阳性率为46.67%(n=7)(P=0.554)。

表3 毒力基因阳性与阴性UPEC的ESBL比较[n(%)]Tab 3 Comparison of ESBL between virulence gene positive and negative UPEC[n(%)]
2.4 UPEC毒力基因与抗生素耐药性的关系 笔者进一步分析毒力标志基因与UPEC菌株抗生素耐药性之间的关系,如表4所示,相较于cnf1-UPEC对阿莫西林/克拉维酸的耐药率(24.32%),cnf1+UPEC的耐药率(70.00%)显著提高(P=0.003)。此外,虽然没有统计学差异,但是cnf1+UPEC对哌拉西林/他唑巴坦(20.00%)、头孢呋辛(70.00%)、头孢西丁(40.00%)、头孢哌酮/舒巴坦(10.00%)、头孢吡肟(50.00%)、左氧氟沙星(100.00%)的耐药率均高于cnf1-UPEC(分别为8.11%、56.76%、18.92%、5.41%、40.54%和87.84%)。而对头孢呋辛酯、头孢他啶、头孢曲松的耐药率,cnf1+UPEC和cnf1-UPEC相差不大。同样发现hlyA+UPEC对阿莫西林/克拉维酸的耐药率(78.78%)显著高于hlyA-UPEC的耐药率(24.00%)(P=0.001)。尽管差异没有显著性,但是hlyA+UPEC对哌拉西林/他唑巴坦(22.22%)、头孢呋辛(77.78%)、头孢呋辛酯(77.78%)、头孢他啶(55.56%)头孢曲松(66.67%)、头孢哌酮/舒巴坦(11.11%)、头孢吡肟(66.67%)的耐药率均高于hlyA-UPEC(分别为8.00%、54.67%、58.67%、36.00%、49.33%、5.33%和38.67%),而对头孢西丁、左氧氟沙星、复方新诺明的耐药率二者相差不大。fimH+UPEC对头孢呋辛(60.87%)、头孢呋辛酯(63.77%)、头孢哌酮/舒巴坦(7.25%)、头孢吡肟(44.93%)、左氧氟沙星(91.30%)、复方新诺明(68.12%)的耐药率均高于fimH-UPEC(分别为46.67%、53.33%、0.00%、33.33%、80.00%和53.33%)(无统计学差异),而对阿莫西林/克拉维酸、哌拉西林/他唑巴坦、头孢西丁、头孢他啶、头孢曲松、头孢哌酮/舒巴坦的耐药率二者相差不大。
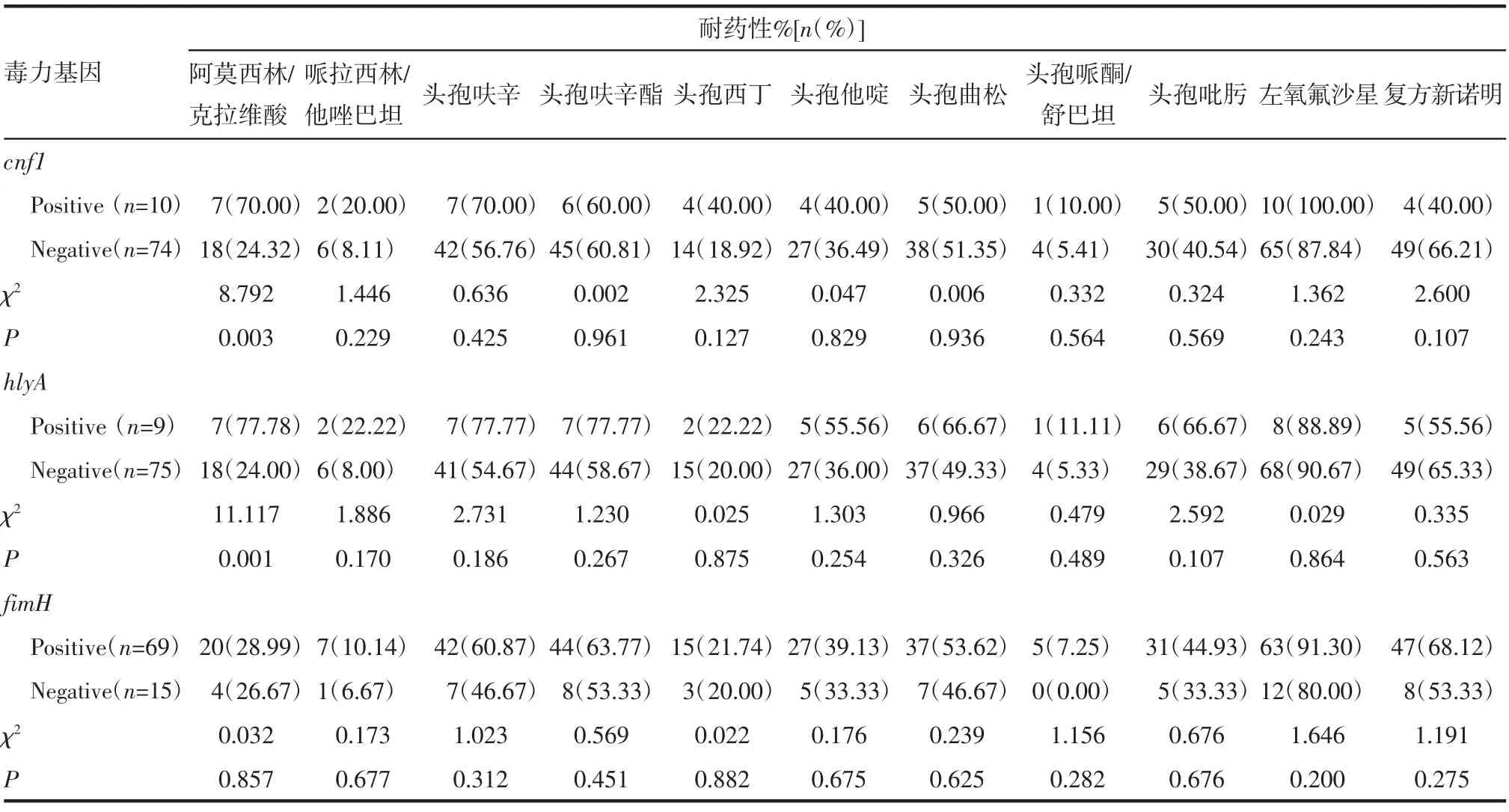
表4 UPEC毒力标志基因与耐药性的关系Tab 4 Relationship between antimicrobial resistance and virulence marker genes in UPEC
3 讨论
UTI已经成为全球最主要的感染性疾病之一,而如今国内抗生素的广泛使用,甚至是滥用也导致了病原菌对抗生素的耐药性增加,进而不断增加UTI患者的治疗难度[22-23]。UPEC作为UTI的主要致病因素,其表达一系列毒力因子增加其致病作用[8]。然而UPEC菌株的毒力因子表达特征与其抗生素耐药模式之间的关系尚不清楚。因此,深入了解UPEC毒力标志基因的表达与其耐药性之间的关系不仅有助于正确管理和治疗UTI患者,并且有益于预防耐药菌的产生和传播。
本研究尿液中分离出UPEC的84例UTI患者年龄从18岁到92岁不等,其中以50~69岁(28例,33.33%)年龄段患者居多,年龄≥50岁患者样本71例(84.52%),年龄<50岁患者样本13例(15.48%)。84例UTI患者中男性20例(23.81%),女性64例(76.19%),女性样本比例(76.19%)明显高于男性(23.81%)。此外,女性患者年龄集中于50~89岁(48人,75%),男性患者年龄集中于60~89岁(14人,70%)。这些数据与现有的研究一致,表明女性更容易被UPEC感染,且年龄是重要的危险因素。
笔者对UTI患者尿液中分离出来的UPEC抗生素的耐药性分析表明,UPEC分离株对抗生素存在不同程度的耐药性,尤其对头孢呋辛、头孢呋辛酯、头孢曲松、左氧氟沙星、左氧氟沙星有较高的耐药率(>50%)。此外,ESBL在本研究所有UPEC分离株中的产生率为53.57%,而其他研究表明,ESBL在UPEC中的产生也有类似的普遍性[24-25]。尽管本研究显示ESBL在hlyA+UPEC、cnf1+UPEC以及fimH+UPEC分离株中ESBL的产生率均高于其相应的阴性菌分离株,但遗憾的是该实验结果差异没有统计学意义,因此该结果仅提示cnf1、hlyA或fimH毒力因子阳性UPEC分离株相较于阴性UPEC菌株可能产生更高的耐药性风险。Jadhav等[26]报道ESBL在UPEC分离株中发生率较低(21.3%),而在本研究中,较高的ESBL产生率可能是由于在我国部分抗生素作为非处方药物非常容易获得而导致的。
从毒力标志因子的表达情况来看,在收集的84例UPEC分离株中,84.52%(n=71)UPEC分离株中检测到了一种或多种毒力因子的表达,其中11.90%(n=10)UPEC表达cnf1,10.71%(n=9)UPEC表达hlyA,82.14%(n=69)UPEC表达fimH。有研究表明UPEC分离株中普遍表达CNF1,并且CNF1被证明可以激活Rho GTPases,从而促进尿路上皮细胞侵袭,并对尿路上皮细胞具有细胞毒性作用[27-28]。溶血素HlyA可以针对多个宿主途径以促进感染[29]。FimH在UPEC的黏附过程发挥重要作用[11]。通过药物敏感实验分析发现,相较于阴性UPEC,cnf1+UPEC和hlyA+UPEC对阿莫西林/克拉维酸的耐药性显著增加(P<0.05),表明UPEC表达毒力基因cnf1或hlyA可以显著提高其对阿莫西林/克拉维酸的耐药性。此外,尽管没有显著性差异,但观察到cnf1+UPEC和hlyA+UPEC对多种其他抗生素的耐药率均高于相应的阴性UPEC。同样,fimH+UPEC对头孢呋辛、头孢吡肟、左氧氟沙星以及复方新诺明的耐药率均高于fimH-UPEC(无统计学差异)。在本研究中,由于收集UPEC分离株样本数量较少,导致部分实验结果差异没有统计学意义,但是这些结果可以提示cnf1、hlyA或fimH的表达可能与UPEC对多种抗生素耐药性的增加具有相关性。
为了解决UPEC的多药耐药以及日渐增加的耐药率问题,控制医院UPEC的暴发流行,需要进一步了解本院UPEC的耐药情况并制定出行之有效的用药和治疗方案,以便为临床经验用药以及UPEC感染患者提供合理可行的治疗策略。因此,深入分析本院临床UPEC毒力因子基因的表达情况及其与抗生素耐药性之间的关系,对于了解UPEC引起的感染特征以及UTI患者临床治疗至关重要。对于UPEC的毒力因子基因的表达以及其耐药情况了解越多,就越能合理地采取措施对感染患者进行更为精准的药物治疗并有效控制多药耐药UPEC菌株的传播。本研究发现,UPEC的毒力因子的表达与其抗生素耐药率增加具有相关性。因此,建议临床将cnf1、hlyA、fimH 3种毒力标志基因作为UPEC感染患者的常规检测项目,以便于临床根据UPEC毒力因子基因的表达情况预测其耐药情况,从而对感染患者进行合理的经验用药。此外,检测毒力因子基因的表达情况还助于进一步了解UPEC的致病性并对UTI患者实施更为科学、合理和有效的治疗策略以及对临床UPEC菌株的管理和控制,从而减少抗生素的不合理使用并有效抑制抗生素耐药菌的医院内传播。
本研究中有几个可能会使结果产生偏见的限制。首先,本研究是一项针对天津市第一中心医院UTI患者尿液中分离出的UPEC菌株进行的单中心研究,因此仍需要进行多中心样本的深入研究。其次,由于本研究收集的样本数量较少,导致UPEC毒力因子基因表达与一些抗生素耐药性之间的相关性并不显著,因此需要扩大样本量进一步研究。

