合作猪HMOX1基因过表达载体构建及组织表达分析
李建荣,王 伟,罗定国,马晓霞,徐美玲,滚双宝,2,杨巧丽
(1甘肃农业大学动物科学技术学院,甘肃兰州 730070;2甘肃省现代养猪技术工程研究中心,甘肃兰州 730070)
0 引言
合作猪是中国高原型地方猪种藏猪的一个类群[1],因其主产于甘肃省甘南藏族自治州的合作市而得名。甘南藏族自治州地处甘肃省西南部,境内多为高山丘陵,平均海拔3000 m以上,年平均气温1~9℃,最高气温27.7℃,最低气温-28.5℃,植被覆盖率达70%~80%[2]。这种自然环境条件使得合作猪形成了极强的适应高原气候环境和耐粗饲特性[3]。高海拔低压造成的缺氧是动物对高原环境适应的最大阻碍。有研究表明,中国特有高原型地方猪种藏猪已经进化出了适应高原缺氧环境的生理特征和在长期进化过程中形成了独特的低氧适应策略,如肺泡间隔较厚、肺泡隔内毛细血管丰富、心脏较大且心肺功能相对发达和血红蛋白含量高等[4-5],其高海拔低氧适应能力明显优于其他猪种。开展藏猪低氧遗传适应性研究,对其种质资源的保护、开发和利用以及防止人类低氧损伤和促进低氧适应的医学措施具有重要的意义。
高原动物低氧适应能力很大程度上取决于机体对氧的结合、转运与代谢的特殊功能,肌红蛋白(myoglobin,Mb)、血红蛋白(hemoglobin,Hb)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞代谢相关酶等细胞因子及蛋白的调控是机体适应低氧环境的关键因素。相关研究表明,促红细胞生成素(erythropoietin,EPO)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的表达与藏猪的低氧适应性有关[6-7]。这些研究对探讨藏猪低氧适应性形成的遗传机制奠定了基础。
血红素加氧酶1(Heme oxygenase 1,HMOX1)是血红素分解代谢过程中的一种应激型诱导酶,能够催化血红素分解生成游离铁、一氧化碳和胆绿素[8],其本身及代谢产物可通过血管紧张度、抗氧化损伤和弱化低氧胁迫对细胞损伤等方式参与细胞对低氧的适应性调节过程[9-11]。目前有关HMOX1基因在动物高海拔低氧适应方面的研究相对较少。何建文等[12]研究发现,藏绵羊HMOX1基因表达及其多态性与低氧适应性存在关联。李艳丽等[13]研究发现HMOX1基因可通过抗细胞凋亡在斑马鱼低氧应激中发挥保护作用。Zhang等[14]研究发现,HO1在牦牛肺组织代谢中发挥重要功能,其基因的分子特征具有适应高海拔生境的潜力。在猪上,目前仅见王伟等[15]对合作猪HMOX1基因做了克隆和蛋白功能预测分析,但合作猪HMOX1基因功能和不同组织中的表达模式尚不清楚。
因此,本研究旨在构建pcDNA3.1-HMOX1过表达载体,并分析HMOX1基因在合作猪不同组织中的表达模式,为进一步研究HMOX1基因功能和探讨合作猪低氧适应性中的分子作用机制奠定基础。
1 材料与方法
1.1 试验动物与样品采集
在甘南藏族自治州合作市选取3头12月龄,体重接近的成年合作藏猪,屠宰后迅速采集心、肝、脾、肺、肾、胃、十二指肠和背最长肌等组织样品,液氮速冻后带回实验室,-80℃保存。试验于2021年3—5月份在甘肃农业大学动物科学技术学院动物遗传与营养实验室进行。
1.2 主要试剂
TransZol Up试剂购自北京全式金生物技术有限公司;大肠杆菌DH5ɑ感受态细胞、2×Taq PCR Master Mix PCR扩增酶、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购自北京天根生化科技有限公司;pMD™19-T载体、限制性内切酶QuickCut™ Nhe I和QuickCut™Xho I、T4 DNA Ligase、DNA Marker均购自 TaKaRa(大连)有限公司;pcDNA3.1(+)载体购自Promega公司;荧光定量试剂盒SYBR®Green Premix Pro Taq HS qPCR Kit和反转录试剂盒Evo M-MLV RT Kit with gDNA Clean for qPCR购自湖南艾科瑞生物工程有限公司;琼脂粉、氨苄青霉素、X-Gal、IPTG均购自Solarbio公司;胰蛋白胨、酵母提取物购自OXOID公司。引物合成和测序由苏州金唯智生物科技有限公司完成。
1.3 引物设计及合成
参照GenBank中猪HMOX1基因序列(NM_001004027.1),应用Primer-BLAST在线软件设计HMOX1基因CDS区特异性扩增引物,预期扩增目的片段长度924 bp。引物送苏州金唯智生物科技有限公司合成,序列见表1。

表1 HMOX1基因CDS区扩增引物
1.4 总RNA提取和cDNA合成
采用TransZol Up试剂盒提取合作猪各组织的总RNA。提取的总RNA浓度和纯度检测合格后,稀释至500 ng/μL,-80℃保存。
按照Evo M-MLV RT Kit with gDNA Clean for qPCR试剂盒说明书进行两步法反转录反应,第一步去除基因组DNA,反应体系:5×gDNA Clean Buffer 2 μL,gDNA Clean Reagent 1μL,总 RNase Free water 5 μL,各组织的RNA 2 μL,混匀后42℃反应2 min。第二步反转录,反应体系:第一步反应混合液10 μL,5×RTase Reaction Buffer Mix I 1 μL,Evo M-MLV RTase Enzyme Mix 1 μL,RNase Free water补足至 20 μL,混匀后37℃反应15 min,85℃反应5 s,4℃保存。
1.5 载体构建
采用普通PCR扩增合作猪HMOX1基因CDS区全长序列,反应总体系20 μL,包括2×Taq PCR Master Mix 10 μL,cDNA 模板 2 μL,上、下游引物各 1 μL,RNase free water补足至20 μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸60 s,共35个循环;72℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测。目的条带切胶后将PCR产物利用琼脂糖凝胶DNA回收试剂盒进行回收纯化,并连接到pMD19-T载体进行测序,将成功连接的阳性克隆菌液扩大培养,提取质粒。然后用限制性内切酶QuickCut™ Nhe I和 QuickCut™ Xho I对 pcDNA3.1 空载体和T载体阳性质粒同时进行双酶切,将酶切回收产物用T4 DNA连接酶16℃过夜连接。将连接好的重组载体进行转化、单克隆筛选、菌液PCR检测、质粒DNA提取,并对提取好的质粒进行双酶切和测序鉴定。将测序正确的重组质粒命名为:pcDNA3.1-HMOX1。
1.6 组织表达分析
采用实时荧光定量PCR检测HMOX1基因在合作猪心、肝、脾、肺、肾、胃、十二指肠和背最长肌8个组织中的mRNA表达量,引物信息见表2,以β-actin基因为内参。应用LightCycler480 Ⅱ System进行实时荧光定量PCR检测,反应体系为:上、下游引物各0.8 μL,cDNA模板(100 ng/μL)2 μL,2×SYBR®Green Pro Taq HS Premix 10 μL,加水补足至20 μL。PCR扩增条件为:95℃变性5 s,95℃预变性30 s,60℃退火30 s,40个循环。每个组织做3个样品重复,每个样品同批次做3个复孔,以 2-ΔΔCt法计算相对表达量。

表2 荧光定量PCR引物信息
1.7 数据统计分析
本研究结果用IBM SPSS 21.0软件进行数据显著性分析,两两比较采用独立样本T-test,多组比较采用单因素方差分析(One Way ANOVA),相对表达量采用2-ΔΔCt计算法。
2 结果与分析
2.1 合作猪HMOX1基因CDS区扩增
通过PCR扩增方法获得了HMOX1基因完整CDS区,如图1所示,目的条带清晰、单一,与预期扩增大小924 bp相符,说明本试验成功克隆出了合作猪HMOX1基因。

图1 合作猪HMOX1基因克隆
2.2 合作猪HMOX1基因真核表达载体构建
首先将HMOX1基因PCR扩增产物进行琼脂糖凝胶回收纯化,然后将产物连接到pMD19-T载体,挑取的阳性克隆菌落菌液PCR初步检测结果见图2A;对阳性克隆菌液进行质粒提取,通过双酶切和测序发现,PCR扩增产物已连接到T载体(图2B)。随后,将阳性克隆T载体质粒和pcDNA3.1(+)空载体分别进行双酶切,用T4 DNA连接酶将酶切产物进行连接,随后经转化、单克隆筛选、双酶切和测序鉴定,结果见图2C,酶切产物两条带分别与空载体和目的条带大小相符,说明本试验成功构建了pcDNA3.1-HMOX1过表达载体。

图2 合作猪HMOX1基因真核表达载体构建
2.3 合作猪HMOX1基因组织表达分析
采用实时荧光定量PCR检测HMOX1基因在合作猪心、肝、脾、肺、肾、胃、十二指肠和背最长肌8个组织中的表达水平,由图3可见,HMOX1基因的表达量在合作猪脾脏组织中最高,其表达量显著高于其它组织(P<0.05);其次表达量从高到低依次为肝脏、肺脏、肾脏、心脏、胃和背最长肌;在十二指肠中的表达量最低,显著低于其它组织(P<0.05)。
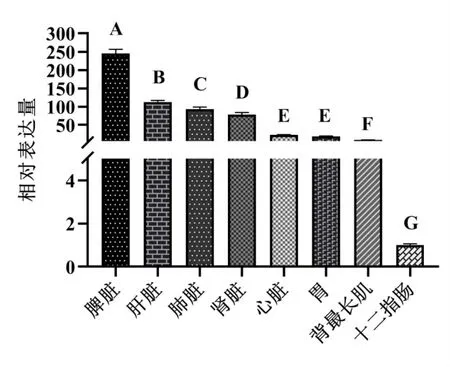
图3 合作猪HMOX1基因组织表达分析
3 讨论
3.1 合作猪HMOX1基因组织表达分析
HMOX1是一个应激诱导型基因,其在机体低氧、氧化应激等条件下被诱导表达,并通过调控抗氧化反应元件的相关基因和酶的表达保护细胞损伤[16.-17]。HMOX1可通过稳定缺氧诱导因子-1α保护缺血介导的细胞损伤[18];此外,HMOX1也可作为Nrf2的下游氧化应激相关基因,参与氧化应激状态下对细胞的保护[19]。付书林等[20]研究发现,在脂多糖诱导的仔猪血管内皮细胞中,黄芩苷可以显著影响HMOX1、CYP1A1和CCL5等基因的表达,从而抑制Toll样受体信号通路、肿瘤坏死因子信号通路、NOD样受体信号通路和趋化因子信号等通路,进而调节炎症反应。这些研究说明,HMOX1在机体抗氧化应激、抗炎症反应和低氧耐受的分子机制中发挥着重要作用。
诸多研究表明,HMOX1主要表达于肝脏、脾脏、肺脏和肾脏等器官。本研究中HMOX1基因在合作猪不同组织中的表达采用实时荧光定量PCR方法检测,发现其在脾脏中的表达量最高,其次是肝脏、肺脏和肾脏。陶文庭[21]等经研究发现HMOX1基因在斑马鱼多个组织中均有表达,且在肝脏、脾、肾中的表达量较高,在皮肤和肌肉中表达量较低。何建文等[12]研究发现,HMOX1基因在藏绵羊脾脏组织中的表达量最高,且其表达量与血红蛋白含量呈正相关,其次是肝脏和肾脏组织表达量较高,而HMOX1基因表达水平最高的是在湖羊皮下肺脏和脂肪中。说明HMOX1基因在高原动物不同组织中的表达趋势一致,均在脾脏表达最高,与本文研究结果基本一致
HMOX1属于一种诱导型反应蛋白,生理情况下,HMOX1在脾脏以外的组织中呈低表达,在重金属离子、过氧化氢、低氧、内毒素、一氧化氮及其底物血红素的诱导下其表达均可上调[22]。在缺氧状态诱导下,HMOX1在不同种属和不同类型组织细胞中的表达存在差异[9]。肝脏和脾脏是机体贮藏血液的器官,当机体处于失血和缺氧等应激状态时,其将血液排送到血液循环中,以调节血容量。在大鼠和斑马鱼上也有报道,HMOX1基因在脾脏和肝脏中的表达最高[13,23]。刘燕等[24]对合作猪血液生理生化指标测定发现,生活在高海拔低氧环境下合作猪的红细胞和血红蛋白含量显著高于低海拔地区的巴马香猪。对高原土著动物而言,血液中的红细胞和血红蛋白含量越高,携带运输氧气的能力越强,有利于更好地适应高原低氧环境。刘秀[25]等在HMOX1基因Exon3区检测到c.3650+30C>T、c.3650+41T>C、c.3750-14 G>A 和 c.3650+30G>A 4个SNPs,该区域多态性将影响藏绵羊HGB、HCT、SO2和PCO2等血液指标的变化,其中c.3650+30G>A位点有增加HGB、HCT和SO2值的趋势,可以使藏绵羊更好的适应低氧环境。说明合作猪在长期处于高原低氧状态环境下,HMOX1基因通过不同方式影响脾脏、肝脏、肺脏和肾脏等组织器官,加速血红素的代谢,提高氧气输送效率,使机体在低氧条件下,实现对高原低氧环境遗传适应。
3.2 合作猪HMOX1基因过表达载体构建
对于基因功能的研究,通常在细胞水平进行敲低和过表达处理。陈敬林[22]等经研究成功构建了pcDNA3.1-HMOX1重组质粒,并在DH5α大肠杆菌中表达,从电泳及测序比对两方面进行验证,从而保证目的基因的正确性,为后续进一步研究HMOX1的功能及其作用机制奠定了基础。目前多数研究认为,HMOX1基因在体内是保护因子的一种,在抗炎、抗氧化应激以及免疫调节方面起到至关重要作用。但是有关合作猪低氧胁迫下的适应性分子机制的研究少见报道。王逸群[26]等成功克隆了山羊NR1D1基因的CDS区并构建了真核表达载体,将重组质粒转染至HEK293T细胞后,验证了NR1D1在mRNA和蛋白水平的过表达。基于前期研究基础,本研究成功克隆出了合作猪HMOX1基因CDS全长序列,并将其插入到pcDNA3.1(+)过表达载体,成功构建了pcDNA3.1-HMOX1过表达载体,这将对进一步在细胞水平探究HMOX1基因功能提供试验保证,为揭示合作猪低氧适应中的分子作用机制奠定了良好的基础。
4 结论
本研究克隆了合作猪HMOX1基因CDS区序列,并成功构建pcDNA3.1-HMOX1过表达载体。HMOX1基因在合作猪脾脏组织中的表达量最高,其次表达量从高到低依次为肝脏、肺脏、肾脏、心脏、胃和背最长肌,在十二指肠中的表达量最低。本研究结果可为进一步研究HMOX1基因功能提供参考,为揭示合作猪适应高海拔低氧环境的分子调控机制奠定基础。
——一道江苏高考题的奥秘解读和拓展

