橄榄苦苷对缺血再灌注大鼠心肌应激性炎症损伤的保护作用①
曹位平 郭建淑 冯文静 钟元缘 宋雷英 陈 明 (乐山市人民医院心内科,乐山 614000)
心肌缺血/再灌注损伤(ischemia/reperfusion injury,I/RI)是急性心肌梗死患者恢复冠状动脉正常血流灌注时,心肌组织损伤加重的病理过程,常发生于心内直视手术、冠状动脉介入治疗等术后[1]。既往研究显示,I/RI的发生与大量释放的炎症介质、氧自由基、细胞内钙超载、细胞自噬、细胞凋亡等有关[2-3]。缺血/再灌注(ischemia/reperfusion,I/R)过程中持续的炎症反应可诱导心肌组织细胞凋亡和血管内皮功能障碍,导致心肌组织损伤,诱导心室重塑、左室功能障碍[4]。目前,临床医师主要采用抗炎、抗氧化、改善能量代谢等相关药物治疗,具有一定疗效,但仍有部分患者治疗效果并不理想[5]。橄榄苦苷(oleuropein,Ole)是从天然植物油橄榄叶中提取的一种有效活性成分,具有较强的抗氧化、抗细菌和抗病毒作用[6]。既往研究显示,Ole可抑制I/RI大鼠的心肌组织炎症反应,减轻心肌组织损伤,但其具体作用机制尚不明确[7]。因此,本研究分析Ole减轻大鼠I/RI的作用及可能的作用机制,旨在为其临床治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器 光学显微镜(型号Bx50F4)购自日本Olympus公司;生物机能测量仪(BL-420F型)购自成都泰盟科技有限公司;彩色多普勒超声便携仪(GE VividⅠ型)购自美国GE公司;二氧化碳培养箱(MCO-17AIC)购自日本SANYO公司。
1.1.2 主要试剂 Ole购自上海陶素生化科技有限公司,纯度99.95%,大鼠推荐剂量40 mg/kg,p.o.;依达拉奉(edaravone,EDA)购自山东新华制药股份有限公司,国药准字:H20203037;肌酸激酶同工酶(creatinekinase Mb,CK-Mb,货号:B20113)、心肌肌钙蛋白Ⅰ(Cardiac troponinⅠ,cTnⅠ,货号:1535721445)、乳 酸 脱 氢 酶(lactic dehydrogenase,LDH,货 号:B20632)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST,货号:1529778953)均购自上海江莱生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD,货号:EY-5082)、谷胱甘肽(glutathione,GSH,货号:EY-5214)、丙二醛(malondialdehyde,MDA,货号:EY-elisa5989)、TNF-α(货号:EYelisa-1775)ELISA试剂盒购自上海一研生物科技有限公司;RNA提取试剂盒(货号:R6688-01)、反转录试剂盒(货号:K1622)购自北京智杰方远科技有限公司;引物由上海生工生物工程合成;兔抗鼠IL-10、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、TNF-α抗体和辣根过氧化酶(horseradish peroxidase,HRP)标记的羊抗兔二抗均购自美国CST公司。
1.2 方法
1.2.1 动物分组及造模 SPF级雄性SD大鼠48只,体质量(260±20)g,由四川省人民医院实验动物研究所提供,动物许可证号:SCXK(川)2018-15,饲养于四川省人民医院动物中心实验室(室温恒定25℃,模拟昼夜光照),自由摄食与饮水。
48只大鼠预饲养1周后,参考已有文献采用结扎左冠状动脉前降支法制备I/RI模型[8]。大鼠常规麻醉,打开胸腔和心包后,在肺动脉圆锥与左心耳交界处,采用线栓结扎距离冠状动脉左前降支下缘2 mm处,缺血30 min后打开线栓,恢复冠状动脉的血流灌注,关闭心包和胸腔,心电图显示结扎后ST段下降1/2以上视为造模成功。随后将大鼠随机分为对照组(对照组只打开胸腔和心包,不结扎冠状动脉)、I/RI组、Ole组和EDA组(阳性对照组),每组12只。
1.2.2 动物给药干预 恢复灌注即刻,Ole组大鼠灌胃剂量为40 mg/(kg·d)的Ole,连续灌胃14 d;EDA组腹腔注射剂量为6 mg/(kg·d)的EDA。对照组和模型组分别灌胃给予等体积生理盐水。
1.2.3 大鼠心功能检测 造模15 d,采用生物机能测量仪检测大鼠心率(heart rate,HR)和左心室收缩压(left ventricular systolic pressure,LVSP);采用彩色多普勒超声便携仪检查左心室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(fraction shortening,FS)。
1.2.4 标本采集 分别于造模第1、3、6、9、12和15天,经眼球静脉丛取血100µl,3 000 r/min离心10 min,取血清,-20℃冰箱保存用于血清TNF-α检测。造模第15天,分离腹主动脉血1 ml,3 000 r/min离心10 min,取血清,-20℃冰箱保存用于血清CKMb、LDH、cTnⅠ和AST检测。取血后,再次结扎冠状动脉前降支,经颈静脉注入2 ml质量分数为1%的伊文思蓝溶液,待大鼠口唇及肢体变蓝,分离左心室组织,切片,进行TTC染色,经Image-pro Plus软件分析心肌梗死面积。分离心脏,一部分采用4%多聚甲醛固定,另一部分于-80℃冰箱保存。
1.2.5 HE染色检测心肌病理 取甲醛固定的心肌组织,进行常规切片,采用HE染色,中性树胶封片,生物光学显微镜观察心肌组织病理变化。
1.2.6 血清中细胞因子的测定 造模第15天,采用免疫抑制法检测血清CK-MB水平,乳酸底物法检测血清LDH水平,胶乳增强免疫比浊法检测血清cTnⅠ水平,天门冬氨酸底物法检测血清AST水平,严格按说明书操作。分别于造模第1、3、6、9、12和15天,ELISA法测定血清TNF-α水平。
1.2.7 心肌组织中氧化应激相关因子的测定 造模15 d,取暂存于-80℃冰箱的心肌组织,匀浆,取上清,采用黄嘌呤氧化酶法检测上清中SOD水平,二硫代二硝基苯甲酸法检测GSH水平,硫代巴比妥酸显色法检测MDA水平。
1.2.8 RT-PCR检测心肌组织iNOS和IL-10 mRNA表达 从-80℃冰箱中取出心肌组织,匀浆,Trizol法提取细胞总RNA,经反转录试剂盒合成cDNA,进行实时定量PCR反应,检测iNOSmRNA(正向引物:5'-CAGAAATGTTCCAGCATATCT-3',反向引物:5'-GACCTGATGTTGCCACTGTT-3')和IL-10 mRNA(正向引物:5'-ACCTGGTAGAAGTGATGCC-3',反向引物:5'-CAAGGAGTTGTTTCCGTTA-3')水平,以GAPDH为内参,采用2-ΔΔCt法分析mRNA相对表达量。
1.2.9 Western blot检测心肌组织iNOS和IL-10蛋白表达 取暂存于-80℃冰箱的心肌组织,匀浆,提取总蛋白,依次进行蛋白定量、电泳、转膜,室温封闭2 h,洗膜并加入iNOS(1∶500)和IL-10(1∶500)一抗,以β-actin(1∶500)为内参,4℃孵育过夜,洗膜加二抗室温孵育2 h,显像,凝胶成像系统分析蛋白相对内参表达量。
1.2.10 H2O2诱导心肌细胞TNF-α、iNOS和IL-10蛋白表达 大鼠心肌细胞H9C2培养于含10%胎牛血清的DMEM培养液,置于含5%CO2、37℃的培养箱中孵育,隔天换液。将对数生长期细胞分为正常细胞对照组、H2O2组(模型组)、Ole组和EDA组(阳性对照组)。H2O2组、Ole组和EDA组分别加入100µmol/LH2O2,对照组加入等体积无血清培养基,于含5%CO2、37℃的培养箱中处理2 h。Ole组加入40µg/ml Ole,EDA组加入6µg/ml的EDA,继续培养过夜,对照组和H2O2组加入等体积无血清培养基,继续培养过夜。收集细胞,采用Western blot检测各组TNF-α(1∶500)、iNOS(1∶500)和IL-10(1∶500)蛋白表达。
1.2.11 LPS诱导心肌细胞TNF-α、iNOS和IL-10蛋白表达 将对数生长期的H9C2细胞分为正常细胞对照组、LPS组(模型组)、Ole组和EDA组(阳性对照组)。LPS组、Ole组和EDA组细胞分别加入10µmol/L LPS,对照组加入等体积无血清培养基,于含5%CO2、37℃的培养箱中处理2 h。Ole组加入40µg/ml Ole,EDA组加入6µg/ml的EDA,继续培养过夜,对照组和LPS组加入等体积无血清培养基,继续培养过夜。收集细胞,采用Western blot检测各组细胞TNF-α、iNOS和IL-10蛋白表达。
1.3 统计学分析 采用SPSS22.0软件对实验数据进行整理和分析,满足正态分布且方差齐的计量资料均以±s表示,采用单因素方差分析比较组间差异性,SNK-q比较多组两两间差异,P<0.05表示差异有统计学意义。
2 结果
2.1 Ole改善I/RI大鼠心肌心功能 I/RI组大鼠HR、LVSP、LVEF、FS水平低于对照组(P<0.05);Ole组和EDA组大鼠HR、LVSP、LVEF、FS水平高于I/RI组(P<0.05);Ole组 和EDA组 大 鼠HR、LVSP、LVEF、FS差异无统计学意义(P>0.05)。见图1。
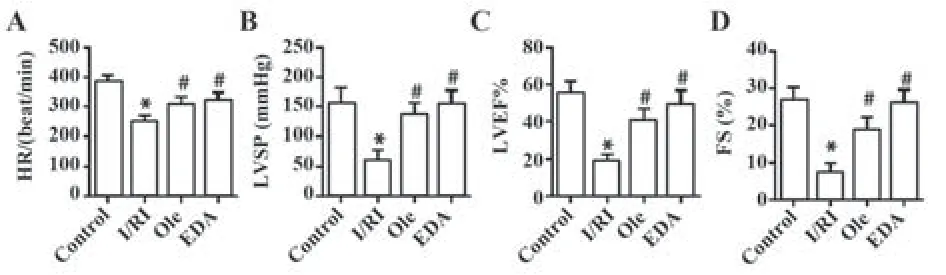
图1 Ole改善I/RI大鼠心肌心功能Fig.1 Ole improved cardiac function in I/RI rats
2.2 Ole减轻I/RI大鼠心肌组织病理损伤 I/RI大鼠心肌组织TTC染色肉眼可见I/RI组大鼠心肌梗死面积明显大于对照组,Ole组和EDA组大鼠心肌梗死面积小于I/RI组(图2A)。经HE染色后,生物光学显微镜下可见对照组大鼠心肌组织细胞排列整齐,未见明显异常,I/RI组大鼠心肌组织细胞排列紊乱,心肌纤维断裂,可见大量炎症细胞浸润;Ole组和EDA组大鼠心肌组织病变明显减轻,Ole组和EDA组大鼠心肌组织病变无明显差异(图2A)。I/RI组大鼠血清CK-Mb、LDH、cTnⅠ和AST水平高于对照组(P<0.05);Ole组和EDA组大鼠血清CK-Mb、LDH、cTnⅠ和AST水平均低于I/RI组(P<0.05);Ole组和EDA组间大鼠血清CK-Mb、LDH、cTnⅠ和AST水平差异无统计学意义(P>0.05),见图2B~E。
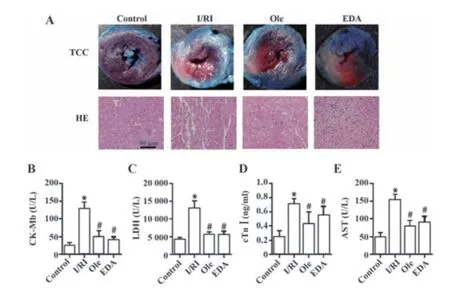
图2 Ole减轻I/RI大鼠心肌组织病理损伤(×200)Fig.2 Ole alleviates pathological injury of myocardial tissue in I/RI rats(×200)
2.3 Ole降低I/RI大鼠血清TNF-α水平 与造模第1天相比,I/RI组、Ole组和EDA组大鼠在造模第3天血清TNF-α水平升高(P<0.05);与造模第3天相比,Ole组和EDA组在造模第9、12和15天血清TNF-α水平降低(P<0.05);Ole组和EDA组大鼠血清TNF-α水平变化差异无统计学意义(P>0.05)。见图3。
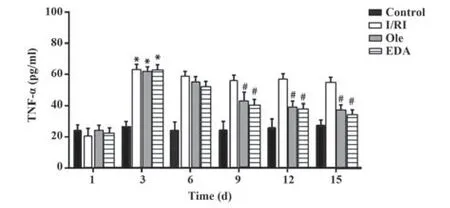
图3 各组大鼠血清TNF-α水平Fig.3 Levels of serum TNF-αof rats in each group
2.4 Ole对I/RI大鼠心肌组织氧化应激和炎症反应的影响 I/RI组大鼠心肌组织SOD和GSH水平低于对照组(P<0.05),MDA、iNOS mRNA和蛋白、IL-10 mRNA和蛋白水平均高于对照组(P<0.05);Ole组和EDA组大鼠心肌组织SOD、GSH和IL-10表达水平高于I/RI组(P<0.05),MDA和iNOS表达水平均低于I/RI组(P<0.05);Ole组和EDA组大鼠心肌组织SOD、GSH、MDA、iNOS、IL-10水平差异无统计学意义(P>0.05)。见图4。
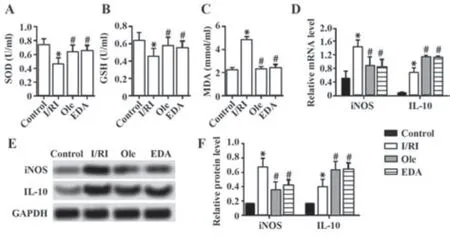
图4 Ole对I/RI大鼠心肌组织氧化应激和炎症反应的影响Fig.4 Effects of Ole on oxidative stress and inflammation in myocardial tissue of I/RI rats
2.5 Ole对H2O2和LPS损伤的心肌细胞TNF-α、iNOS、IL-10蛋白表达的影响 H2O2组心肌细胞TNF-α、iNOS、IL-10蛋白表达水平高于对照组(P<0.05),Ole组和EDA组心肌细胞TNF-α、iNOS蛋白表达水平低于H2O2组(P<0.05),IL-10蛋白表达水平高于H2O2组(P<0.05)。LPS组心肌细胞TNF-α、iNOS、IL-10蛋白表达水平高于对照组(P<0.05),Ole组和EDA组心肌细胞TNF-α、iNOS蛋白表达水平低于LPS组(P<0.05),IL-10蛋白表达水平高于LPS组(P<0.05);Ole组和EDA组心肌细胞TNF-α、iNOS、IL-10表达差异无统计学意义(P>0.05)。见图5。
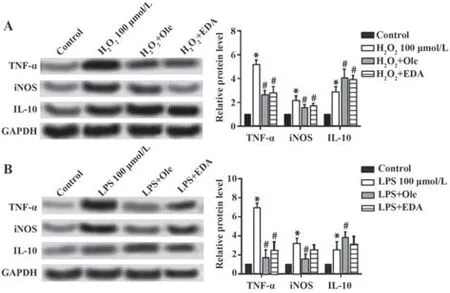
图5 Ole对H 2O2和LPS损伤的心肌细胞TNF-α、iNOS、IL-10蛋白表达的影响Fig.5 Effects of Ole on expressions of TNF-α,iNOSand IL-10 protein in H 2O2 and LPS-injured cardiomyocytes
3 讨论
I/RI是一种临床常见的病理过程,常见于溶栓、介入等治疗后,临床尚缺乏特效治疗药物。Ole属于裂环烯醚萜苷类化合物,具有抗菌消炎、抗氧化、抗病毒、降血压等多种药理学作用,有望应用于临床I/RI的治疗[9-10]。依达拉奉是一种具有抗炎、抗氧化、改善I/RI作用的药物,目前已广泛应用于临床I/RI的治疗[11]。因此,本研究以依达拉奉为阳性对照,探讨Ole对I/RI大鼠的保护作用。HR、LVSP、LVEF和FS是临床常用的反映机体生命体征和心功能的指标,本研究发现,I/RI组大鼠的HR、LVSP、LVEF、FS水平明显降低,而经Ole干预后,大鼠HR、LVSP、LVEF、FS水平明显升高,且其HR、LVSP、LVEF、FS升高水平与EDA干预无明显差异。提示Ole可改善心肌I/RI大鼠的生命体征和心功能,其效果与EDA无明显差异。本研究观察到I/RI组大鼠心肌梗死面积和心肌组织病理损伤明显增加,血清CK-MB、LDH、cTnⅠ和AST水平明显升高,而经Ole干预后,大鼠心肌梗死面积和心肌组织病理损伤明显减轻,血清CK-MB、LDH、cTnⅠ和AST水平明显降低。CK-MB、LDH、cTnⅠ和AST广泛分布于心肌组织中,为心肌损伤的重要标志物,一旦心肌细胞发生损伤,可以释放到血液中,使其在血液中的浓度迅速升高[12-13]。JIN等[14]研究显示,Ole可改善血液微循环,抑制心肌组织炎症反应,减轻心肌I/RI损伤,本研究结果与其相似。提示Ole可减轻I/RI大鼠心肌组织损伤,改善心功能,有望应用于临床治疗。
本研究观察到,与大鼠I/RI造模第1天相比,I/RI模型组和Ole组大鼠在造模第3天血清TNF-α水平显著高于对照组,随着观察的时间延长,I/RI组大鼠血清TNF-α水平始终维持高水平,而Ole组大鼠在造模第9、12和15天血清TNF-α水平逐步下降,明显低于I/RI组。TNF-α主要由活化的巨噬细胞、T淋巴细胞产生,可刺激单核巨噬细胞合成并分泌大量炎症介质,还可激活死亡受体介导的凋亡途径,诱导心肌组织细胞凋亡,在I/R的发生发展中发挥重要作用[15]。HUANG等[16]研究显示,TNF-α可激活核因子κB(nuclear factor-κB,NF-κB),激活炎症级联反应,参与心肌I/R过程中的多种病理反应。研究结果表明,Ole可抑制TNF-α的合成与释放,减轻心肌组织损伤。SOD和GSH是机体重要的抗氧化酶,可清除体内过多的氧自由基(reactive oxide species,ROS),对维持氧化/抗氧化系统平衡具有重要作用,MDA是体内脂质过氧化的中间产物,可以敏感地反映体内的ROS水平[17-18]。已有多项研究显示,I/R早期内皮细胞和心肌细胞可产生大量ROS,直接对心肌细胞产生明显的毒性作用,引起心肌组织细胞损伤,还可攻击细胞膜结构,使膜结构发生脂质过氧化,激活中性粒细胞和NF-κB,释放大量的TNF-α,加重心肌组织炎症性损伤[19-20]。本研究观察到I/RI组大鼠的SOD和GSH水平明显降低,MDA明显升高,经Ole干预后,SOD和GSH水平明显升高,MDA明显降低。表明Ole可降低心肌I/RI大鼠的氧化应激反应和炎症反应,减轻心肌组织损伤。CHEN等[21]研究显示,大量释放的TNF-α还可激活黄嘌呤氧化酶,促进ROS产生,形成恶性循环,加重心肌组织损伤,甚至导致心室重塑。
iNOS是合成NO的关键限速酶,I/R早期释放的大量炎症因子TNF-α等可刺激巨噬细胞分泌大量iNOS,并活化产生大量的NO,诱导能量代谢障碍、ROS产生,加重I/R损伤[22]。IL-10是机体重要的免疫和炎症抑制因子,可拮抗TNF-α、iNOS等促炎因子的产生[23]。本研究发现I/RI组大鼠心肌组织iNOS和IL-10表达明显升高,经Ole干预后,iNOS表达明显降低,IL-10表达明显升高。提示Ole可减轻心肌组织炎症性损伤。H2O2和LPS均可诱导H9C2心肌细胞TNF-α、iNOS、IL-10蛋白表达水平升高,Ole干预后,心肌细胞TNF-α、iNOS蛋白表达明显降低,IL-10蛋白表达明显升高。H2O2和LPS可分别模拟I/R时期的氧化应激损伤和炎症性损伤[24-25]。LIU等[26]研究显示,H2O2可诱导细胞膜发生脂质过氧化,产生大量ROS,激活炎症因子释放,导致心肌细胞氧化损伤。本研究结果表明,Ole可能通过抗氧化作用清除I/R时期释放的ROS,从而抑制炎症反应,减轻心肌组织细胞损伤。
综上所述,Ole通过提高I/RI大鼠的抗氧化酶活性,清除再灌注早期释放的大量ROS,抑制心肌组织的炎症反应,减轻心肌组织细胞损伤,改善心功能。