凯里酸汤对代谢性脂肪肝的改善作用及其机制探讨①
丛 硕 李正超 朱紫馨 刘咏梅 胡亚欣 程义局 程明亮 (贵州医科大学附属医院,贵阳 550003)
随着国家经济的不断发展,人们的生活环境、饮食习惯和结构发生了较大的改变,随之引发的慢性代谢性疾病的发病率逐年增加,其中肥胖、代谢性脂肪性肝病(metabolic-dysfunction-associated fatty liver disease,MAFLD)和糖尿病等疾病跃居前列[1]。MAFLD是指发病机制排除酒精和其他诱发继发性肝脂肪变性因素外,以弥漫性肝细胞脂肪变性为主要特征的临床病理综合征[2],临床以肝组织病理学活检、影像学及血液生物标志物为证据,同时结合以下三项体征之一:超重/肥胖、Ⅱ型糖尿病、代谢功能障碍作为诊断MAFLD新标准[3]。MAFLD是多种因素共同参与的结果,其发病机制除了遗传因素外,还与饮食、胰岛素抵抗、脂质过氧化、胆汁酸代谢和肠道菌群等因素密切相关。目前多采用保肝、改变饮食结构和运动等方法来达到缓解或改善疾病的目的。
凯里酸汤作为贵州省非物质文化遗产,其由西红柿、辣椒、大米和生姜等多种天然农作物经传统工艺两次自然发酵而成,富含番茄红素、辣椒碱、维生素C/E、钙、磷等多种有效成分[4]。番茄红素能抑制肝脏脂肪变性、修复肝损伤及改善肝功能[5]。辣椒碱同样可减轻肝脏脂肪变性,防止肝损伤[6]。本课题组前期对贵州省凯里市开展的MAFLD流行病学调查统计结果显示,当地人群中,MAFLD的发病率为18.19%,而食用凯里酸汤人群中,MAFLD的发病率为12.60%,明显低于全国平均水平29%[7],且长期食用酸汤的人群发病率也低于该地区平均水平。因此,本研究拟利用高脂饮食诱导的MAFLD大鼠模型为研究对象,通过调节饮食-肠道菌群-胆汁酸代谢来探讨凯里酸汤对MAFLD的改善作用及其可能机制,为凯里酸汤防治MAFLD提供进一步的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 34只SPF级雄性SD大鼠,体质量(200±10)g,周龄6周,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001,所有动物实验均经贵州医科大学动物伦理委员会批准。
1.1.2 主要试剂 凯里酸汤由贵州亮欢寨餐饮娱乐管理有限公司提供;蛋白提取试剂盒购自Solarbio公司;BCA定量试剂盒购自碧云天公司;免疫组化和DAB显色试剂盒购自Bioss公司;HE和油红O试剂盒购自南京雨露实验器材有限公司;一抗:抗β-actin抗体购自Bioss公司;抗IL-6抗体、抗TNF-α抗体均购自Abcam公司;抗TLR-4抗体购自Proteintech公司;抗NF-κBp65抗体购自CST公司;二抗:辣根过氧化物酶标记的羊抗兔抗体、羊抗鼠抗体均购自普美生物公司。
1.1.3 主要仪器 双垂直电泳仪购自北京六一公司;全波长酶标仪购买Bio-Rad公司;高速离心机购自BECKMANAllegra X-30R Centrifuge公司;旋涡振荡器购自杭州米欧公司;光学显微镜购自耐博公司;Cobas 702全自动生化分析仪购自罗氏Cobas公司。
1.2 方法
1.2.1 实验分组、MAFLD模型构建及酸汤干预所有SD大鼠适应性喂养1周后,随机分为4组,正常对照组(ND,n=8)、正常饮食+酸汤组(NS,n=8)、模型对照组(HF,n=10)和高脂饮食+酸汤组(HS,n=8)。ND组和NS组大鼠给予标准饲料喂养,HF组和HS组大鼠给予高脂饲料喂养以诱导MAFLD模型。饲料喂养时NS组和HS组大鼠给予酸汤灌胃干预,ND组和HF组大鼠给予等体积双蒸水灌胃。饲喂12周后,随机从HF组中取2只大鼠处死,收取血和肝组织样本,通过生化和病理组织学检查确认造模是否成功。
1.2.2 标本收集 各组大鼠自由饮水摄食12周后,水合氯醛麻醉后心脏取血,称量各组大鼠体质量及肝质量,计算肝指数;收集血和肝组织用于后续相关指标检测。
1.2.3 生化指标活性/含量检测 将全血置于低速离心机4 000 r/min离心5 min,取上清,检测各组大鼠生化指标活性及含量。
1.2.4 HE和油红O染色观察肝组织病理学改变及脂肪变性程度 采用4%多聚甲醛固定肝组织,脱水浸蜡,石蜡包埋,制成3µm厚的石蜡切片,脱蜡透明后行HE和油红O染色,光学显微镜下观察肝组织形态结构及脂肪小滴多少与大小。
1.2.5 免疫组织化学(IHC)染色检测肝组织中TNF-α的变化 石蜡切片,常规脱蜡至水,高压抗原修复,3%H2O2灭活组织内源性过氧化物酶20 min,正常山羊血清工作液封闭30 min,孵育一抗4℃过夜,室温复温30 min,室温孵育二抗30 min,DAB显色,显微镜观察,苏木素复染细胞核,自来水返蓝,脱水、透明、封片,光学显微镜下观察TNF-α的变化情况。
1.2.6 粪便16SrRNA测序检测大鼠肠道菌群变化 实验干预12周后,大鼠处死前,固定大鼠,无菌去酶EP管直接接取大鼠自然排出的粪便,采用Misep技术对大鼠粪便进行细菌16SrRNA测序,在OTU水平上,对各组大鼠肠道菌群的多样性及丰度进行α分析。各组大鼠肠道菌群多样性及丰度用Observed species指数表示。
1.2.7 Western blot检测肝组织中IL-6、TNF-α、TLR-4和NF-κBp65等蛋白表达 称取0.020 g肝组织加入蛋白裂解液充分研磨裂解,4℃离心20 min取上清,应用BCA法测定蛋白浓度,配制蛋白样本。配制SDS-PAGE凝胶,上样、电泳、转膜、封闭。分别加入一抗:IL-6、TNF-α、TLR-4和NF-κB p65,4℃摇床孵育过夜。TBST洗膜,孵育相应二抗,TBST洗膜,ECL显影曝光,Bio-Rad凝胶成像系统扫描,Image J 1.6软件分析各条带的灰度值,以β-actin为内参,目的蛋白与β-actin的比值用于后续统计学分析。
1.3 统计学处理 采用SPSS23.0统计软件对数据进行统计学分析,数据以±s表示,组间比较用独立样本t检验,计数资料以例数(n)或百分比(%)表示,以P<0.05为差异具有统计学意义。
2 结果
2.1 凯里酸汤对各组大鼠体质量、肝质量、肝指数和Lee's指数的影响 与ND组相比,HF组大鼠体质量、肝质量、肝指数及Lee's指数均明显升高(P<0.05),提示模型构建成功;与HF组相比,HS组大鼠体质量、肝质量、肝指数和Lee's指数均显著降低(P<0.05)。各组小鼠体质量、肝质量、肝指数和Lee's指数测定结果见表1。
表1 大鼠体质量、肝质量、肝指数和Lee's指数变化(±s,n=6)Tab.1 Changes in body weight,liver weight,liver index and Lee's index of rats(±s,n=6)

表1 大鼠体质量、肝质量、肝指数和Lee's指数变化(±s,n=6)Tab.1 Changes in body weight,liver weight,liver index and Lee's index of rats(±s,n=6)
Note:1)P<0.05 vs NDgroup;2)P<0.05 vs HFgroup.
Parameters Initial body weight/g Final body weight/g Liver weight/g Liver index/%Lee's index ND 235.83±10.67 428.33±27.81 11.19±1.01 2.59±0.18 2.94±0.04 NS 236.83±7.17 413.83±12.73 10.40±0.69 2.46±0.19 2.96±0.05 HF 237.17±6.59 503.83±36.441)14.33±1.741)2.85±0.161)3.06±0.061)HS 233.33±5.13 453.00±24.452)12.39±0.872)2.60±0.152)2.96±0.062)
2.2 凯里酸汤对各组大鼠血清中AST和ALT活性及TG、TC、HDL-C、LDL-C和TBA含量的影响 与ND组比较,HF组大鼠血清中AST和ALT活性及TG、TC、LDL-C和TBA含量显著升高(P<0.05),而血清中HDL-C含量显著降低(P<0.05);与HF组比较,HS组大鼠血清中AST和ALT活性及TG、TC、LDL-C和TBA含量均显著降低(P<0.05),而血清中HDL-C含量均显著升高(P<0.05)。各组大鼠血清中AST和ALT活性及TG、TC、HDL-C、LDL-C和TBA含量测定结果见表2。
表2 各组大鼠血清中ALT和AST活性及TC、TG、LDL-C、HDL-C和TBA含量测定结果(±s,n=6)Tab.2 Serum ALT,AST activity,TC,TG,LDL-C,HDL-C and TBA concentrations of rats in each group(±s,n=6)
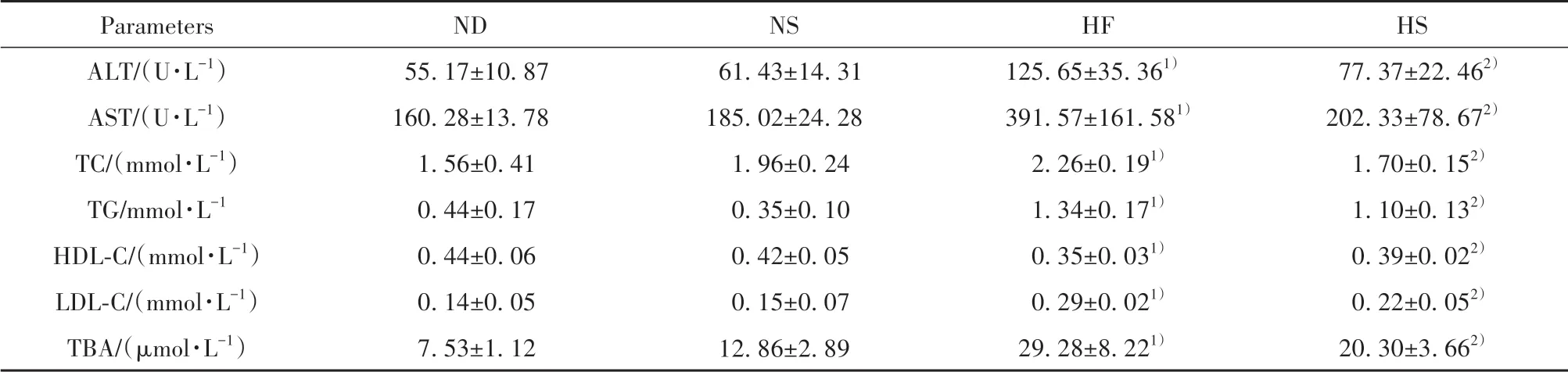
表2 各组大鼠血清中ALT和AST活性及TC、TG、LDL-C、HDL-C和TBA含量测定结果(±s,n=6)Tab.2 Serum ALT,AST activity,TC,TG,LDL-C,HDL-C and TBA concentrations of rats in each group(±s,n=6)
Note:1)P<0.05 vs NDgroup;2)P<0.05 vs HFgroup.
Parameters ALT/(U·L-1)AST/(U·L-1)TC/(mmol·L-1)TG/mmol·L-1 HDL-C/(mmol·L-1)LDL-C/(mmol·L-1)TBA/(µmol·L-1)ND 55.17±10.87 160.28±13.78 1.56±0.41 0.44±0.17 0.44±0.06 0.14±0.05 7.53±1.12 NS 61.43±14.31 185.02±24.28 1.96±0.24 0.35±0.10 0.42±0.05 0.15±0.07 12.86±2.89 HF 125.65±35.361)391.57±161.581)2.26±0.191)1.34±0.171)0.35±0.031)0.29±0.021)29.28±8.221)HS 77.37±22.462)202.33±78.672)1.70±0.152)1.10±0.132)0.39±0.022)0.22±0.052)20.30±3.662)
2.3 凯里酸汤对各组大鼠肝组织病理形态的影响 ND组大鼠肝组织结构正常,肝小叶结构清晰,周围细胞索呈放射状排列,无脂肪变性细胞;HF组大鼠肝组织结构发生病理性改变,肝小叶界限不清晰,出现大量球形脂滴;与HF比较,HS组大鼠肝组织病理形态得到明显改善,球形脂滴减少或变小。各组大鼠肝组织病理改变结果见图1。

图1 各组大鼠肝脏病理学改变Fig.1 Pathological changes of liver in each group rats
2.4 凯里酸汤对各组大鼠肠道菌群的影响 HF组菌群多样性明显降低,与ND组和HS组差异有统计学意义(P<0.05),而NS组和HS组的菌群虽低于ND组,但差异均无统计学意义(P>0.05)。HS组与HF组菌群结构上相近,但与ND组距离较远,NS组与ND组距离较近。且HF组与ND组和NS组、HS组的菌群结构差异均具有统计学意义(P<0.01,P<0.05)。各组大鼠粪便肠道菌群α多样性、PC分析和β多样性分析结果见图2。
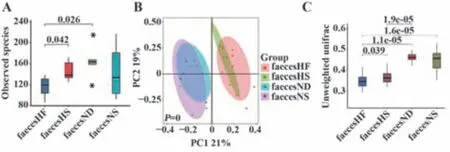
图2 各组大鼠粪便肠道菌群分析Fig.2 Analysis of intestinal microflora in faeces of rats in each group
2.5 凯里酸汤对各鼠肝组织中IL-6和TNF-α含量的影响 与ND组比较,HF组大鼠肝组织中IL-6及TNF-α含量均显著升高(P<0.01);与HF组比较,HS组大鼠肝组织中IL-6及TNF-α含量均显著降低(P<0.01)。各组小鼠肝组织中IL-6及TNF-α含量测定结果见图3和图4。
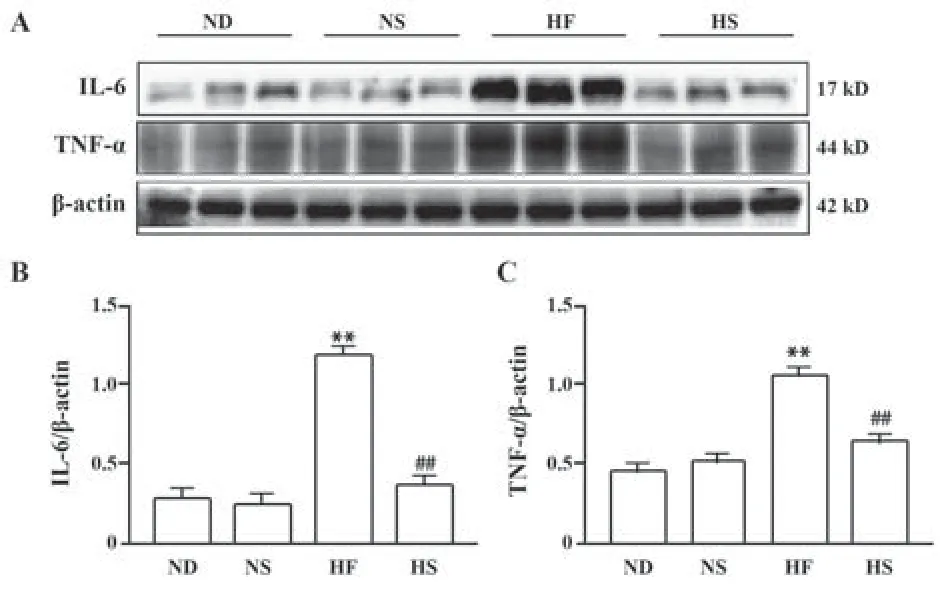
图3 各组大鼠肝组织中IL-6和TNF-α相对表达Fig.3 Content determination results of IL-6 and TNF-α in liver tissue of mice in each group
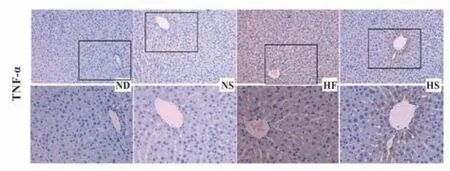
图4 各组大鼠肝组织中TNF-α表达Fig.4 Expression of TNF-αin liver tissue of rats in each group
2.6 凯里酸汤对各鼠肝组织中TLR-4和NF-κB p65含量的影响 与ND组比较,HF组大鼠肝组织中TLR-4和p-NF-κB p65含量均显著升高(P<0.05);与HF组比较,HS组大鼠肝组织中TLR-4和p-NF-κB p65含量均显著降低(P<0.05)。各组大鼠肝组织中TLR-4和p-NF-κBp65含量测定结果见图5。
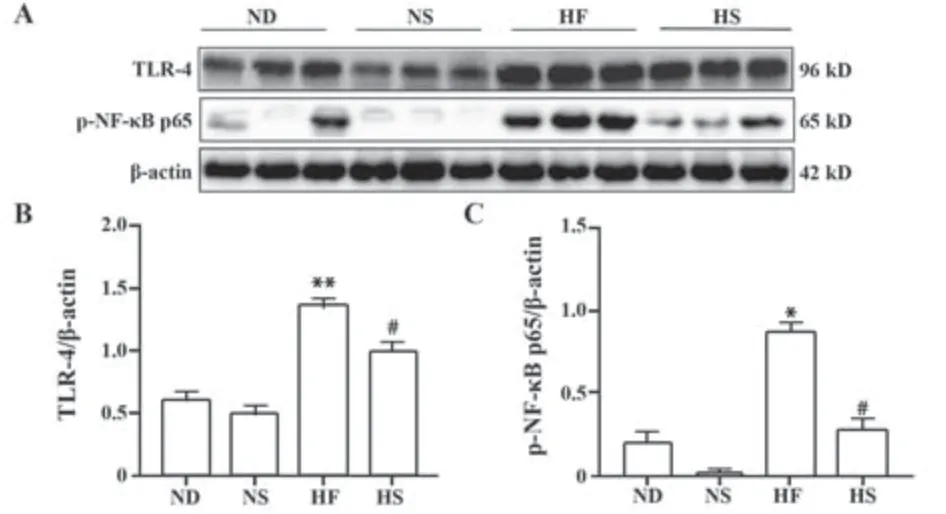
图5 各组大鼠肝组织中TLR-4和p-NF-κB p65相对表达Fig.5 Content determination results of TLR-4和p-NFκB p65 in liver tissue of rats in each group
3 讨论
肝脏作为脂肪代谢的主要靶器官,长期高脂饮食会增加肝脏对脂肪的摄取,当脂肪摄取量大于排出量时,会导致肝脂肪变性[8]。运用高脂饮食诱导的MAFLD大鼠动物模型,具备胰岛素抵抗、肥胖等特征,较好地模拟了人类MAFLD的发生、发展过程[9]。本研究运用高脂饮食饲养SD大鼠12周,构建MAFLD大鼠模型,研究结果显示,与ND组相比,HF组大鼠体质量、肝质量、肝指数及Lee's指数均明显升高,肝组织出现病理性改变及大量的球形脂滴,提示建模成功,与国内外研究结果一致[10]。而HS组大鼠体质量、肝质量、肝指数及Lee's指数均显著下降,肝组织病理形态及脂肪变性得到改善,提示凯里酸汤具有改善高脂饮食诱导的MAFLD大鼠肝脏病变的作用。本研究还发现,凯里酸汤可显著降低HF组大鼠血清中AST、ALT活性、TG、TC及LDL-C含量,升高HDL-C含量,进一步证明了凯里酸汤能够改善高脂饮食诱导的MAFLD大鼠肝组织病变。
高脂饮食诱导的MAFLD机制复杂,有众多因素参与,肠道菌群紊乱及肠道屏障功能障碍是其关键因素。研究表明,肠道菌群紊乱可引起胆汁酸代谢紊乱,肠壁通透性增加,致使活性氧系、细菌内毒素和乙醇及其毒性代谢产物大量进入肝脏,最终导致肝损害加剧[11]。胆汁酸是胆固醇的终末降解产物,在脂肪代谢中起重要作用,研究表明,胆汁酸可通过直接或间接激活法尼醇X受体和G蛋白偶联胆汁酸受体5在脂质代谢中发挥作用,与肥胖、糖尿病和MAFLD等代谢性疾病有着密切关系[12]。本研究发现,经凯里酸汤干预后,与ND组相比,HF组大鼠肠道菌群及菌群结构均发生了显著改变,粪便肠道菌群的丰度和多样性均显著降低,厚壁菌门(Firmicutes)比例明显升高,拟杆菌门(Bacteroidetes)和放线菌比例降低,与文献报道相一致[13]。有研究发现,厚壁菌门可产生更多的脂多糖和脱氧胆酸,通过肝门静脉进入肝脏,导致肝脏炎症[14-15]。拟杆菌参与不可消化多糖的发酵,以产生短链脂肪酸,能够直接激活G蛋白偶联受体,抑制组蛋白去乙酰化酶,并作为能量底物,从而调节各种生理过程,有助于身体健康[15-17]。而放线菌负责产生抗炎特性的短链脂肪酸[18]。肠道菌群的这些改变也正是影响MAFLD发生、发展的重要因素。而经过酸汤干预后的HS组的菌群结构得到了改善,厚壁菌门比例降低,拟杆菌门和放线菌比例升高。同时,与ND组相比,HF组大鼠血清中TBA含量明显升高,而凯里酸汤可显著降低HS组大鼠血清中TBA含量,其机制可能与凯里酸汤干预后肠道菌群的改变进而影响胆汁酸代谢相关[19]。
MAFLD患者常伴有肥胖和胰岛素抵抗(insulin resistance,IR)两大特点,而因肥胖导致的肠道菌群失衡和肠壁通透性增加是机体内毒素血症发生的重要因素,肠道内毒素通过门静脉进入肝脏,促进肝脏炎症反应[20],而肝脏炎症反应使肝细胞分泌胆汁酸异常,进一步加重肠道菌群失衡,提示肠道和肝脏通过“肠-肝轴”,相互作用,相互影响[21]。肝脏炎症反应参与MAFLD发生发展且贯穿MAFLD整个过程,其机制与“二次打击学说”关联紧密[22]。“二次打击学说”中一次打击核心是IR,二次打击是在IR基础上导致肝脏炎症反应,促使TNF-α及IL-6等炎症细胞因子大量释放,引发肝细胞脂肪变性、凋亡、坏死及炎症,最终导致MAFLD的发生[23]。研究发现,五味子提取物对高脂饮食诱导的MAFLD大鼠肝组织炎症损伤和肝细胞变性有较好的改善作用,其机制与抑制TNF-α及IL-6等炎症因子的表达有关[24]。本研究发现,HF组大鼠肝组织中IL-6和TNF-α含量明显升高,而HS组大鼠肝组织中IL-6和TNF-α含量显著降低,提示凯里酸汤可有效改善高脂饮食诱导的MAFLD大鼠肝组织的炎症反应,其机制可能与抑制TNF-α和IL-6等炎症因子有关,但具体机制还有待进一步研究。
肠道菌群失衡可诱发IR,在肝脂肪变性过程及肝脏炎症反应中均发挥重要作用,是诱发MAFLD发生发展的关键因素之一[25]。脂多糖是革兰氏阴性菌细胞壁的主要成分,该物质可通过Toll样受体4(Toll-like receptor 4,TLR4)等介导的信号通路激活炎症级联反应,导致多种炎症介质[如:TNF-α、IL-6和核转录因子(nuclear factor kappa-B,NF-κB)等]的基因表达上调,是诱发肝脏炎症反应及激活炎症信号通路的关键因子[26-27]。本研究发现,HF组大鼠肝组织中TLR-4和NF-κB含量明显升高,而HS组大鼠肝组织中TLR-4和NF-κB含量显著降低,提示凯里酸汤可通过抑制TLR-4/NF-κB信号转导通路激活,进而抑制肝组织炎症反应,改善高脂饮食诱导的MAFLD大鼠肝组织病变。
综上所述,凯里酸汤能够明显改善高脂饮食诱导的MAFLD大鼠肝组织病变,其机制可能与凯里酸汤改善肠道微生态环境,进而改善胆汁酸代谢有关。凯里酸汤作为一类多种物质经过发酵而形成的混合物,其中富含的番茄红素、辣椒碱、维生素C/E、钙、磷等多种有效成分已经得到了验证,但是课题组本次的研究并未对其主要成分进行提取和验证,其具体作用机制还有待进一步深入研究。