蕹菜替代伊乐藻对中华绒螯蟹产量和蟹塘水质的影响
刘永茂,金梅娟,付卫国,沈明星,朱卫峰,吕海瑞,徐 君,施林林
(1.苏州市农业科学院,江苏苏州 215155;2.江苏大学农业装备工程学院,江苏镇江 212013;3.国家土壤质量相城观测实验站,江苏苏州 215155;4.江苏沙家浜渔业科技有限公司,江苏常熟 215500;5.信阳农林学院,河南信阳 464000)
阳澄湖大闸蟹,学名中华绒螯蟹(Eriocheirsinensis),是苏州地区驰名中外的优质水产品[1,2]。传统围网养殖大闸蟹易污染自然水体,2001年仅太湖江苏段大闸蟹养殖向环境排放总氮(TN)和总磷(TP)分别即达147.37和21.67吨[3]。因此,围网养殖正被逐步取缔,集约化池塘养殖已成为大闸蟹最主要的养殖方式[4]。“养蟹先养草”,蟹塘内种植水草是蟹生态养殖的关键环节,水草不仅能降低因蟹塘水体氮磷等污染物超标导致的富营养化风险,同时也能为中华绒螯蟹脱壳提供了掩蔽场所,显著提高中华绒螯蟹的成活率和内在品质[5]。目前苏州地区中华绒螯蟹养殖常用水草为伊乐藻(Elodeanuttallii)。作为外来物种,伊乐藻耐低温,早春易种植、生长快速[6]。但伊乐藻高温耐受性差,在夏季其常因气温过高而大量死亡,易导致蟹塘水质恶化[7,8]。因此,寻找有效替代伊乐藻的水生植物成为蟹生态养殖的研究热点。
蟹塘常用水草除伊乐藻外,还包括菹草、金鱼藻、轮叶黑藻、苦草和空心莲子草等[9,10]。其中,菹草对中华绒螯蟹的生长促进作用较弱[10],金鱼藻和轮叶黑藻均不耐低温[11,12],苦草易被河蟹摄食不易栽种[13,14],空心莲子草作为入侵植物,常难于控制[15]。因此,目前中华绒螯蟹生产仍需进一步筛选出对环境温度要求低,对氮磷等物质同化能力强,有利于保持水体质量健康且易栽培与管理,并能产出一定的经济价值的蟹塘水生植物。
蕹菜(Ipomoeaaquatic)作为我国南方常见蔬菜,在水体中易种植,生长迅速,环境适应性强,生物量大,氮磷同化能力强,基本符合蟹塘水生植物的筛选要求[16-18]。但蕹菜在中华绒螯蟹生产中的应用研究并不充分,特别是蕹菜对蟹塘水体氮排放的研究仍不多见。刘永茂等[19]初步比较了高温期蕹菜和常规伊乐藻处理水体氮含量的差异,结果表明蕹菜处理后显著降低了高温期水体氮含量,但未完整揭示河蟹全养殖周期内水质变化,同时也未探讨蕹菜对河蟹产量的影响。因此,本研究拟利用蕹菜替代传统伊乐藻,设置100%替代和50%替代2种模式,系统研究蕹菜替代伊乐藻对中华绒螯蟹产量和养殖周期内水质的影响。
1 材料与方法
1.1 试验概况
实验地位于苏州市相城区太平镇中华绒螯蟹养殖基地(31°26′37.84″N,120°42′43.92″E)。为精确控制水生植物覆盖面积,减少打捞及刈割的实验成本,按20 m×5 m尺寸依次开挖中华绒螯蟹养殖塘9个,每个实验塘面积约为100 m2,塘深1.50 m。塘壁采用混凝土隔断,蟹塘四周采用高20 cm铝板防止逃逸。每个实验塘底铺设微孔增氧管以解决小型实验蟹塘水体空气复氧低的问题。
实验于2019年3月15日-10月26日,采用随机区组设计,共设3个处理,每个处理重复3次。处理包括100%伊乐藻处理组(EL)、100%蕹菜处理组(IP)和50%蕹菜+50%伊乐藻处理组(E-I),每个处理组植物覆盖总面积均占池塘面积的60%,并用围网进行固定。
蟹塘在2018年底和2019年初进行晒垡冻土,并采用生石灰消毒10 d,之后按45 kg/hm2投入三元复合肥(N ∶P2O5∶K2O=15 ∶15 ∶15)作为基肥。伊乐藻栽培采用人工移栽法,先在池塘内放入5~10 cm水,并将新鲜具有活力的伊乐藻枝条直接移栽至蟹塘内,平均每穴移栽约40枝,移栽密度为0.5 m×0.5 m。蟹塘蕹菜种植采用人工毯苗方式,人工毯苗提前进行温室穴盘育苗,将20 d蕹菜苗直接摆放在水面,并用围网保持覆盖面积[20]。伊乐藻种植和蕹菜移栽均在3月底完成。为进一步促进植物前期生长,在5月上旬继续按50~60 kg/hm2施用三元复合肥(15 ∶15 ∶15)。
采用中华绒螯蟹作为养殖对象,蟹苗规格80~100 ind./kg,投放量为15 000 ind./hm2。养殖过程采用商品饵料(通威集团)和部分冰鲜鱼。养殖前期,投喂蛋白质含量为30%~38%的商品饵料;养殖后期,以商品饵料并添加部分冰鲜鱼。整个河蟹养殖期间,依据气温与植物长势状况控制水位,当伊乐藻和蕹菜的覆盖率超过60%进行打捞及刈割。河蟹养殖期间进行持续的微孔增氧,一般为晚间19点至翌日凌晨6点增氧8~10 h,阴雨天全天持续增氧。为提高中华绒螯蟹存活率,每个蟹塘内加入20组人工掩蔽所。每组人工掩蔽所包含16根内径150 mm,长300 mm的PVC管。一般情况下,蟹塘不主动排水,除非暴雨导致水位过高,在夏季高温期,为弥补蒸发量,每天早5~6点根据实际情况补水0~5 cm。中华绒螯蟹其余养殖方法,如病害管理等,均参考中华绒螯蟹生态养殖技术标准[21]。
1.2 取样与分析方法

在11月26日清塘后测定中华绒螯蟹产量。在清塘前20 d左右采用刈割方法估计水生植物干物质量。先在实验塘内用1 m×1 m铁框固定取样面积,然后收集铁框内所有植物,并在90 ℃下烘干称重。
1.3 统计方法
采用Excel 2016进行数据整理,采用SPSS 21.0软件进行统计分析,实验结果以平均值±标准差(mean ± SD)表示,运用Sigma Plot 12.5软件作图。处理组间中华绒螯蟹产量、水体质量指标的比较采用单因素方差分析(ANOVA),在取得显著性后采用LSD方法进行多重比较,显著水平取0.05。
2 结果与分析
2.1 中华绒螯蟹产量与植物生物量
方差分析表明,中华绒螯总产量和母蟹产量在处理组间无显著差异,但公蟹产量有显著差异(表1)。IP处理组与常规EL处理组相比,公蟹产量增加了68.73 kg/hm2;E-I处理组与EL处理组相比,公蟹产量减少了41.86 kg/hm2。蟹塘种植蕹菜显著提高了干物质量,IP处理组与E-I和EL处理组相比,干物质量分别提高32.3%和79.5%。

表1 不同处理下中华绒螯蟹产量和水生植物干物质量
3.2 蟹塘水质变化
蕹菜替代传统伊乐藻后,蟹塘水体pH、DO含量随时间变化差异较大(图1A,B)。与EL处理组相比,IP和E-I处理组水体pH、DO含量均呈现出持续下降趋势,且在6月份之后差异显著。EL、IP和E-I处理组养殖周期内水体DO平均分别为8.96、6.08和5.57 mg/L,IP和E-I处理组比EL处理组水体DO含量分别降低2.88 mg/L和3.39 mg/L。EL、IP和E-I处理组pH均值分别为8.06、7.47和7.50,IP和E-I处理组比EL处理组水体pH值分别降低0.49和0.45。

图1 蟹塘水体pH,DO,Chla和TSS动态
蟹塘水体各处理组Chla含量随时间变化趋势一致(图1C),EL、IP和E-I处理组水体Chla平均含量分别为2.68、2.19和2.64 μg/L,IP处理组水体Chla相对较低。各处理组TSS含量随时间变化趋势也基本一致(图1 D),且处理组间无显著差异,EL、IP和E-I处理组水体TSS平均含量分别为16.29、18.93和18.40 μg/mL,处理组间无显著差异。

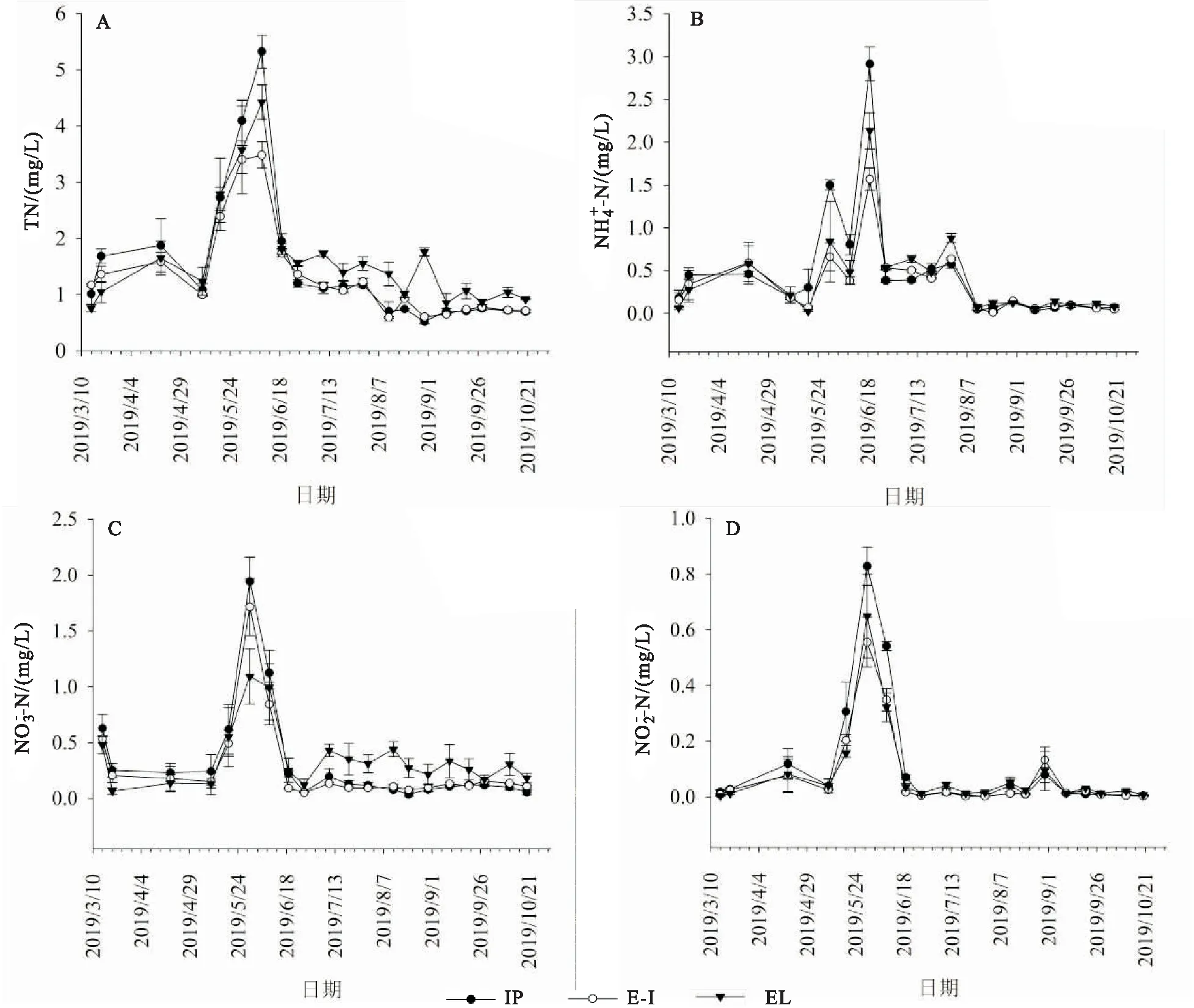
图2 蟹塘水体和动态
3 讨论
3.1 蕹菜替代伊乐藻对中华绒螯蟹产量的影响
除公蟹产量外,中华绒螯蟹总产量在不同水生植物处理间并无显著差异,初步表明蟹塘种植蕹菜对中华绒螯蟹的生长并无影响。E-I处理组公蟹产量显著低于IP和EL处理组,可能是由于E-I处理组蟹苗中公蟹比例较低导致。蟹塘内伊乐藻的主要作用之一是为中华绒螯蟹脱壳提供掩蔽所,提高了其存活率和产量。蕹菜作为蟹塘漂浮植物,在水中并不具有类似伊乐藻的茎叶组织,但前期研究发现蟹塘中蕹菜根系发达,可作为中华绒螯蟹的潜在掩蔽所[20]。同时,本研究在实验过程中也添加了部分人工掩蔽所,进一步保证了中华绒螯蟹的存活率。
3.2 蕹菜替代伊乐藻对蟹塘水质的影响
蟹塘水体溶解氧主要来自微孔增氧和水生植物的光合作用[24],较高的水体DO含量不仅能为蟹正常生长提供保障,也是水质良好的重要化学指标[25-27]。结果表明,EL处理组DO平均含量高于IP和E-I处理组,这主要是因为蕹菜漂浮于水面遮挡了太阳辐射,限制了沉水植物和水体藻类光合作用[28]。同时,蕹菜作为漂浮植物,也直接阻碍了水体与大气的接触,降低了水体大气的复氧[29]。但整体而言,由于蟹塘微孔增氧的大量普及[30,31],各处理组蟹塘水体平均DO含量均大于5.0 mg/L,满足渔业水质标准[32]。
本研究中IP和E-I处理组水体Chla含量相对较低,且处理组间无显著差异,表明蕹菜漂浮水面遮挡阳光导致藻类生物量降低。水体TSS常会导致水体透光度低,进而限制水体光合作用。蟹塘水体TSS增大主要由于河蟹活动和微孔增氧,本研究中各处理组水体TSS总体无显著差异,且均满足太湖流域池塘养殖水排放要求(TSS<50 mg/L)[34]。
4 结论


