低氧应激下克氏原螯虾肝胰腺转录组分析
于瑶瑶,王 丹,徐 进,徐 滨,马宝珊,朱祥云
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院长江水产研究所,农业农村部淡水生物多样性保护重点实验室,武汉 430223)
克氏原螯虾(Procambarusclarkii)隶属于十足目螯虾科原螯虾属,俗称淡水龙虾、小龙虾。原产于北美洲,于1929年经日本引入我国,是我国主要经济虾类之一[1]。低氧应激是养殖过程中最常见的应激因子,在人工养殖条件下,温度、天气、浮游动植物以及投入饵料多少等因素都会影响水中溶解氧浓度,使养殖品种受到低氧应激[2]。已有研究证明,在虾类养殖中低溶氧状态下的存活率显著低于高溶氧下存活率[3]。养殖动物在低氧应激状态下,生理生化水平以及基因表达方面会发生改变[4],导致诸多不良影响如食欲、活力和抵抗力下降等,甚至死亡。
肝胰腺是甲壳动物消化、吸收、储存和代谢功能的重要器官[5]。低氧应激会破坏肝胰腺的渗透调节机制,使肝胰腺消化细胞的溶酶体产生自噬[6],从而对组织细胞结构造成损伤,并引起肝胰腺中抗氧化酶活力以及其它代谢相关的酶活力发生显著变化,从而影响代谢和免疫反应[7-9]。有研究表明,低氧应激可上调凡纳滨对虾(Litopenaeusvannamei)肝胰腺中Lvglut2转录本的表达,影响缺氧时糖代谢[10]。肝胰腺在虾类防御反应的启动中也起着重要作用,低氧应激会通过影响凡纳滨对虾(L.vannamei)肝胰腺细胞中的凋亡调节因子(TIGAR)参与低氧应激[11]。肝胰腺是虾类生理代谢调控的主要器官,研究克氏原螯虾肝胰腺的转录组变化,将有助于揭示机体应对低氧应激的分子机制。本研究利用转录组测序技术构建了低氧应激下克氏原螯虾肝胰腺的转录组文库,分析低氧应激下克氏原螯虾肝胰腺中基因的表达变化以及相关信号通路,以期为进一步研究克氏原螯虾低氧应激机制奠定基础,为研究抗应激技术提供理论支持。
1 材料与方法
1.1 实验虾及低氧应激实验
实验用克氏原螯虾取自长江水产研究所梁子湖实验基地。随机挑选规格一致的虾,平均体重25 g,在持续充气的水中暂养两周,溶氧(DO)浓度(7.8±0.5)mg/L,水温18~22 ℃。暂养期间,每24 h换一半的水,投喂适量的商品饲料(湖北蒲阳饲料股份有限公司,湖北),实验前一天停止喂食。低氧应激实验:将克氏原螯虾分为两组,一组进行低氧应激,一组为对照组在正常DO条件下饲养。实验组采用氮气排除水体中氧气的方法降低DO,将水体中DO降至(2.5±0.2) mg/L[12],并保持稳定10 min。对照组用增氧泵向水中持续充氧以保持充足DO(DO≥7.5 mg/L)。将实验虾投入缺氧水体后,立即将容器用塑料膜封住,3 h后,实验组和对照组分别取3尾虾,迅速解剖获得肝胰腺组织,并立即放入RNA保存液中,在4 ℃冰箱放置过夜后转移至-80 ℃冰箱中保存。
1.2 转录组测序及分析
转录组测序由上海元莘生物医药科技有限公司完成。对Illumina Hiseq/Miseq双末端测序得到的原始数据进行处理,得到高质量的测序数据,同时对质量修剪前后的序列进行数据量统计。然后通过Trinity[13]软件进行从头组装,并使用该软件对组装得到的所有转录本序列进行基因预测。基于非冗余蛋白库(Non-Redundant Protein Sequence Database,NR)、蛋白质家族的集合数据库(Protein Families database,Pfam)、基因本体(Gene Ontology,GO)和生物学通路分析(Kyoto Encyclopedia of Genes and Genomes,KEGG)、蛋白直系同源簇数据库(Clusters of Orthologous Groups of proteins,COG)、蛋白质序列数据库(Swiss-Prot Protein Sequence Database,Swiss-prot)等数据库进行比对,获得特异基因(Unigene)和转录本的功能注释信息。
1.3 差异表达基因(DEGseq)分析
结合RSEM[14]与各样品测序得到的reads与Unigene库的比对结果进行表达量水平估计。对获得的数据进行FPKM(fragments per kilobase per million)值[15]转换,取阈值为错误发现率(FDR)<0.05且差异倍数(Fold Change)≥1的基因作为差异表达基因。获得差异表达基因以后,对其进行KEGG通路富集分析,GO功能及Pfam结构域分析,获得各种注释信息。
1.4 实时荧光定量PCR(qRT-PCR)验证
从测序结果中随机挑选出10个差异基因,以18S核糖体RNA(18S rRNA)为内参,用Primer premier 5软件设计引物(表1),进行qRT-PCR验证。按2-△△CT法计算基因相对表达量,与测序结果进行比对。反应程序为:95 ℃预变性1 min后开始40个循环,95 ℃ 5 s,60 ℃ 10 s,72 ℃ 15 s,然后收集荧光信号,进行溶解曲线分析。

表1 实验所用的引物
2 结果与分析
2.1 测序结果及功能注释
转录组测序分别获得149 905 186、135 461 974条原始序列。经过处理后,得到149 687 062条、135 229 834条的clean reads。对碱基质量及组成进行分析,每组GC含量区间为 43.98%~47.21%。转录本与Unigene的N50(按照长度将组装转录本从小到大排序,累加转录本的长度到总长度的一半时,对应转录本的长度)分别为2 814 bp 和 1 540 bp,平均长度分别为1 130.17 bp和 760.08 bp
将转录本和Unigene与NR、Pfam、Swiss-Prot、GO和KEGG等数据库进行比对,Unigene得到注释的基因数总共为39 342个。拼接所得的Unigene与Nr蛋白数据库进行同源性比对,相似序列所占比例最高的前6种物种分别是美洲钩虾(Hyalellaazteca,26%)、内华达古白蚁(Zootermopsisnevadensis,6%)、水螅(Hydravulgaris,3%)、美洲鲎(Limuluspolyphemus,2%)、刺参(Apostichopusjaponicas,2%)和克氏原螯虾(Procambarusclarkii,2%)(图1)。
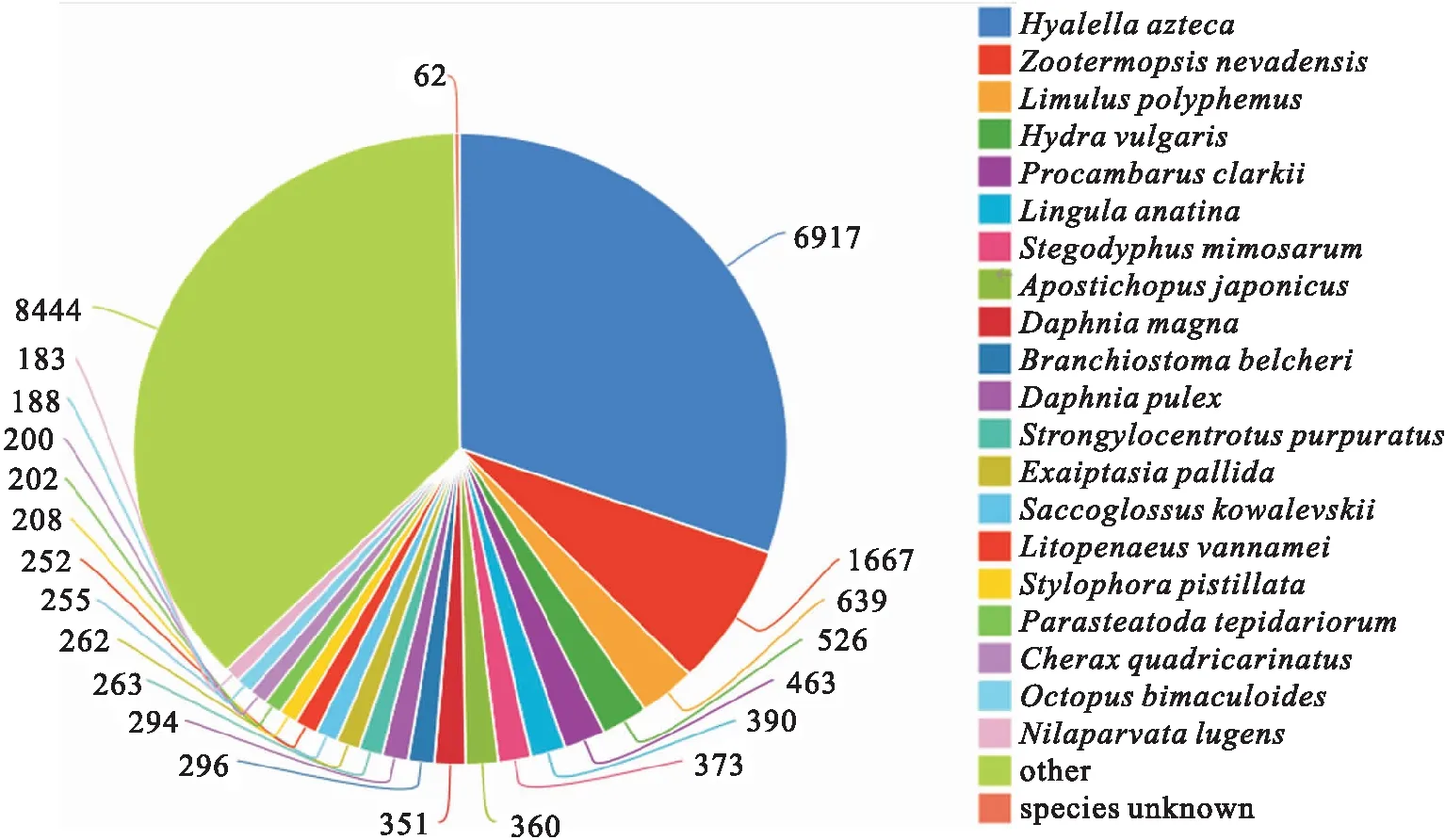
图1 NR同源物种分类图
2.2 差异基因表达分析
利用DEGseq分析在低氧应激下和正常状态下克氏原螯虾的肝胰腺中的差异基因表达。显示251个基因在低氧应激下的肝胰腺中特异表达,其中上调DEGs140个(55.77%),下调DEG111个(44.22%)(如图2)。为了进一步筛选得到与克氏原螯虾耐低氧性状相关的基因,从差异表达的251个基因中,筛选到差异表达最显著的前10个基因(表2)。
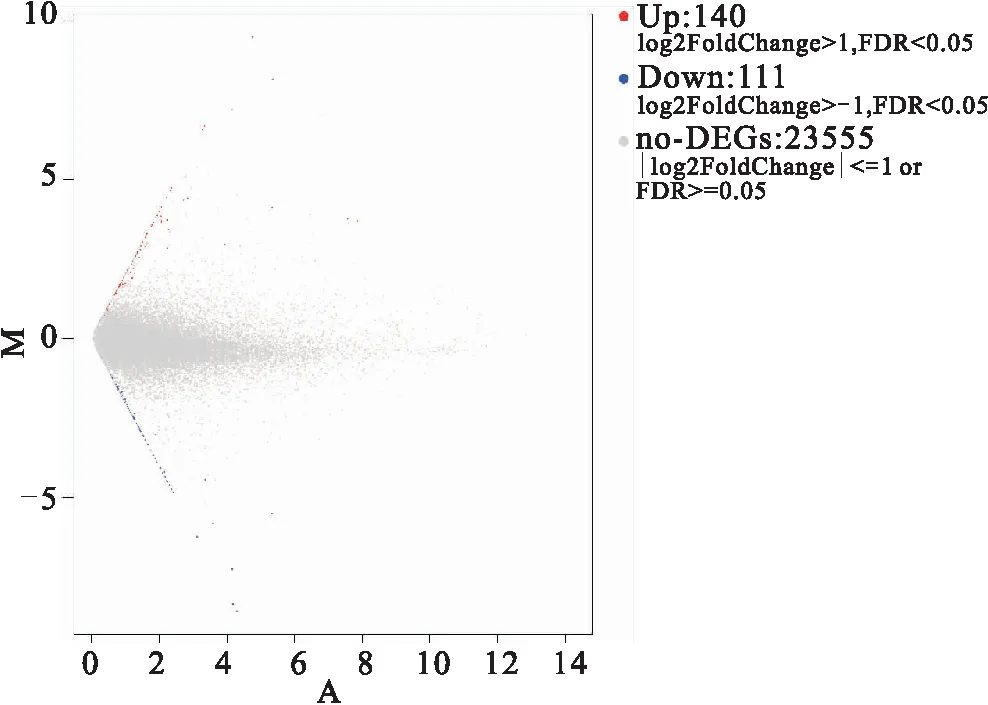
图2 差异表达基因MA图
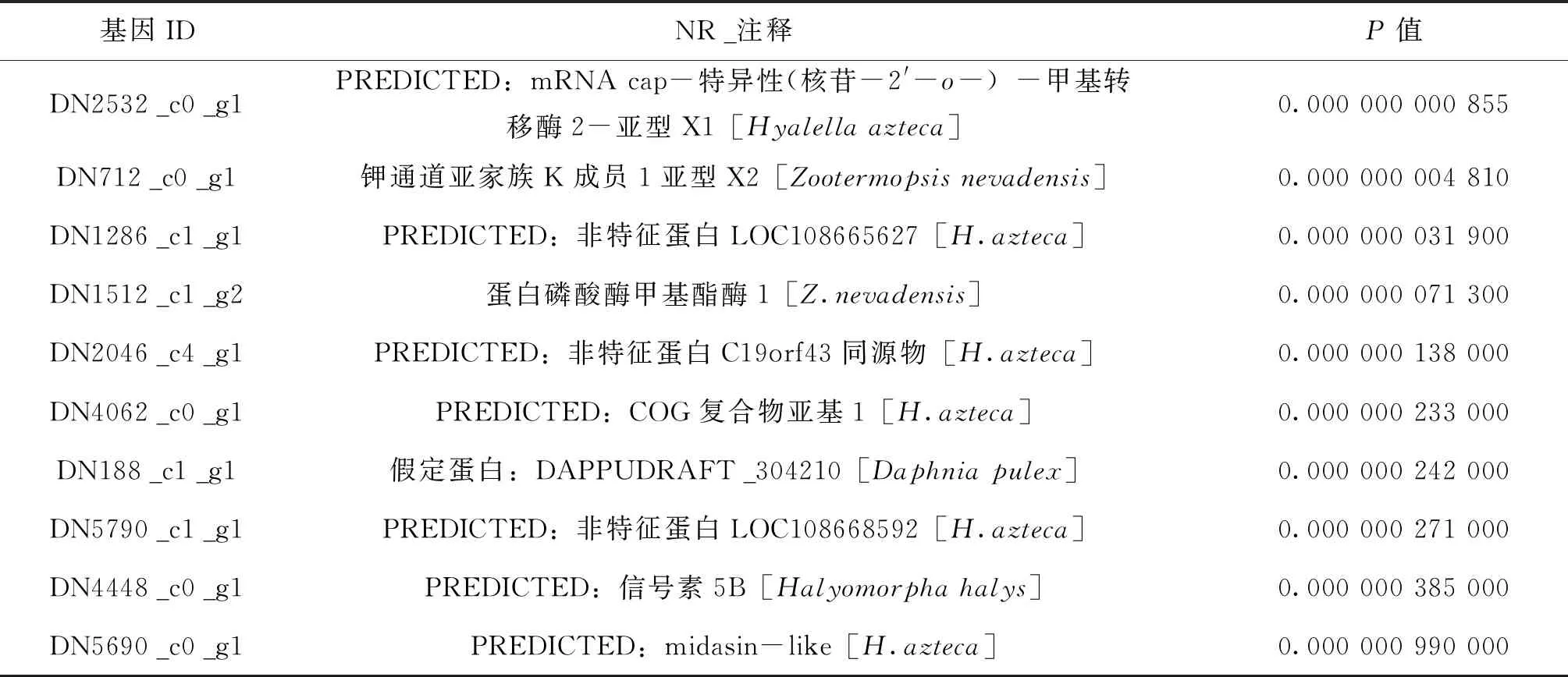
表2 低氧胁迫下克氏原螯虾差异表达最显著的前 10 个基因
2.3 差异表达基因GO功能分析
低氧应激状态下,克氏原螯虾肝胰腺产生251个差异表达基因,将其进行了GO功能富集。图3展示了克氏原螯虾DEG在GO各二级功能中的注释情况。在生物学过程中DEG注释的主要功能有细胞、代谢和调控;在细胞组分中DEG注释的功能大多数与细胞结构和机体的构建有关,如细胞、细胞成分和细胞膜;而在分子功能中,DEG注释的主要功能为催化活性、结合以及转运活性。DEG经过GO功能富集分析分别富集到生物学过程2 797个、细胞组分399个、分子功能560个GO条目。GO功能富集程度前十的条目如表3。
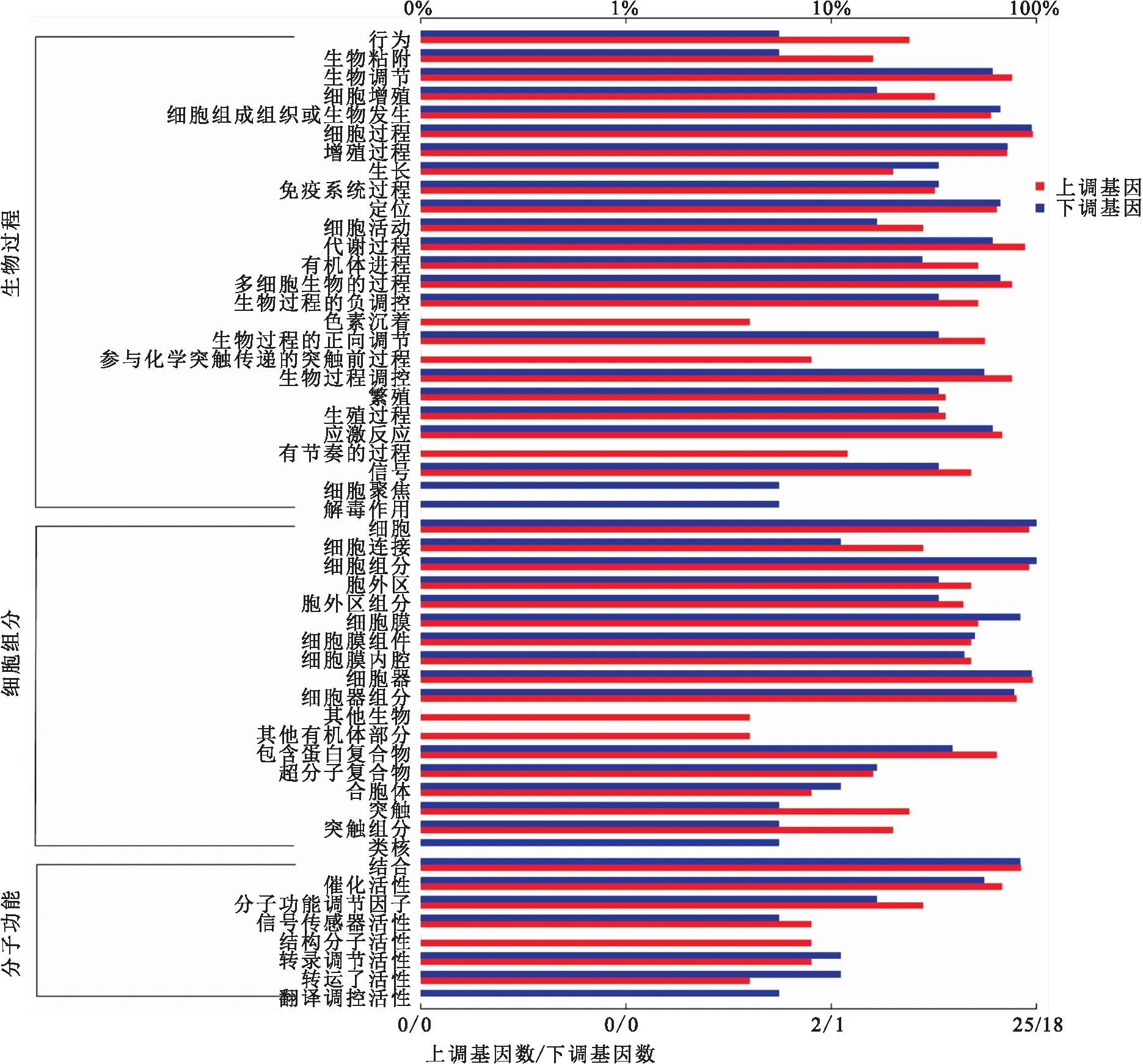
图3 差异表达基因GO二级节点注释统计图

表3 GO功能富集前十的条目
2.4 差异表达基因KEGG分析
低氧应激下和常氧状态下克氏原螯虾的肝胰腺中共有5 893个基因注释到5大类特定的KEGG通路中,分别为细胞过程(9.23%)、环境信息处理(18.48%)、遗传信息处理(8.16%)、代谢机制(44.78%)和组织系统(19.26%)。其中,在代谢机制中基因被注释到的数目最多(图4)。KEGG通路富集分析结果显示:差异表达基因主要富集在代谢途径(ko00281),不同环境下的微生物代谢(ko00280)、缬氨酸、亮氨酸和异亮氨酸的降解(ko01100)和原核生物的碳固定途径(ko00650)等信号通路(图5)。

图5 差异表达基因KEGG功能富集柱状图
3 讨论
3.1 低氧应激反应对克氏原螯虾体内离子浓度的影响
本研究结果显示,低氧应激下钾通道亚家族K成员1亚型X2基因表达量显著增加。KEGG显示,低氧应激下差异表达基因在钙信号通路和磷脂酰肌醇信号通路富集。钾通道家族蛋白跨越细胞膜形成传导通路或孔,钾、钠和钙等选择性离子通过该通路或孔跨细胞膜转运,维持细胞离子平衡。钾通道亚家族K成员1属于内向整流K+通道家族的成员[16],受胞内ATP的调控,ATP敏感通道只有在受到ATP浓度降低或者缺氧时开放率才会增加[17]。磷脂酰肌醇信号通路中会产生两个第二信使,与内质网上的配体相结合,开启钙通道,使胞内金属离子浓度升高。低氧应激会影响体内的离子浓度[18],这与本实验结果相似。可以推测低氧应激下,钾通道蛋白活跃,导致胞内金属离子浓度升高,维持细胞正常兴奋,同时通过钙信号通路和磷脂酰肌醇信号通路,激活下游相关蛋白活性,调节机体应对低氧所造成的影响。
3.2 低氧应激对克氏原螯虾物质能量代谢的影响
外界环境发生改变影响生物体内整个调控网络,包括相关基因的表达调控、物质能量代谢进而影响细胞增殖和存亡[10,11,19]。例如组蛋白H3-K36甲基化参与基因的转录激活和DNA损伤修复[20]。虾类可调节呼吸代谢方式,从有氧代谢转变为无氧代谢,以糖酵解方式获得部分能量[21];蛤蜊(Mactra)在应对急性缺氧时,各种游离氨基酸不仅可以作为渗透调节的潜在渗透剂,而且在急性缺氧暴露期间通过代谢产生能量[22]。凡纳滨对虾的研究表明,当机体处于低氧胁迫时,脂肪酸可作为一种补充物,可有效修复缺氧应激造成的损伤[23]。这与本实验的结果相似:缬氨酸、亮氨酸和异亮氨酸的降解,赖氨酸代谢、脂肪酸代谢以及糖代谢、组蛋白H3-K36甲基化负调控条目等通路显著富集,说明能量代谢在抵抗低氧应激下发挥了重要作用,推测H3-K36甲基化修复细胞所受到的损伤,脂肪酸代谢和氨基酸代谢为调节体内离子平衡,抵抗低氧应激提供了能量。在低氧应激状态下,机体无氧代谢增强,促进了糖、氨基酸和脂肪酸的无氧代谢。
3.3 克氏原螯虾在低氧应激反应下的相关信号通路
已有研究证明环磷酸腺苷(cAMP)通路、磷脂酰肌醇-3激酶(PI3K)-蛋白激酶B(AKT或PKB)信号通路和丝裂原活化蛋白激酶(MAPK)通路这三条信号通路在低氧应激过程中发挥重要作用[24-29]。这与本实验结果相似,在上述通路(图4)上差异表达基因注释较多,说明这三个信号通路在低氧应激期间比较活跃。在cAMP信号通路中,低氧应激诱导腺苷酸环化酶系统的转录上调,腺苷酸环化酶(AC)是产生cAMP的酶,部分是由低氧诱导因子-1(HIF-1)转录因子介导的[28],在低氧应激过程中,低氧诱导的其它系统中酶的磷酸化状态的变化经常与cAMP依赖蛋白激酶(PKA)联系在一起[25],从而影响克氏原螯虾的抗低氧能力。PI3K-AKT是细胞中一个经典的信号通路,涉及多个先天免疫功能相关的生理功能,在无脊椎动物应对环境刺激过程中起着关键作用[30]。已有研究发现低氧应激下PI-3K通路主要通过影响HIF-1α的稳定和(或)合成来发挥抗低氧作用[26]。HIF-1α是低氧诱导因子-1(HIF-1)的一个亚单位。HIF-1是一种不稳定的异二聚体,可以调控多种途径使机体适应低氧环境[31];MAPK通路有三级信号传递过程的功能,MAPK,MAPK激酶(MEK或MKK)以及MAPK激酶的激酶(MEKK或MKKK),这三种酶依次激活共同调节细胞的多种反应。MAPK信号通路主要有四种分别是ERK-MAPK、JNK-MAPK、p38-MAPK和ERK5-MAPK。Ras-MAPK信号通路在对DNA损伤的应答中,表现出一种自我保护应答,使DNA修复系统对损伤进行纠正[32]。MAPK信号通路参与了罗非鱼(Oreochromisniloticus)以及花鲈(Lateolabraxmaculatus)缺氧环境下的生长阶段[27,29],且HIF-1α是ERK的下游调控成员之一[24]。可以推测,这三个信号通路可能是通过协同作用刺激产生HIF-1α(图6)应对低氧应激。
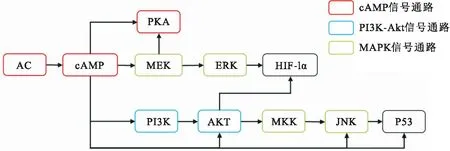
图6 cAMP、PI3K-Akt、MAPK信号通路示意图
此外,在差异表达基因GO功能富集中显示,黄体溶解功能显著富集。黄体是生物的一个内分泌腺,它的主要功能之一就是合成孕酮与雌二醇等一系列的类固醇激素以维持生物正常发育及繁殖功能[33]。黄体异常溶解会导致激素减少从而会对克氏原螯虾的性腺发育造成一定影响。已有研究证明低氧应激是通过促进黄体细胞凋亡来诱导黄体溶解[34,35]。本研究结果表明低氧应激对克氏原螯虾的性腺发育可能会带来不良影响。
4 结论
低氧应激下克氏原螯虾肝胰腺的钾通道蛋白活跃,导致胞内金属离子浓度升高,维持细胞正常兴奋,消耗大量营养物质进行能量代谢,为机体应对低氧应激提供能量;并产生各种转录因子通过钙信号通路和磷脂酰肌醇信号通路,激活下游相关蛋白活性,通过cAMP、PI3K-Akt、MAPK这三个信号通路从酶活性、机体免疫、DNA损伤修复等方面调节机体应对低氧所造成的不良影响;同时发现低氧应激导致黄体溶解,对性腺发育产生不良影响。

