基于皮肤TRP通道探讨三伏贴穴位经皮给药渗透机制的研究
赖蓉蓉,翟苑好,林媛媛,曾瑶,伍艳,徐月红
(中山大学药学院,广东 广州 510006)
三伏贴(Sanfu patch)为一种传统的中医外治疗法,是取《素问·四气调神大论篇》中“春夏养阳,秋冬养阴”的原理[1-2],于三伏阳气旺盛之际,将阳性、热性的药物敷贴于肺俞(Feishu acupoint,FS)、膏肓、膻中、天突、定喘等穴位之上[3-4],使其通过经络循行和气血输送到达病灶部位,达到调节阴阳平衡,祛除外邪的目的。目前,三伏贴多以清代名医张璐冷哮方(白芥子、延胡索、甘遂和细辛)为基础[3,5],结合不同疾病的临床特点和四时变化加减,主要用于支气管哮喘、变应性鼻炎等呼吸系统疾病的治疗[6]。现代药效学研究表明:三伏贴可以通过调节IL-4、IL-5、IL-γ和IL-2等细胞因子调节Th1/Th2免疫平衡,达到防治哮喘的目的[7]。三伏贴经穴位给药防治呼吸系统疾病具有广泛的临床基础和确切的疗效,但作为经皮给药系统,其经穴位促渗,内病外治的机理尚待探明。
瞬时感受器电位离子通道(Transient receptor potential ion channels,TRP)是广泛分布于感觉神经细胞、肥大细胞、角质形成细胞上的非选择性阳离子通道,主要介导单价或者二价阳离子,如Ca2+、K+等内流进入细胞,以响应各种化学刺激和物理刺激。TRP通道根据主要氨基酸结构的不同可以分为7个亚家族:TRPA、TRPC、TRPM、TRPML、TRPP、TRPV和TRPN[8-9]。其中瞬时受体电位香草酸亚型1[Transient receptor potential vanilloid 1,TRPV1,又称为辣椒素(Capsaicin,CAP)受体]和瞬时受体电位锚蛋白1(Transient receptor potential ankyrin 1,TRPA1)是TRP通道家族中研究较多的2种通道蛋白,不仅参与温度、pH、机械等物理刺激和化学刺激的调节,而且与瘙痒、疼痛、神经源性炎症等疾病的发生有密切关系[10-12]。2021年,诺贝尔生理或医学奖授给发现温度和触觉感受器的美国科学家David教授和Ardem教授,其中David教授首次揭示了TRPV1可以介导CAP引起的灼热、疼痛等感觉的功能并解析了TRPV1通道蛋白的冷冻电镜结构[13]。研究发现TRP通道中TRPV1及TRPA1均表达于表皮角质细胞,与表皮屏障功能密切相关[11,14]。同时,TRPV1及TRPA1也均表达于皮肤感觉神经,介导皮肤对温度和化学感知和调节,参与痛痒觉发生以及皮肤神经源炎症发生,这一点可能与三伏贴作用于皮肤后产生温感、烧灼或辛辣感及瘙痒相关。因此,我们推测三伏贴有可能通过激活穴位皮肤TRPV1和TRPA1通道而发挥经皮促渗和增效的作用。
本研究首先考察三伏贴有效成分芥子碱硫氰酸盐(Sinapine thiocyanate,SPT)和延胡索乙素(Tetrahydropalmatine,THP)对TRP通道的激活作用。以肺俞穴为代表性穴位,比较肺俞穴和非穴位(Non-acupoint,NFS)皮肤TRP通道表达的差异,并比较TRP通道激动剂激活TRP通道后三伏贴在体经皮渗透有效成分SPT和THP在穴位与非穴位皮肤滞留的差异,进一步验证TRP通道对三伏贴经皮渗透的影响。本研究为三伏贴经穴位皮肤促渗增效机制研究提供新的契入点。
1 材料
DZTW型电子调温电热套(上海邦西仪器科技有限公司),Sartorius BT 25S十万分之一天平(北京赛多利斯科学仪器有限公司),FV3000激光扫描超高分辨率显微镜(日本奥林巴斯公司),电泳仪(北京六一仪器厂),5200化学发光成像仪(上海天能公司),LC-2030岛津高效液相色谱仪(日本岛津公司)。
白芥子、延胡索、细辛药材购自广州市诚济药业有限公司;SPT对照品(批号:111702-200501)、THP对照品(批号:111726-201011)购自中国药品生物制品检定所;鼠源神经生长因子(NGF)、CAP购自美国Sigma公司;0.25%胰蛋白酶-EDTA、青霉素-链霉素、胎牛血清(FBS)、Ⅱ型胶原酶购自美国Gibco公司;DMEM/F12培养基购自美国Thermo公司;4%多聚甲醛(批号:CR2101179)、HRP标记山羊抗兔IgG购自武汉塞维尔公司;TRPA1抗体购自美国Novusbio公司;TRPV1抗体、Alexa Flour 594标记山羊抗兔IgG购自英国Abcam公司;即用型山羊血清购自武汉博士德公司;BCA蛋白浓度测定试剂盒(批号:122120210323)、RIPA裂解液(批号:11252021020)购自碧云天;ECL化学发光显色试剂盒(批号:S0023721)购自Yeasen公司;异硫氰酸丙烯酯(Allyl isothiocyanate,AITC),甲醇、乙腈(色谱纯)购自美国Sigma-Aldrich公司。
Wistar乳鼠(1~3 d)、SPF级SD大鼠,雌性,体质量180~220 g,购于中山大学(大学城)实验动物中心,实验动物合格证号:SCXK(粤)2016-0029。动物实验方案通过中山大学实验动物伦理委员会审查,实验动物伦理批号:SYSU-IACUC-2019-B235。
2 方法
2.1 三伏贴的制备
在本课题组前期的研究中,甘遂在三伏贴用药时易引起皮肤破溃,但是预防哮喘发作的作用较弱,因此本研究对三伏贴进行加减后去掉甘遂[15]。粉碎白芥子、延胡索后按质量比1∶1配伍,加入10倍量80%乙醇回流提取2 h,重复3次,合并提取液,过滤,滤液用旋转蒸发仪浓缩,得到相对密度为1.1~1.3 g·mL-1的浸膏。
用水蒸气提取法提取细辛挥发油。粉碎细辛后(细辛粒径为50~80目)加入适量水,120 ℃加热回流6 h,收集挥发油,挥发油的得率为0.64%。
每20 g浸膏中加入1 mL挥发油混合均匀,制备成三伏贴。三伏贴中有效成分SPT的含量为(27.30±0.81)mg·g-1,THP的含量为(2.87±0.18)mg·g-1。含20 μmol·L-1CAP和0.5 μmol·L-1AITC浸膏的制备:将对应量CAP和AITC与三伏贴浸膏均匀混合后制得。
SPT的高效液相色谱测定方法如下[16]:色谱柱:Kromsil 100-5-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-0.08 mol·L-1磷酸二氢钾溶液(10∶90,v/v);流速:1 mL·min-1;柱温:30 ℃;进样量:20 μL;检测波长:326 nm。
THP的高效液相色谱测定方法如下[16]:色谱柱:Kromsil 100-5-C18(4.6 mm×250 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(三乙胺调pH至6.0)(55∶45,v/v);流速:1 mL·min-1;柱温:30 ℃;进样量:20 μL;检测波长:280 nm。
2.2 三伏贴中有效成分对TRP通道的作用
2.2.1 原代背根神经元(Dorsal root ganglion,DRG)细胞提取和培养 取出乳鼠脊柱分离脊神经节,用0.1%Ⅱ型胶原酶和0.25%胰蛋白酶消化,加入血清终止消化,离心弃上清,加入含有50 ng·mL-1鼠源NGF、10%FBS、1%青霉素-链霉素的DMEM/F12培养基重悬细胞,接种培养皿内,移入37 ℃、5%CO2的培养箱。
2.2.2 Ca2+内流试验 将DRG细胞以2×104mL-1的密度接种于多聚赖氨酸包被的Confocal皿中,待细胞贴壁后,用台氏液清洗2次。各组细胞加200 μL钙离子荧光探针Fluo-4,AM(1∶1 000),避光孵育30 min后,用台氏液清洗2次,再加入400 μL台氏液,培养箱孵育15 min,于激光共聚焦扫描显微镜(Confocal laser scanning microscope,CLSM)下进行Ca2+内流实验,激发波长488 nm,发射波长516 nm。在预设时间点分别向培养皿中加入终浓度为20 μmol·L-1CAP、100 μmol·L-1SPT和100 μmol·L-1THP溶液,对细胞进行动态观察,细胞内Ca2+浓度变化(Δ[Ca2+]i)以荧光强度值的百分比值来表示,根据公式Δ[Ca2+]i=(F-F0)/F0×100%=ΔF/F0×100%计算,式中F为给药后的荧光强度峰值,F0为给药前的荧光强度基础值[17]。
2.3 肺俞穴与非穴位皮肤TRP通道表达差异
2.3.1 Western blot检测TRP通道表达差异 大鼠肺俞穴位于第三胸椎下旁开0.75 mm,以肺俞穴穴位点为中心,选取1 cm2的皮肤为肺俞穴皮肤[18],非穴位的皮肤为距离肺俞穴5 cm下1 cm2的背部皮肤。取3只SD大鼠脱颈处死后,立即分离所需皮肤并除去皮下脂肪。研碎皮肤,用RIPA裂解液提取皮肤总蛋白,BCA法测定蛋白浓度,SDS-PAGE电泳分离蛋白,转至PVDF膜,5%脱脂奶粉封闭1 h,放入稀释的TRPA1或TRPV1一抗中(1∶1 000),4 ℃摇床孵育过夜。加入稀释的二抗(1∶3 000)室温孵育1 h,TBST洗膜后用ECL化学发光显色试剂盒显影,用化学发光成像仪进行拍照,用Image J进行灰度分析
2.3.2 免疫荧光考察TRP通道表达差异 另取3只SD大鼠,根据“2.3.1”中方法获取肺俞穴与非穴位皮肤,用4%多聚甲醛4 ℃固定4 h后,在30%蔗糖中下沉过夜,OCT包埋,制作冰冻切片,于-80 ℃保存。切片放至室温后,PBS清洗3次,每次5 min,用4%多聚甲醛室温固定20 min,用即用型山羊血清封闭2 h,滴加一抗(Anti-TRPV1抗体1∶500,Anti-TRPA1抗体1∶100),于湿盒中4 ℃过夜。PBS清洗3次,每次5 min,滴加二抗(Alexa Fluor 488标记山羊抗兔IgG 1∶200,Alexa Fluor 594山羊抗兔IgG H&L 1∶200),室温孵育1 h,PBS清洗3次,每次5 min,用甘油封片。于CLSM下观察:Alexa Fluor 488激发波长488 nm,发射波长516 nm;Alexa Fluor 594激发波长590 nm,发射波长617 nm。
2.4 三伏贴对TRPA1通道的作用
将15只SD大鼠随机分为5组,根据“2.3.1”中方法确定肺俞穴和非穴位位置,分别于第0、1、2、3、7天给药,给药面积为1 cm2,给药量为0.21 g·cm-2。每次给药6 h后,将大鼠脱颈处死并立即分离所需皮肤,根据“2.3.2”中方法进行免疫荧光实验。
2.5 激动TRP通道对三伏贴穴位敷贴透皮行为的影响
2.5.1 在体透皮实验 将10只SD大鼠随机分为CAP(TRPV1激动剂)组和AITC(TRPA1激动剂)组,麻醉后将背部脱毛。其中,CAP组在左侧肺俞穴与非穴位皮肤分别给予含20 μmol·L-1CAP的三伏贴,AITC组分别给予含0.5 μmol·L-1AITC的三伏贴,在所有组别右侧的肺俞穴与非穴位皮肤给予不含CAP和AITC的三伏贴作为对照,给药面积为1 cm2,三伏贴给药量为0.21 g·cm-2。给药6 h后,将大鼠脱颈处死,擦除皮肤表面药物,剪下给药部位并剪碎,加入500 μL甲醇,超声30 min后,离心取上清液,过0.22 μm滤膜后用于HPLC测定,计算经皮渗透后SPT的皮肤滞留量。
2.5.2 激光共聚焦3D扫描 THP具有自发荧光,其在皮肤的渗透和滞留可通过CLSM可视化研究。给药方案与“2.5.1“项下一致。将皮肤角质层面朝盖玻片铺平,盖上盖玻片,进行CLSM观察。
THP的激发波长为488 nm,发射波长为520 nm。选择3D扫描模式拍摄,Image J进行荧光半定量,并用Imaris对所得荧光扫描图片进行3D重构。
2.6 统计学方法
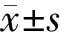
3 结果
3.1 CLSM考察三伏贴有效成分对TRP通道的作用
TRP通道属于非选择性阳离子通道,在DRG中高表达,可以通过DRG细胞内Ca2+离子浓度的变化判断受试物对TRP通道的作用,CAP是激动TRPV1的阳性对照药。如图1所示,分别考察了20 μmol·L-1CAP、100 μmol·L-1SPT和100 μmol·L-1THP对DRG细胞Ca2+浓度的影响,其中Fluo-4为Ca2+荧光探针,其荧光强度的变化可以显示Ca2+离子浓度水平。从图1A中可以看出,CAP和SPT的加入都可以引起DRG细胞Ca2+离子的内流,对TRP通道均有激活作用,而THP的加入没有引起DRG细胞Ca2+离子浓度的变化,对TRP通道没有激活作用。
注:A.分别给予20 μmol·L-1 CAP、100 μmol·L-1 SPT和100 μmol·L-1 THP后DRG细胞内Ca2+浓度变化(ΔF/F0);B.分别给予20 μmol·L-1 CAP和100 μmol·L-1 SPT前后DRG细胞的CLSM图像,标尺=20 μm
3.2 肺俞穴和非穴位皮肤TRP通道的表达
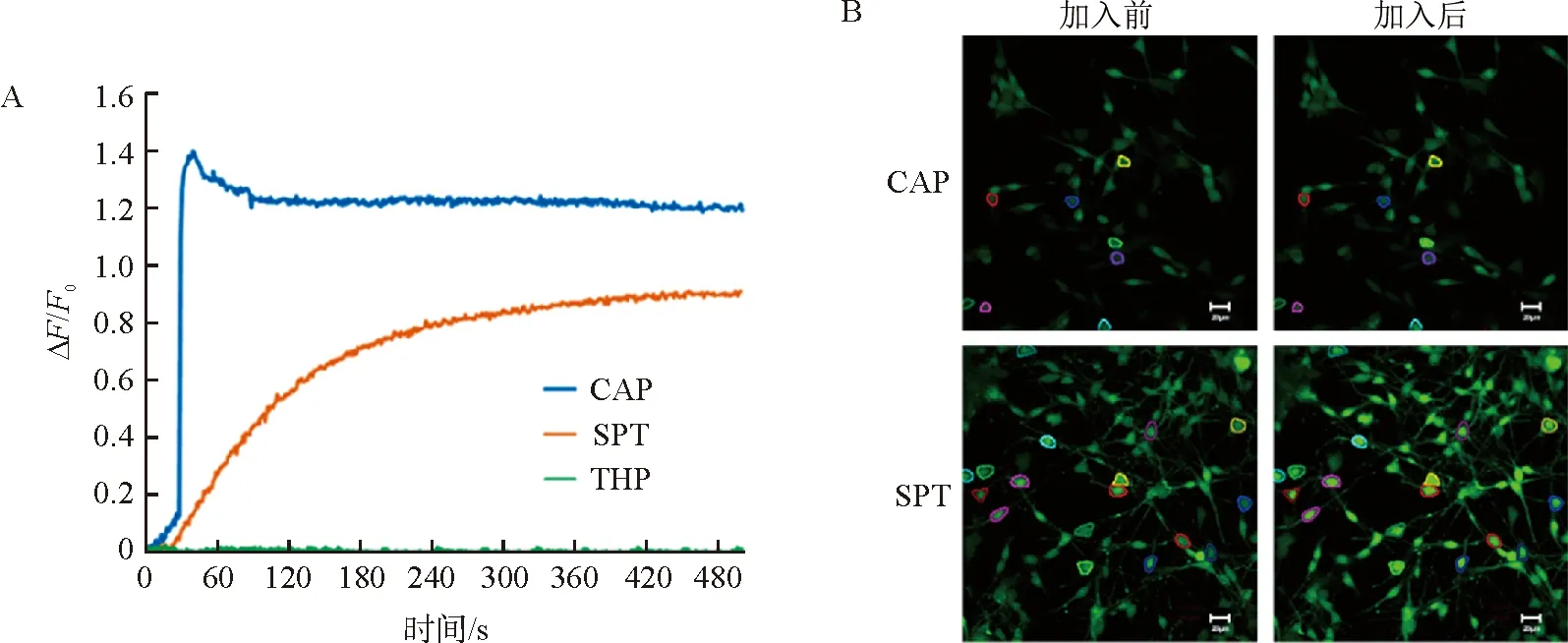
研究表明,TRP通道在感觉神经元细胞、肥大细胞和角质形成细胞中均有分布,与皮肤屏障功能有密切的关系[14,19-21]。如图2A所示,通过对大鼠肺俞穴和非穴位皮肤进行冷冻切片和免疫荧光标记可视化TRPV1和TRPA1在皮肤组织的分布,结果发现,TRPV1和TRPA1主要分布在表皮组织中,而且肺俞穴皮肤的荧光强度明显强于非穴位皮肤,说明肺俞穴皮肤TRPV1和TRPA1的表达高于非穴位皮肤。相似的结果也体现在Western blot实验(图2B)中,且该结果具有统计学差异(P<0.05),进一步证实肺俞穴皮肤TRPV1和TRPA1的表达高于非穴位皮肤。
注:A.CLSM观察肺俞穴和非穴位皮肤TRPV1和TRPA1的表达,标尺=100 μm;B.皮肤中TRPA1、TRPV1蛋白表达量的Western blot结果图和灰度分析;FS.肺俞穴组;NFS.非穴位组;与非穴位组比较,
3.3 三伏贴对肺俞穴和非穴位皮肤TRPA1表达的影响
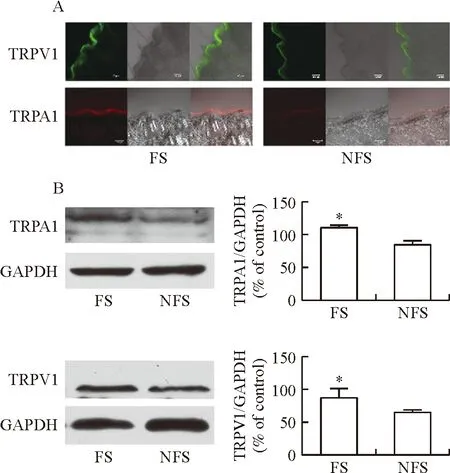
采用CLSM和免疫荧光标记分别考察三伏贴作用前和作用1、2、3、7 d后对肺俞穴和非穴位皮肤TRPA1表达量的影响。从图3可以观察到随着三伏贴作用时间的延长,肺俞穴和非穴位皮肤中TRPA1的含量逐渐下降,直至第3天几乎观察不到TRPA1的荧光标记,说明三伏贴持续给药后能够降低肺俞穴和非穴位皮肤中TRPA1表达,三伏贴的持续给药可能会导致皮肤中TRPA1的耗竭,出现TRP脱敏现象,但这个现象的机制有待进一步研究。
注:FS.肺俞穴组;NFS.非穴位组
3.4 激活TRP通道对三伏贴敷贴透皮行为的影响
为了进一步阐明三伏贴经穴位促渗的机理,本实验利用TRPV1的特异性激动剂CAP以及TRPA1的特异性激动剂AITC[13,22],观察这些激动剂激活TRPV1和TRPA1通道后对三伏贴敷贴透皮行为的影响。
3.4.1 激活TRPV1对三伏贴敷贴渗透行为的影响 首先通过在体滞留实验研究激活TRPV1对三伏贴经皮渗透行为的影响,以三伏贴中有效成分SPT为指标,对三伏贴在体滞留行为进行量化。从图4A可以看出,当20 μmol·L-1CAP与三伏贴同时作用于肺俞穴皮肤后,SPT在体滞留量可以达到(3.30±0.36)μg·cm-2,而单独三伏贴给药组的滞留量仅有(2.17±0.27)μg·cm-2,显著低于CAP+三伏贴联合给药组(P<0.05)。然而,因为非穴位中TRPV1表达显著低于穴位皮肤,CAP与三伏贴联合给药与否对SPT在非穴位皮肤的滞留量无显著影响(P>0.05),说明CAP通过激活穴位皮肤的TRPV1通道促进三伏贴中有效成分的经穴位渗透。激光共聚焦结果与在体滞留实验类似,由于THP本身具有自发绿色荧光,因此以THP为指标对三伏贴在体滞留行为进行可视化比较。从图4B~D可以看出:在CAP和三伏贴联合给药之后,穴位皮肤部位绿色荧光显著高于非穴位皮肤,且可以达到100 μm深处,而单独三伏贴给药组药物到达的深度为60 μm。此外,CAP对于非穴位皮肤的渗透行为无显著影响。
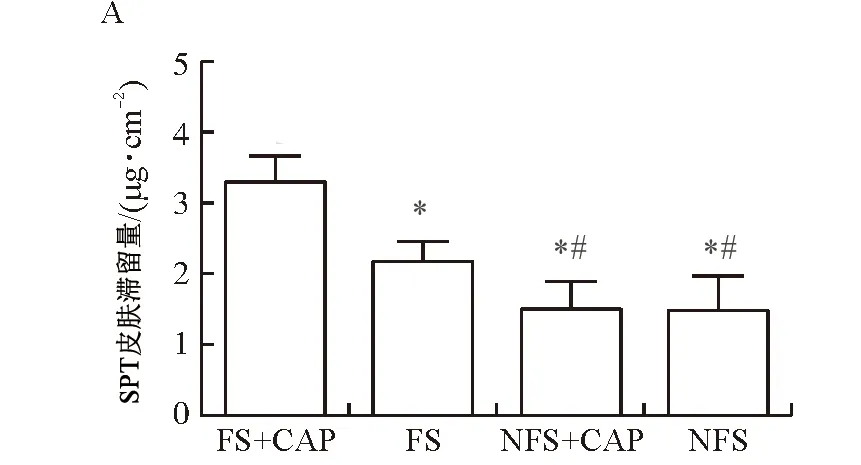
注:A.CAP与三伏贴同时作用于大鼠皮肤6 h后SPT在体皮肤滞留量;B.CAP与三伏贴同时作用于肺俞穴和非穴位皮肤后皮肤不同深度的CLSM图像;C.大鼠不同皮肤深度的荧光半定量图;D.荧光三维重构图,标尺=200 μm;FS+CAP.CAP和三伏贴联合给予大鼠肺俞穴皮肤组;FS.仅给予三伏贴于大鼠肺俞穴皮肤组;NFS+CAP.CAP和三伏贴联合给予大鼠非穴位皮肤组;NFS.仅给予三伏贴于大鼠非穴位皮肤组;与FS+CAP组比较,*P<0.05;与FS组比较,
产生这种现象的原因可能是:①肺俞穴皮肤TRPV1的表达量显著高于非穴位皮肤;②激活TRPV1对肺俞穴皮肤屏障功能的影响更强,从而能促进三伏贴的经穴位渗透。
3.4.2 激活TRPA1对三伏贴经皮渗透行为的影响 通过在体滞留实验对TRPA1激活后三伏贴中有效成分SPT的透皮行为进行量化。从图5A中可以看出,当TRPA1通道特异性激动剂AITC与三伏贴共同作用6 h后,SPT在肺俞穴皮肤中的滞留量[(3.05±0.40)μg·cm-2]显著高于三伏贴单独给药组[(2.11±0.30)μg·cm-2](P<0.05),但是AITC对SPT在非穴位皮肤中的滞留量没有显著影响(P>0.05)。对于激光共聚焦结果,如图5B~D所示:当0.5 μmol·L-1AITC与三伏贴同时作用于肺俞穴皮肤时,与单独三伏贴组相比,THP在肺俞穴皮肤的绿色荧光更强,且能达皮肤更深处(140 μm)。而当AITC与三伏贴同时作用于非穴位皮肤,THP在非穴位皮肤的绿色荧光强度仅略微增强。
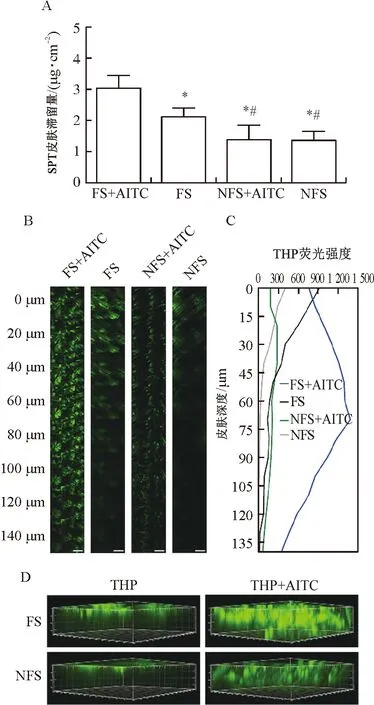
注:A.AITC与三伏贴同时作用于大鼠皮肤6 h后SPT在体皮肤滞留量;B.AITC与三伏贴同时作用于肺俞穴和非穴位皮肤后皮肤不同深度的CLSM图像;C.大鼠不同皮肤深度的荧光半定量图;D.荧光三维重构图,标尺=200 μm;FS+AITC.AITC和三伏贴联合给予大鼠肺俞穴皮肤组;FS.仅给予三伏贴于大鼠肺俞穴皮肤组;NFS+AITC.AITC和三伏贴联合给予大鼠非穴位皮肤组;NFS.仅给予三伏贴于大鼠非穴位皮肤组;与FS+AITC组比较,*P<0.05;与FS组比较,
4 讨论
本课题组前期的研究已经证明:三伏贴经肺俞穴皮肤的透过量、稳态渗透速率以及皮肤滞留量均显著高于非穴位皮肤,并比较了穴位和非穴位皮肤在物理渗透屏障上的区别,包括皮肤电阻和角质层厚度[23-24]。为进一步研究三伏贴经穴位促渗以及内病外治的机制,本研究从穴位与非穴位皮肤的神经屏障进行研究。通过研究三伏贴中有效成分对TRP通道的激动作用以及肺俞穴和非穴位皮肤TRP通道表达量的差异,阐明了三伏贴经穴位促渗与TRP通道相关。通过在体滞留实验和激光共聚焦可视化进一步对这个结论进行了验证。本研究还探讨了三伏贴给药后对大鼠肺俞穴和非穴位皮肤TRPA1通道表达量的影响,有助于解释三伏贴内病外治,产生“经脉-脏腑”相关效应的机制[25]。
有研究表明,芥子油中的异硫氰酸酯化合物可以激活TRPA1通道[22]。而实验结果显示三伏贴中的有效成分SPT对TRP通道的TRPV1也具有激活的作用,而且肺俞穴TRPV1和TRPA1的表达量明显高于非穴位皮肤,证实三伏贴中SPT对TRP通道的激活作用是三伏贴在肺俞穴的经皮渗透和滞留量高于非穴位皮肤的原因之一。另外,实验结果显示三伏贴的持续给药可以引起穴位和非穴位皮肤中TRPA1表达量下降。这可能是因为三伏贴作用于穴位皮肤后,通过持续激动TRPA1通道,导致穴位皮肤TRPA1通道蛋白耗竭从而脱敏[26-29]。同时,激活TRP通道并脱敏最终导致表达TRP的感觉神经脱敏或去功能化是TRP激动剂临床发挥作用的机理之一,如CAP临床的止痛止痒作用[30-31]。TRPA1除了在皮肤中有表达,在肺组织也有表达,而且激动TRPA1可以引起类似支气管收缩、黏液分泌、气道炎症、刺激和咳嗽等哮喘反应[32-34],因此推测TRPA1通道可能是肺俞穴与肺产生“经脉-脏腑相关”效应的机理之一,三伏贴持续激动皮肤上的TRPA1通道致其耗竭脱敏,可能会进一步导致呼吸道中迷走神经和感觉神经纤维上的TRPA1通道蛋白脱敏或表达下调,从而发挥在哮喘缓解期预防及治疗哮喘的作用。我们将进一步对此皮肤-肺脏的级联调控进行研究,期望能进一步基于TRP通道阐明三伏贴内病外治,通过“经络-脏腑”相关效应防治哮喘的机制。

