雄黄外用对三阴性乳腺癌上皮间质转化的调控作用研究
王春晖,楚爱景,朱振宇,裴晓华
(1.北京中医药大学房山医院,北京 102400;2.北京中医药大学厦门医院,福建 厦门 361001;3.北京中医药大学第三临床学院,北京 100020)
随着医学技术的进步,乳腺癌的治疗日臻成熟和完善,早期诊断和治疗使乳腺癌患者获益,但统计数据表明:超过90%乳腺癌相关死亡并不是由于原发肿瘤引起的,而是因为出现了远处转移,转移性乳腺癌通常被认为是不能治愈的,因此治疗后发生远处转移是乳腺癌患者死亡的首要原因[1]。由此可见,抑制乳腺癌转移是提升疗效和延长患者生存期的关键。上皮间质转化(Epithelial-mesenchymal transition,EMT)是指上皮细胞失去上皮特征而获得间质特征,细胞黏附丧失,表型由典型的长方体变为细长纺锤形,导致细胞迁移、侵袭、抗凋亡、免疫抑制等能力增强[2-3]。在乳腺癌转移早期的原发肿瘤细胞中,随着细胞增殖、微环境变化以及其他外部因素刺激等,EMT过程启动,导致乳腺癌细胞表型发生变化、新血管生成和基底膜重建[4],细胞的侵袭力增强,进而乳腺癌细胞可作为循环肿瘤细胞(CTCs)进入血液或淋巴管系统[5],CTCs在血管和淋巴管中存活并突破屏障,发生间质-上皮转化,肿瘤细胞重新获得上皮细胞增殖特性,最终到肺、骨骼、大脑等部位,形成转移灶[6]。由此可见,EMT在乳腺癌转移过程中作用关键,抑制EMT发生是抗乳腺癌转移的关键环节。
中医典籍中有关雄黄治疗恶疮及恶性肿瘤的治法由来已久,雄黄作为攻毒类中药代表之一,具有拔毒化腐、祛瘀消癥功效,常用于治疗痈肿疔疮、癌性翻花,如将雄黄与青黛、三七配伍,研粉口服治疗骨髓增殖性肿瘤[7];或使用雄黄外敷治疗乳腺癌、皮肤癌、宫颈癌、肠癌等多种肿瘤溃破创面[8],均获得良好效果。我们前期研究发现,雄黄可通过上调凋亡因子Caspase-3、Bax、Bid,下调抑凋亡因子Survivin、Bcl-2抑制乳腺癌[9]。因此,我们设计本研究,进一步探讨雄黄抗乳腺癌的药用价值。
1 材料与方法
1.1 实验细胞和实验动物
人三阴性乳腺癌MDA-MB-231细胞购于国家生物医学实验细胞资源库。
Balb/c雌性裸小鼠,SPF级,体质量16~20 g,5~6周龄,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011,动物实验伦理号:2021B129,饲养于中国中医科学院中药研究所。
1.2 主要试剂及仪器
1.2.1 主要药品 雄黄:主要成分为二硫化二砷,约200目,粒径小于76 μm,纯度98%,批号:140408(长沙市医药公司);卡培他滨片:0.5 g×12片,批号:H20073024(上海罗氏制药有限公司)。
1.2.2 主要试剂 1640培养基原液(Gibco,C11875500BT);胎牛血清(Gibco,10099-141);RIPA裂解液(艾旗,S1004);细胞膜蛋白与细胞浆蛋白抽提试剂盒(碧云天,P0033);BCA蛋白浓度测定试剂盒(碧云天,P0012);上皮钙黏蛋白(E-cadherin),rabbit pAb(Proteintech,20874-1);波形蛋白(Vimentin),rabbit mAb(Cell Signaling,5741T);Vimentin,mouse mAb(Cell Signaling,5741T);TGF-β1, rabbit mAb(Abcam, ab215715);Twist1, mouse mAb(Proteintech, 60330-1);Slug, mouse mAb(Abcam, ab51772);VEGFA,mouse mAb(Proteintech, 66828-1);GAPDH,mouse mAb(Proteintech,60004-1);蛋白质常规分子量标记(10~180 kDa)(Proteintech,PL00001); HRP-conjugated affinipure goat anti-mouse IgG(H+L)(Proteintech,SA00001-1);HRP-conjugated affinipure goat anti-rabbit IgG(H+L)(Proteintech, SA00001-2);超敏ECL化学发光试剂盒(NCM Biotech,P10100)。
1.2.3 主要仪器 高分辨显微分析系统(DM4B,德国LEICA);蛋白质印迹定量分析仪(c600,美国Azure biosytems);热循环PCR仪(T100 Thermal Cycler,美国Bio-rad);荧光定量PCR仪(CFX96 touch,美国Bio-rad)。全自动封闭式组织脱水机(ASP200S,德国Leica),石蜡切片机(RM2235,德国Leica),全自动血液检测仪(BC6600,中国迈瑞)。
1.3 造模及干预方法
取对数生长期状态良好的MDA-MB-231细胞,用胰酶常规消化后,以1∶1比例与无血清培养基RPMI1640混匀制成单细胞混悬液,调整细胞悬液浓度为5×106mL-1,冰上放置保存。将细胞悬液混匀后,用1 mL注射器注入雌性裸小鼠左侧第二对乳房垫内,每只0.1 mL。细胞悬液注入后,可见局部卵圆形皮肤隆起,以乳头位于隆起中心为准。每日观察乳房垫内情况,第7~10天以裸鼠注射区域可见芝麻样隆起肿物为造模成功(15 mm3或瘤体大小为3 mm×3 mm)。造模成功后,随机分组进行药物干预。
根据小鼠与人的用药剂量换算公式计算给药剂量。卡培他滨片给药量为:7.8 mg·d-1;雄黄外用为探讨性研究,药物浓度的设定为自拟,以醋调雄黄,浓度为0.5 g·mL-1。具体分组及干预方法见表1。
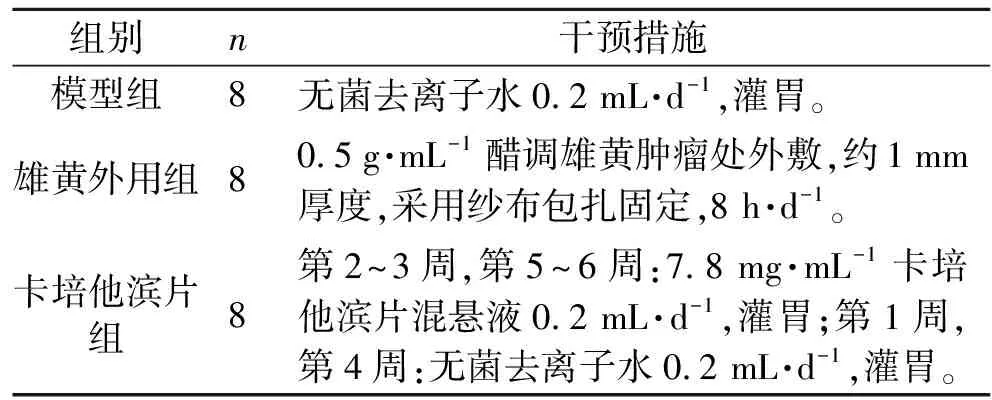
表1 分组及干预措施
1.4 一般状态观察
观察不同组别裸小鼠一般状态,体质量变化,详细记录、绘制体质量变化曲线。造模成功后,干预第0、7、14、21、28、35、42天用游标卡尺测量体表肿瘤横轴、纵轴长度,计算体表肿瘤体积,绘制肿瘤生长曲线。取材后肿瘤组织称质量,根据以下公式并计算抑瘤率。抑瘤率=(模型组平均瘤质量-给药组平均瘤质量)/模型组平均瘤质量×100%。
1.5 HE染色
石蜡包埋肿瘤组织样本,进行组织切片,烤片机烘烤切片,二甲苯脱蜡处理后无水乙醇浸泡,然后进行梯度乙醇水化,自来水冲洗,加入苏木素染色,自来水冲洗,75%盐酸乙醇溶液分化,自来水冲洗后返蓝液处理,自来水冲洗后用0.5%伊红染色,水冲洗后继续梯度乙醇脱水,再经二甲苯透明处理后,加入树脂封片后风干,显微镜下筛选观察。
1.6 免疫组化
烘烤切片,二甲苯脱蜡,无水乙醇浸泡,梯度乙醇水化后再用自来水冲洗。放入柠檬酸缓冲液高压煮沸,进行抗原修复,冷却后PBS冲洗,滴加3%过氧化氢酶浸泡,PBS反复冲洗,滴加血清封闭,吸去封闭液后,滴加一抗,4 ℃过夜。复温后使用含有1%BSA的PBS冲洗,加入二抗37 ℃孵育,再使用含有1%BSA的PBS冲洗,DAB显色后自来水冲洗,苏木素浸染→自来水冲洗→分化液→自来水冲洗→返蓝液→自来水冲洗→梯队乙醇脱水→二甲苯透明化,树脂封片后风干,显微镜下观察筛选。
1.7 血常规和肝、肾功能检测
利用血液细胞分析仪、生化分析仪检测白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)、血小板(PLT)等血常规检测项目及谷丙转氨酶(ALT)、谷草转氨酶(AST)、血肌酐(CRE)、尿素氮(BUN)含量。
1.8 Western blot检测
提取肿瘤组织蛋白,然后用BCA法进行蛋白定量。取蛋白上样,配置10%分离胶,5%浓缩胶。电泳、电转后,5%脱脂牛奶封闭2 h,一抗4 ℃过夜;TBST清洗,加入二抗辣根酶标记山羊抗兔IgG(HRP)或辣根酶标记山羊抗鼠IgG 1∶8 000室温孵育1 h,TBST清洗。用超敏ECL化学发光液显现条带,并用生物成像系统拍照,Image J图像分析软件进行灰度值分析。
1.9 qPCR检测
按照试剂盒指示对肿瘤组织进行RNA提取,最后加入30 μL RNase free water溶解RNA,吹打混匀。利用紫外分光光度计分析对总RNA进行定量。反转录cDNA,利用PCR热循环仪进行PCR反应。采用相对定量2-ΔΔCt法进行qPCR结果分析。所用引物序列如表2。
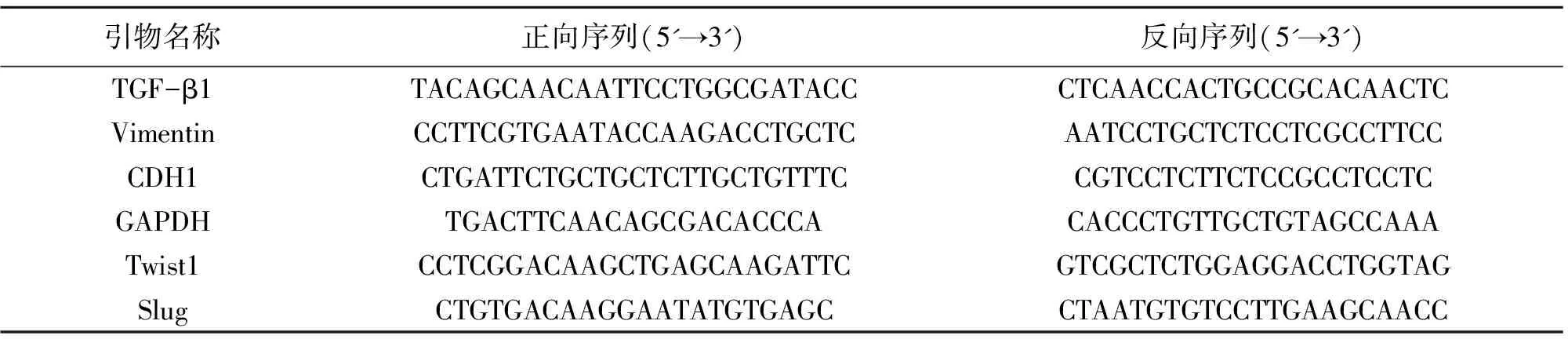
表2 引物序列
1.10 统计学方法
2 结果
2.1 雄黄外用对荷瘤裸鼠一般情况及移植瘤生长的影响
各组裸鼠随着观察时间延长,呈现不同程度的反应迟缓、活动减少、食欲减退、精神萎靡,脊骨突出等表现,个别裸鼠因瘤体较大,症状较重。在观察3周后,个别裸鼠肿瘤部位出现皮肤溃破,表面颜色为黑褐色。各组裸鼠体质量虽呈上升趋势,但均伴有不同程度的肿瘤恶病质表现,组间体质量未见明显统计学差异,见图1。
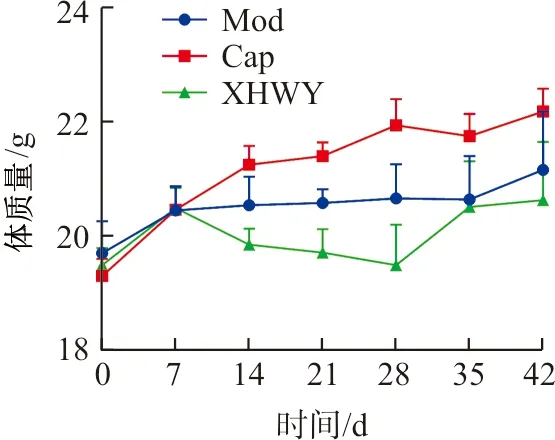
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组
各组裸鼠肿瘤体积随时间延长而逐渐增大,自第14天起至第42天,卡培他滨组肿瘤体积明显小于模型组,差异具有统计学意义(P<0.05)。自第35天起至第42天,雄黄外用组肿瘤体积明显小于模型组,差异具有统计学意义(P<0.05)。卡培他滨组和雄黄外用组相比,肿瘤体积无明显统计学差异(P>0.05),见图2。
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组
与模型组相比,卡培他滨片组瘤体质量明显小于模型组,差异有统计学意义(P<0.05);雄黄外用药组瘤体质量小于模型组,但无统计学意义。卡培他滨片抑瘤率为65.88%,雄黄外用抑瘤率为30.2%。见图3。
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组;与模型组比较,*P<0.05。
2.2 雄黄外用对裸鼠肿瘤组织病理变化的影响
如图4所示,HE染色可见在各组肿瘤组织中,癌细胞排列杂乱不规则,紧凑成巢状,细胞大小形态不一,细胞核核仁较大,异型性明显。模型组癌细胞几乎未见明显坏死,细胞拥挤,排列杂乱无序,细胞核深染,且呈多核及异形。与模型组相比,卡培他滨片组和雄黄外用组可见不同程度的癌细胞坏死,坏死区域呈粉红色,细胞形态失常,细胞核减少或几乎见不到细胞核,卡培他滨片组坏死区域最为广泛及明显。
图4 各组肿瘤组织HE染色比较
2.3 雄黄外用对裸鼠肿瘤组织中E-cadherin、Vimentin的影响
图5所示,E-cadherin蛋白在模型组中表达较低,卡培他滨片和雄黄均能上调E-cadherin表达(P<0.05),其中卡培他滨片组表达最强;模型组中Vimentin呈强表达,卡培他滨片及雄黄均可不同程度地降低Vimentin表达(P<0.05)。
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组;与模型组比较,*P<0.05;与卡培他滨片组比较,#P<0.05。
2.4 雄黄外用对裸鼠血常规和肝、肾功能的影响
各组之间AST、ALT、BUN、CRE、WBC、RBC、HGB、PLT等数值未见明显统计学差异(P>0.05)。
2.5 雄黄外用对裸鼠乳腺癌EMT相关因子蛋白表达的影响
如图6所示,与模型组比较,雄黄外用组和卡培他滨片组肿瘤组织中E-cadherin蛋白表达明显增强,Vimentin、Slug、Twist1、TGF-β1蛋白表达明显减弱,且差异具有统计学意义(P<0.05)。卡培他滨片对E-cadherin和TGF-β1调控作用优于雄黄外用。
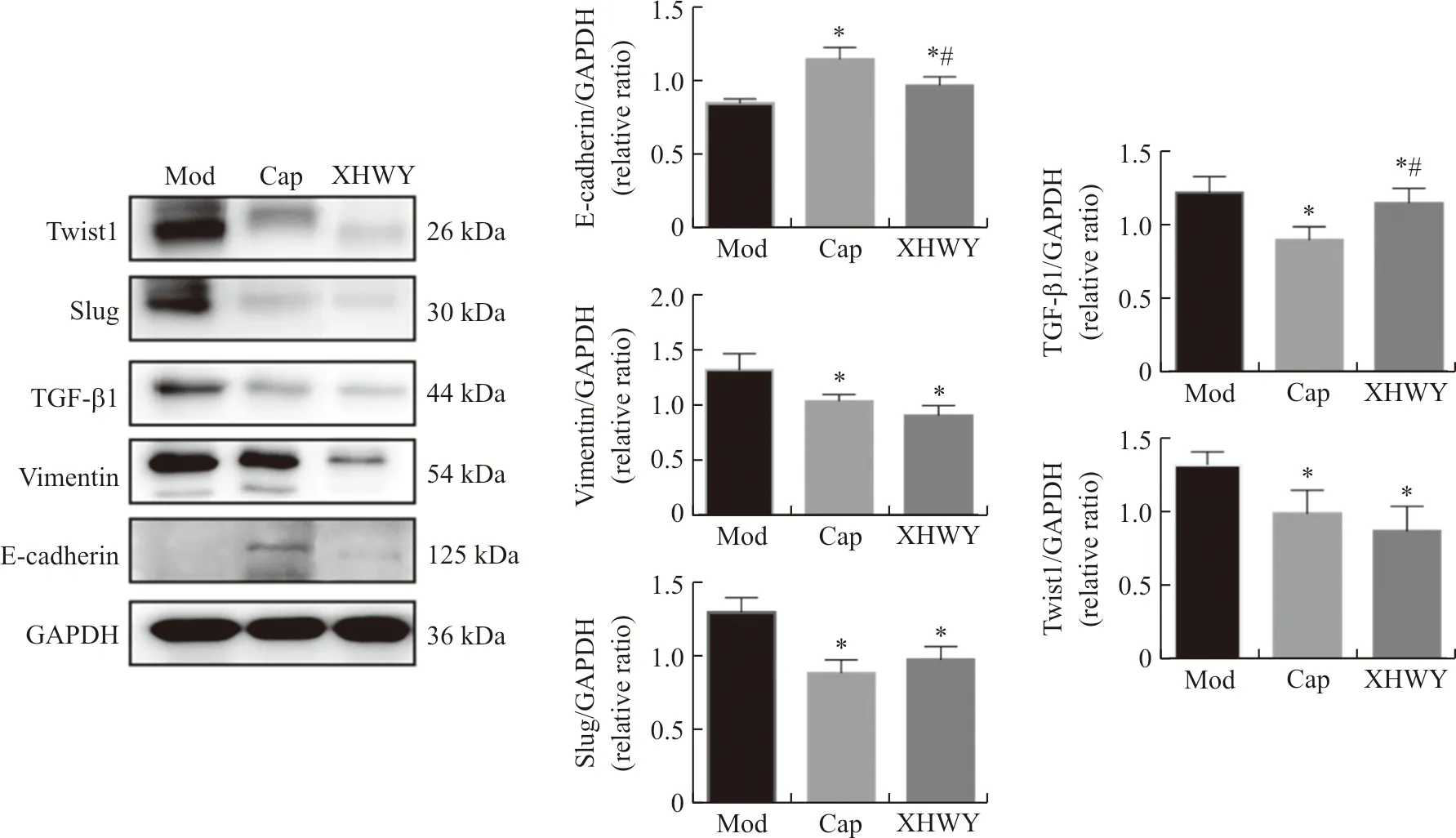
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组;与模型组比较,*P<0.05;与卡培他滨片组比较,#P<0.05。
2.6 雄黄外用对裸鼠乳腺癌EMT相关因子mRNA表达的影响
如图7所示,与模型组比较,雄黄外用组肿瘤组织中E-cadherin(CDH1)mRNA表达增强,Twist1、Vimentin、TGF-β1 mRNA表达减弱,差异具有统计学意义(P<0.05);对于Slug mRNA表达则仅呈现减弱趋势,差异无统计学意义(P>0.05)。对于TGF-β1 mRNA的调控,雄黄外用组的效果优于卡培他滨片组(P<0.05)。
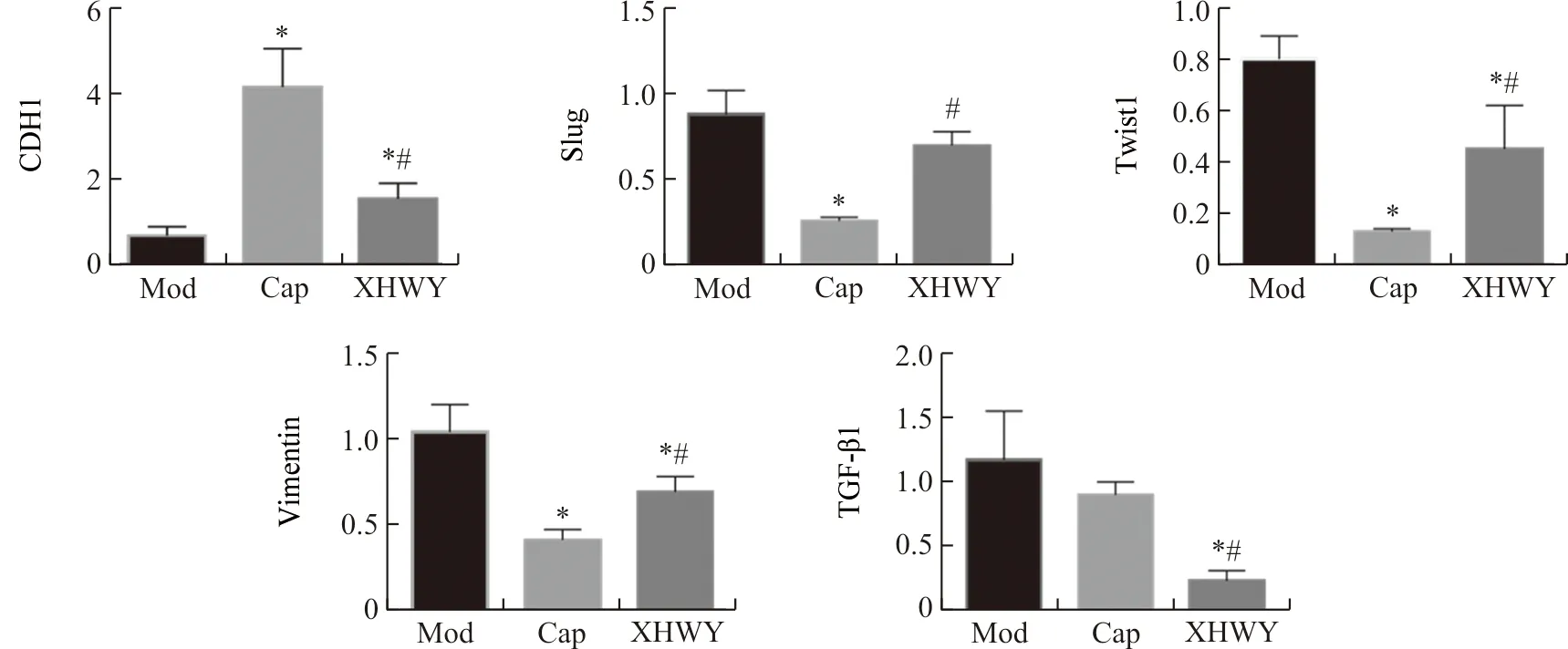
注:Mod.模型组;Cap.卡培他滨片组;XHWY.雄黄外用组;与模型组比较,*P<0.05;与卡培他滨片组比较,#P<0.05。
3 讨论
中医外治法历史悠久,在痈疽肿疡方面甚为普遍。在《灵枢·痈疽》中就有记载:“发于腋下赤坚者,名曰米疽,治之以砭石,欲细而长,疏砭之,涂以豖膏。”[10]广义的中医外治法是指在中医基础理论指导下,将中药或其他器具作用于皮肤、孔窍、经络、俞穴等部位,发挥疏通经络、调节气血、解毒化瘀、扶正祛邪等作用的治疗方法;狭义的中医外治法则是指利用中药药粉或新鲜药草加入蜂蜜、醋等调成膏状,敷于局部起到治疗作用的治疗方法[11]。中医外治法广泛运用于抑制肿瘤、改善癌痛、减轻放化疗不良反应等方面,其方式主要包括敷、贴、涂、擦、熏、蒸、洗、浴等,其目的是为了使药物通过皮肤腺体直达浅层肿瘤病灶,直达靶区;同时使药物经皮下毛细血管进入人体内循环系统,在血液、淋巴及其周围发挥抗肿瘤的作用。
“癌毒”这一概念是中医对肿瘤病因病机认知的新理论,许多医家都认为肿瘤的发生发展以及患者预后都与“癌毒”存在关联性[12]。乳腺癌属于中医“乳岩”范畴,纵观其发病过程,与“毒聚”关联密切,其易发生转移多是由于“余毒”流窜。由此可见,“癌毒”不仅是乳腺癌发生的重要条件之一,亦与其进展密切相关,是乳腺癌转移不可缺少的重要因素[13]。EMT是乳腺癌发生转移的关键驱动因素,它使乳腺癌细胞获得转移能力,这也与中医“癌毒”走窜性特点具有相似之处。因此,我们假定EMT为“癌毒”的组成部分,抑制EMT发生则相当于攻伐限制“癌毒”。中医素有攻毒治法之说,常用于恶性肿瘤的治疗,它包括广义和狭义两个范畴:广义的攻毒治法是以攻为治,指针对毒邪而施治的特殊治疗手段与方法;狭义的攻毒治法则是指以有毒之药治病的方法[14]。有毒中药即中毒剂量和治疗使用剂量相接近的一类中药,亦称攻毒类中药。《中医大辞典》中治法术语“以毒攻毒”是指使用有毒药物治疗恶疮病毒的方法[15]。由此可见,攻毒治法可理解为应用有毒中药治疗肿瘤以达到祛除癌毒、调节机体阴阳平衡的目的。综上所述,我们选择雄黄外用为治疗方法,并以醋调和雄黄制成糊状外敷肿瘤处,取醋散瘀解毒之功,共奏箍集围聚,收束癌毒作用,观察其对乳腺癌EMT的作用,以验证我们的假设。
EMT是一个复杂的过程,E-cadherin和Vimentin常被用作为乳腺癌EMT标志物:E-cadherin的主要作用为促进上皮细胞之间的黏附,它常被作为EMT典型改变的上皮标物[16-17],也与乳腺癌的侵袭力、肿瘤分级以及预后关系密切[18],E-cadherin功能或表达被抑制时,可能导致间质形态的改变,增加肿瘤细胞的侵袭和转移能力[19];Vimentin作为间充质细胞的标记物,其表达与肿瘤侵袭力呈正相关,也常被用为肿瘤发生EMT的标志物[20]。EMT相关的转录因子(EMT-Transcription factors,EMT-TFs),包括Snail1/Slug家族[21]、Twist[22]、dEF1/ZEB1和SIP1/ZEB2[23-24]等,它们以各种组合方式诱导促进间充质形态的基因表达,并抑制维持上皮状态的基因表达。本研究中经过雄黄干预后,肿瘤组织中E-cadherin表达增强,Vimentin、Slug、Twist1、TGF-β1表达减弱,说明雄黄外用在一定程度上可维持乳腺癌组织中上皮状态,抑制间质化的发生,具有一定的抗肿瘤作用和抗转移潜力。但是雄黄外用在调控TGF-β1蛋白表达和Slug mRNA表达方面,效果弱于作为对照药的卡培他滨片,但与模型组相比整体效果与抑制EMT相符合,说明雄黄外用对乳腺癌EMT的整体调控作用是有效的。另外,研究结果显示对于TGF-β1因子,在蛋白表达层面雄黄外用效果弱于卡培他滨片,但在基因表达层面雄黄外用效果优于卡培他滨片,这个效果差异可能与TGF-β1因子在细胞分布位置或药物作用细胞位置有关,有待于进一步研究探讨。另外,实验结果中各组裸鼠的肝、肾功能和血常规指标无差别,在一定程度上可以说明外用雄黄的安全性,但是并没有进一步深入地探讨其毒理,关于雄黄安全剂量有待于进一步探讨和验证。
综上所述,雄黄外用可在一定程度上抑制人三阴性乳腺癌裸鼠模型中肿瘤的发展,可通过上调E-cadherin表达,下调Vimentin、Slug、Twist1、TGF-β1表达,实现对乳腺癌EMT的调控作用,具有一定抗乳腺癌转移的潜力,但具体作用机制仍待进一步研究。

