气道滴注PM2.5混悬液并灌胃给予橄榄苦苷的去势雌性大鼠股骨骨密度及骨矿物盐含量变化
林晓莉,黄惠娟,杨荟
1 福建中医药大学中西医结合学院,福州 361005;2 厦门大学附属东方医院妇产科
女性绝经后出现的以骨量减少、骨微结构改变和骨代谢异常为主要特征的一种原发性骨质疏松称为绝经后骨质疏松症(Postmenopausal osteoporosis,PMOP)。绝经后骨质疏松是导致绝经后女性骨折的重要原因之一[2]。PM2.5 是空气的主要污染源之一,与呼吸道疾病的发生发展密切相关[3]。我们前期研究[1]发现,去势雌性SD 大鼠的骨密度低于未去势大鼠,暴露于一定浓度PM2.5 下的去势雌性SD大鼠骨密度相较于去势未PM2.5 暴露的雌性大鼠更低,因此,PM2.5 暴露可能加速PMOP 的发生和发展。橄榄苦苷是一种提取自橄榄叶的化合物,具有抗氧化、抗炎、抗癌及保护心脑血管等作用[4]。动物研究[5]发现,橄榄苦苷可增加去势力小鼠左股骨骨密度。但橄榄苦苷对PM2.5 暴露下的去势大鼠骨密度的影响如何,目前相关研究较少。为此,2021年3-9 月,我们观察了道滴注PM2.5 混悬液并灌胃给予橄榄苦苷的去势雌性SD 大鼠左股骨骨密度及骨矿物盐含量变化,现报告如下。
1 资料与方法
1.1 动物、试剂及仪器 30 只8 周龄SPF 级健康雌性性成熟Sprague-Dawley 大鼠[实验动物许可证号为SCXK(浙)2019-0002],体质量约200 g,动物实验管理依照实验动物管理委员(IACUC)会指导方案进行在中国人民解放军联勤保障部队第九00医院比较医学中心动物房单笼饲养(摄入食物59%碳水化合物,7%脂肪,21%蛋白质,13%矿物质),保持干燥、通风、安静,每日光照时间一定,室温18 ℃~25 ℃,自由摄食和饮水。动。Thermo Sciencce GUV-15-H-1 大流量采样器;双能X 线骨密度仪(型号:HOLOGICDISCOVERYW,美国)。
1.2 大鼠分组、PM2.5 及橄榄苦苷给予方法 30只大鼠适应性喂养1 周后称量体质量,并按照随机表法将其分为观察组20只和对照组10只,观察组又分为观察组1、观察组2,每组10只。
1.2.1 大鼠去势方法 取30 只SD 大鼠,腹腔注射0.1%戊巴比妥钠溶液(45 mg/kg)麻醉。俯卧位固定大鼠,以背部后正中线旁开1.5 cm、双侧肋缘下1 cm 为切口,切开皮肤钝性分离皮下组织,切开肌层,暴露腹腔,切口视野可见白色脂肪,拨开脂肪,可见脂肪包裹呈粉红色桑葚状的卵巢,轻柔分离卵巢下输卵管与脂肪,组织钳夹闭卵巢下输卵管,用慕斯线将输卵管结扎,剪除卵巢,将断端输卵管送回腹腔,间断缝合肌层、皮肤,用碘伏再次消毒皮肤缝合口。同一方法切除大鼠另一侧卵巢。术后于大鼠大腿肌肉内注射青霉素G 钠盐40 000 IU。
1.2.2 PM2.5干预方法 ①PM2.5的采集:选取中国人民解放军联勤保障部队第九00医院旧病房大楼7层为采样点,用Thermo Sciencce GUV-15-H-1 大流量采样器采样。用石英纤维膜(英国Whatman 公司)采集大气PM2.5。每连续采样24 h 更换一次滤膜。将采有PM2.5 的滤膜放入密封袋,-20 ℃避光保存。②PM2.5 颗粒制备:将滤膜裁剪成约1 cm×1 cm,置于盛满去离子水烧杯中,将烧杯放置于超声清洗器中,超声低温震30 min,重复3次,8层无菌纱布过滤烧杯液体。将洗涤液在4 ℃、12 000 r/min高速低温离心机中离心30 min,弃上清,-20 ℃冰箱过夜并避光保存。第2天将样本取出,-80 ℃冰箱保存备用。将样本置于冷冻干燥器,待水分完全挥发后,将瓶底灰色粉末室温称重后4 ℃冰箱保存。③PM2.5悬浊液制备:取PM2.5粉末,PBS配制成浓度为2 μg/μL颗粒物悬液,4 ℃保存。悬浊液浓度参考课题组前期研究[1]。④PM2.5 暴露方法:取各组大鼠,乙醚浅麻醉后仰卧位固定,将舌尽可能拉出口腔,暴露咽喉,将静脉留置针插入气管约1 cm,将PM2.5 混悬液滴注于气管之中,待大鼠完成两次深呼吸(15 s 内)后松舌,左侧卧至完全复苏。每3 天采用PM2.5 混悬液滴注1 次,以第一次气道滴注当天为第1 天。PM2.5 悬浊液滴注体积为8.25 μL/次,即16.5 μg,三组大鼠暴露剂量相同。
1.2.3 橄榄苦苷灌胃方法 观察组1、2 在气道滴注PM2.5 后,分别用50、100 mg/kg 橄榄苦苷溶液灌胃,对照组在气道滴注PM2.5 后予等量生理盐水灌胃。
1.3 各组大鼠左股骨干骺端、左股骨中段骨密度及骨矿物盐含量检测 第150 天时处死各组大鼠,剥离左股骨,剔除股骨周围血管神经,将左股骨置于骨密度仪检查床上,运用双能X 线骨密度仪(型号:HOLOGICDISCOVERYW,美国)检测各组大鼠左股骨干骺端、左股骨中段骨密度及骨矿物盐含量。重复3次,取平均值。
1.4 统计学方法 采用SPASS26.0 统计软件进行数据处理。采用Shapro-Wilk 法对样本数据进行正态性检验,符合正态分布的计量数据以xˉ± s 表示,组间差异比较用方差分析(ANVOA),组内差异用配对样本t检验,不符合正态分布的资料运用秩和检验。P<0.05时为差异具有统计学意义。
2 结果
2.1 三组大鼠左股骨干骺端、左股骨中段骨密度比较 三组大鼠左股骨干骺端、左股骨中段骨密度比较见表1。
表1 三组大鼠左股骨干骺端、左股骨中段骨密度比较(g/cm2,±s)
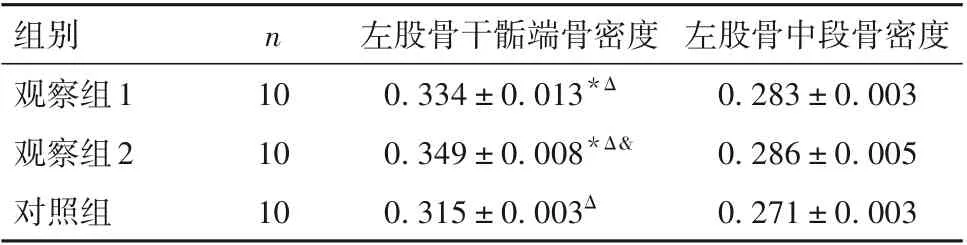
表1 三组大鼠左股骨干骺端、左股骨中段骨密度比较(g/cm2,±s)
注:与对照组比较,*P<0.01;与左股骨中段比较,ΔP<0.01;与观察组1比较,&P<0.05。
左股骨中段骨密度0.283±0.003 0.286±0.005 0.271±0.003组别观察组1观察组2对照组n 10 10 10左股骨干骺端骨密度0.334±0.013*Δ 0.349±0.008*Δ&0.315±0.003Δ
观察组1、2 及对照组左股骨中段骨密度与左股骨干骺端骨密度差值分别为0.051±0.014、0.064±0.005、0.043±0.003,与对照组比较,观察组1、2 大鼠左股骨中段与左股骨干骺端骨密度差值高(P均<0.05)。
2.2 三组大鼠左股骨干骺端、左股骨中段骨矿物盐含量比较 三组大鼠左股骨干骺端、左股骨中段骨矿物盐含量见表2。三组大鼠左股骨中段及左股骨干骺端骨矿物盐含量差异无统计学意义。
表2 三组大鼠左股骨干骺端、左股骨中段骨矿物盐含量(g,±s)
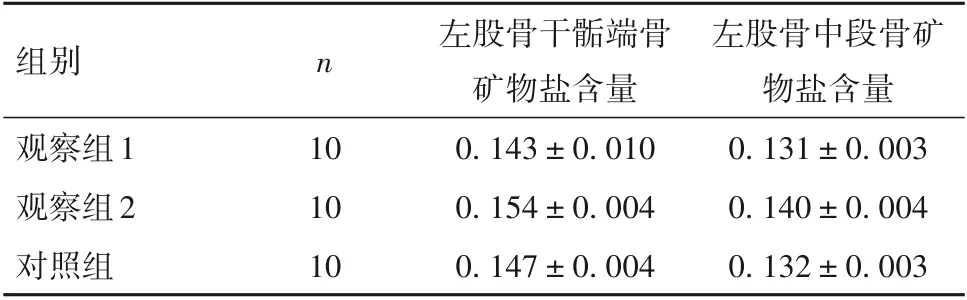
表2 三组大鼠左股骨干骺端、左股骨中段骨矿物盐含量(g,±s)
组别观察组1观察组2对照组n 10 10 10左股骨干骺端骨矿物盐含量0.143±0.010 0.154±0.004 0.147±0.004左股骨中段骨矿物盐含量0.131±0.003 0.140±0.004 0.132±0.003
3 讨论
绝经后骨质疏松是一种发生于绝经后女性的因骨形成和再吸收之间的不平衡而导致的骨质疏松[6]。绝经后女性体内的雌激素水平断崖式下跌是导致绝经后骨质疏松发生的重要原因之一。当雌激素水平下降可致破骨细胞过度形成和过度的骨吸收[7]。女性在绝经后体内的雌激素水平骤降,失去了对骨的保护作用,更易患骨质疏松[8]。雌激素缺乏可导致人体促炎细胞因子水平增加,加剧体内的骨吸收,导致骨平衡失调[9-10]。绝经后骨质疏松与骨折的发生密切相关,约40%的女性在50岁后将会因骨质疏松而导致骨折[11]。女性因骨质疏松而发生骨折的危险性甚至超过了乳腺癌、子宫内膜癌和卵巢癌的总和。目前,在我国的50 岁以上的人群中,女性的骨质疏松的患病率为20.7%,高于男性的14.4%。可见在老年女性中更易因骨质疏松而发生骨折,从侧面也说明了绝经后骨质疏松的危害[12],但目前国内外常用的治疗绝经后骨质疏松的药物都或多或少的存在着一些不良反应[13]。
大气污染已经是一个世界性问题,人们将空气中的主要污染物通过颗粒的大小进行划分,颗粒直径<2.5 μm的被称为PM2.5[1]。PM2.5因其颗粒小、质量轻,极易随着呼吸进入人体的肺泡中,通过血液循环进入各组织器官,引起相应的神经炎症反应、氧化应激反应、细胞凋亡、DNA 损伤和染色体畸变、DNA 甲基化,从而导致神经系统的损伤作为主要污染物[1]。PM2.5 在绝经后骨质疏松的发病过程中起到推动作用[1]。PRADA 等[14]在分析了大量因骨质疏松而导致骨折的患者后得出结论,高污染是骨折和骨质疏松症的重要危险因素,尤其是在低收入人群中,这一现象更为明显。PM2.5 在体内可激活体内诸如IL-6、IL-1β 和TNF-α 等与绝经后骨质疏松发病有关的炎性因子。多环芳烃作为PM2.5 中的主要成分也会增加维生素D分解代谢[15]。化石燃料燃烧后产生的大量PM2.5 在被吸入人体后,除了会诱导机体产生炎性细胞因子,这些炎性细胞因子可能会直接增加RANKL的分泌,进而诱导骨质疏松的发生[16]。(Osteoprotegerin,OPG)- RANK- RANKL 通路是研究骨质疏松的经典通路。YOUNG 等[17]研究发现,OPG 护骨素能够与核因子κβ 受体活化因子(receptor activator of NF-κβ,RANK)都 是TNF 超级家庭的成员,对骨质吸收的调节至关重要。RANKL,通过其受体RANK,激活骨质疏松形成,而OPG则是RANKL 的另一个受体,抑制骨质疏松,并通过结合RANKL 抑制骨质流失,以防止RANK 与RANKL 相结合所产生的骨破坏作用。此外,PM2.5 的暴露与维生素D 缺乏有关。流行病学报告[16]显示,来自污染地区的健康妇女、青少年和儿童血清维生素D 水平较低。PM2.5中的多环芳烃能以受体依赖性方式激活AhR 并加速破骨细胞发育。进而加速体内骨质的吸收[18]。我们前期的实验结果发现,PM2.5 在绝经后骨质疏松的发生与发展中起到了推动的作用,且PM2.5 的暴露使得绝经后骨质疏松的病理过程产生了更为复杂的变化[1]。
橄榄苦苷是一种多酚类裂环烯醚萜苷类化合物,这是一种广泛存在于木犀科植物中的成分,具有多种药理作用,包括:抗氧化作用、抗肿瘤作用、抗炎作用、降血糖作用、降血压作用、降血脂作用、器官(心脏、肝脏、肾脏)保护作用,以及解毒、抗惊厥、抗焦虑、抗阿尔兹海默症等药理作用[5]。橄榄苦苷可以通过降低体内IL-6、IL-1β 和TNF-α 等炎性因子的水平发挥到抗炎的作用[19],橄榄苦苷可以延缓随衰老而发生的骨质疏松症的实验模型中骨量的损失。体外研究[20]表明,橄榄苦苷抑制从人骨髓分离的间充质干细胞(MSCs)分化为脂肪细胞并增强成成骨细胞的分化,表明它可以预防与年龄相关的骨质流失和骨质疏松症。在课题组前期的研究[21-23]中发现,橄榄苦苷可有效抑制破骨细胞的增殖,促进成骨细胞的增殖。一项随机双盲实验[24]研究发现,相较于单纯服用钙剂,在服用钙剂的基础上加上橄榄提取物可以让患者的血清骨钙素上升,腰椎骨密度明显改善。这可能是因为橄榄苦苷的化学结构中含有一个与雌激素相同的芳香环结构,这使得橄榄苦苷可以竞争性的与雌激素受体结合但不会产生雌激素样作用[25]。PM2.5 的暴露使得绝经后骨质疏松的发病机制变得越加复杂,橄榄苦苷对于PM2.5 暴露后的绝经后骨质疏松是否仍然有效目前国内外的文献罕有报道。
国内外指南均将骨密度作为骨质疏松诊断的重要标准之一,测量骨密度一方面可以评估患者的骨折风险,另一方面可以结合患者的临床表现来推测患者的用药效果。检测骨密度的方法多种多样,目前在临床和科研中较常采用的是DXA 骨密度测量法[13]。DXA 与其前代产品相比,DXA 的优势包括减少辐射暴露,更快的扫描采集速度和更高的测量精度。在当前的临床实践中,DXA 仍然是评估骨骼健康和身体成分的综合平台。因此,DXA 是诊断绝经后骨质疏松症的所谓金标准[13]。去势后的SD 雌性大鼠是一种目前已被广泛使用的研究绝经后骨质疏松的大鼠模型,去势后大鼠的骨吸收速度快于骨形成,大约在12 周左右可形成骨质疏松[1]。本研究结果发现,气道滴注PM2.5 混悬液同时橄榄苦苷灌胃处理的去势雌性大鼠左股骨左股骨干骺端、左股骨中段骨密度高于单纯气道滴注PM2.5 混悬液的去势雌性大鼠,且橄榄苦苷浓度越高对骨密度的提升越大。因此,橄榄苦苷可以延缓PM2.5 暴露下绝经后骨质疏松的发展,且这一效果与橄榄苦苷的服用剂量存在正相关。猜测橄榄苦苷可能通过抑制体内与骨质流失有关的炎症反应,降低相关炎症因子浓度等机制来延缓去势后雌性大鼠的骨质流失。
绝经后妇女的骨质流失分2 个阶段发生。初始短期持续3~5 年,小梁骨质流失迅速发生(更年期相关骨质流失),而后,女性的皮质骨和小梁骨开始流失,这一过程将持续10~20 年(年龄相关性骨质流失)。骨折、残疾和慢性疼痛是骨质疏松症最常见的并发症[6]。PM2.5 暴露不仅与骨质疏松的发病有关[16],且不同部位的骨质收到影响的程度不一,与小梁部位(即腰椎)相比,皮质部位(即股骨颈)更容易受到PM2.5 暴露造成的不利影响,这可能是由于骨质流失是一个非均匀的过程[15]。大鼠去卵巢后再行PM2.5 悬浊液的暴露,以期能够尽可能模拟现实场景中PM2.5 暴露后的绝经后女性。本实验数据表明,橄榄苦苷对于不同部位的骨质的保护作用不同,用药后股骨干骺端的骨质流失情况要好于股骨中段,且这一效应与橄榄苦苷的服用剂量有关,本实验中高剂量的橄榄苦苷对骨质的保护作用优于低剂量。根据不同部位的骨矿物盐数值来看,橄榄苦苷对于保护骨矿物盐的流失并不明显且并不能改变不同部位的骨矿物盐的分布情况。因此,橄榄苦苷能够延缓PM2.5 暴露后的去卵巢大鼠的骨质的流失,有效提升其骨密度,但是其对骨质保护的具体的机制尚待进一步的研究。
综上所述,道滴注PM2.5 混悬液并灌胃给予橄榄苦苷的去势雌性大鼠左股骨左股骨干骺端、左股骨中段骨密度高于单纯气道滴注PM2.5 混悬液的去势雌性大鼠。且气道滴注PM2.5 混悬液并灌胃给予橄榄苦苷的去势雌性大鼠左股骨干骺端的骨质流失情况好于左股骨中段,且100 mg/kg 橄榄苦苷效果更好。但本研究仅限于动物实验且纳入样本量有限,未能更深入地探讨橄榄苦苷的具体作用机制,今后有待于进一步实验和研究。

