医用口罩标准比对及医用口罩生产企业飞行检查常见问题浅析
姜帆 王晓 辽宁省药品审评查验中心 (辽宁 沈阳 110036)
内容提要: 近年来医用口罩产品质量受到持续关注。文章对国内医用口罩相关标准及技术指标进行比对,对医用口罩结构、原材料、生产工艺及省内行业现状进行介绍,结合2022年辽宁省医用口罩生产企业飞行检查情况,对生产管理、采购及文件管理部分出现问题进行分析,以供同类企业借鉴和参考。旨在帮助口罩生产企业提高质量意识,学习质量管理技能,持续产出符合预期用途和技术要求的口罩产品。
自新型冠状病毒肺炎疫情以来,医用口罩作为基础性呼吸防护物资,在阻断病毒经呼吸道飞沫和接触传播方面发挥重要作用。在疫情防控常态化背景下,医用口罩已成为日常工作生活出行的“刚需品”。本文对医用口罩标准进行对比,结合辽宁省医用口罩生产企业年度飞行检查情况,对省内医用口罩生产企业质量管理体系运行情况存在问题展开分析,以期为口罩生产企业提升质量管理体系管理能力,加强风险管控水平,提供可行性参考。
1.医用口罩标准介绍
口罩一般由口罩主体及其他材料构成,口罩主体由内层无纺布、外层无纺布及中间层熔喷布构成,其他材料包括金属(用于鼻夹)、弹性材料(用于口罩带)、染色剂等。医用口罩大部分为自吸式过滤口罩,其工作原理是使含有害物的空气通过口罩的滤料过滤后再被人吸入或者呼出[1]。按照《医疗器械分类目录》规定,医用口罩属于第二类医疗器械,类别号为6864。
根据预期用途和使用环境的不同,医用口罩分为一次性使用医用口罩、医用外科口罩、医用防护口罩三种,分别有对应的国家标准和行业标准(见表1)。一次性使用医用口罩适用于普通医疗环境中佩戴,以阻隔口腔和鼻腔呼出或喷出的污染物,应符合YY/T 0969-2013《一次性使用医用口罩》[2]标准。医用外科口罩适用于临床医务人员在有创操作等过程中佩戴,通过覆盖住使用者的口、鼻及下颌,为防止病原体微生物、体液、颗粒物等的直接透过提供物理屏障,应符合YY 0469-2011《医用外科口罩》[3]标准。医用防护口罩适用于医疗工作环境下,过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物等,应符合GB 19083-2010《医用防护口罩技术要求》[4]标准(见表2)。

表1. 医用口罩执行标准及适用范围
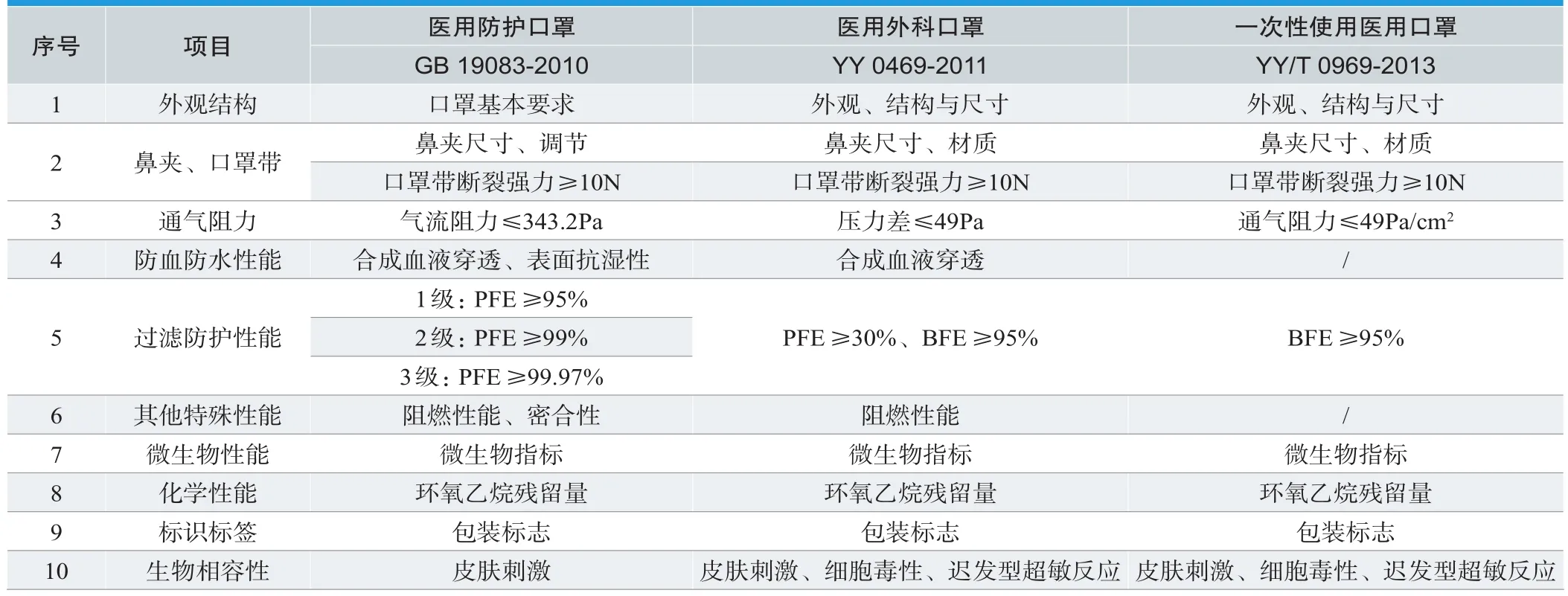
表2. 各类别医用口罩指标要求对比
2.医用口罩技术指标比较
常生等[5]通过研究YY/T 0969-2013《一次性使用医用口罩》、YY 0469-2011《医用外科口罩》、GB 19083-2010《医用防护口罩技术要求》3个医用口罩标准,从外观结构、耐用性、舒适性、毒理性、卫生性、防血液防水、过滤防护、阻燃性能、包装标识等9个方面展开分析,对比考核指标及试验方法的不同,提出适用于不同类别医用口罩适用场景及生产要求(详见表2)。韩玲等[6]在比对国内标准同时,对美国、日本、欧盟等国家主流医用口罩标准进行研究,总结各类医用防护口罩的防护性能、最佳使用范围,以及国内外医用口罩在分类方式、测试方法方面的异同,为我国医用口罩标准体系后续修订完善提出参考性建议。
3.医用口罩生产企业飞行检查中发现的问题
受辽宁省药品监督管理局委托,2022年辽宁省药品审评查验中心(以下简称中心)组织对20家省内医用口罩生产企业进行飞行检查。本次飞行检查是以抽验不合格或产品生产情况为依据确定检查品种,重点围绕采购、生产、检验及售后部分开展检查。主要依据《医疗器械生产质量管理规范》[7](以下简称《规范》)、《医疗器械生产质量管理规范附录无菌医疗器械》[8](以下简称《无菌附录》)及口罩相关标准开展。《规范》于2014年12月29日发布,2015年3月1日开始实施,共十三章八十四条,重点包括设计开发、采购、生产管理、质量控制等章节。《无菌附录》则是针对无菌医疗器械产品特点提出的特殊要求。
检查过程中发现大部分口罩生产企业都处于停产或停工状态,这与口罩产能提升及国内疫情防控形势逐步好转密切相关。疫情暴发初期口罩需求激增,引发许多投资者跨界转入口罩生产中,尤其对洁净厂房设施、生产设备及原料投入巨大,而现阶段口罩市场趋于饱和、供大于求,口罩价格大幅度下降,导致经营陷入困境,也有少数企业及时调整思路,投入新产品研发或适时转型,实现逆势增长。
结合本次飞行检查情况,按照《规范》章节对医用口罩生产企业飞行检查中出现的不符合项进行汇总(见图1),排在前三位分别是生产管理、采购和文件管理,其中生产管理占比25.8%,采购占比18.2%,文件管理占比16.7%,下面对上述章节出现问题进行具体分析。
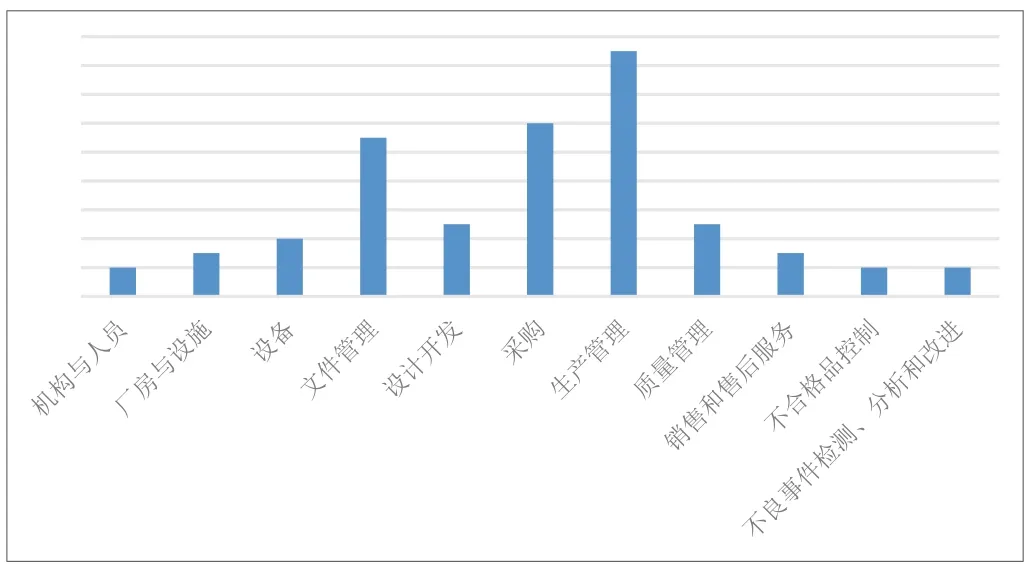
图1. 2022年医用口罩生产企业飞行检查不符合项目分布情况
3.1 生产管理
医用口罩生产一般分为全自动生产线和半自动生产线,主要生产工艺包括口罩体成型(含裁剪、打片、口罩带焊接等工序)、内包装、外包装、环氧乙烷灭菌、解析等,环氧乙烷灭菌、解析仅限无菌产品。通常将口罩成型设定为关键工序,将环氧乙烷灭菌设定为特殊过程。
检查过程中应重点关注企业是否编制了生产作业指导书,并明确关键工序及特殊过程;生产批记录是否完整可追溯;中间品的存放是否满足要求;无菌产品是否对灭菌过程进行验证,并保留验证记录及灭菌记录。生产管理章节发现的主要问题如下:
3.1.1 未按确认过的灭菌工艺进行灭菌
①未制定一次性使用医用口罩(无菌)的灭菌过程控制文件;②灭菌记录中灭菌时间与工艺文件规定不符;③灭菌工艺文件规定灭菌加药4kg,灭菌记录未记录加药量,实际加药量依靠压力差控制。
3.1.2 灭菌/解析过程记录内容不完整
①未保留灭菌过程原始数据记录;②生产记录未包含产品解析过程;③医用外科口罩生产记录中无灭菌委托过程相关灭菌参数记录;④未提供与灭菌外包方每批产品交接记录。
3.1.3 批号管理不规范
①医用外科口罩灭菌批号均未遵循《批号管理制度》中灭菌批及批号规定;②同一批次医用外科口罩使用外购和企业自产熔喷布,不符合企业《批号管理制度规定》中生产批的定义;③对灭菌批号管理不规范,同一生产批号产品分三次灭菌,灭菌批号相同。
3.1.4 未对最差灭菌条件进行验证
灭菌验证温度为(51±10)°C,设备说明书建议灭菌温度为45~55°C,未进行最差温度灭菌条件验证。
3.1.5 未按标准要求对每批产品灭菌效果进行考察
未依据GB18279要求在环氧乙烷灭菌过程中放置灭菌过程装置,及将该装置灭菌效果作为灭菌过程放行依据。
3.2 采购
口罩主要原材料有无纺布、熔喷布、口罩带、初包装材料等,《规范》要求应根据采购物品对产品的影响,对原材料进行分级分类管理。应对主要原材料供应商进行准入评价,并签订质量协议。口罩生产企业通常不具备对熔喷布过滤效率等指标的检验能力,需要收集每批次熔喷布供方合格报告,并核对是否满足原材料采购要求。注意的是,《无菌附录》规定:“与无菌医疗器械的使用表面直接接触、不需清洁处理即使用的初包装材料,其生产环境洁净度级别的设置应当遵循与产品生产环境的洁净度级别相同的原则,使初包装材料的质量满足所包装无菌医疗器械的要求”,因此应对初包装材料供应商生产环境的洁净级别开展审核,质量协议中应明确生产环境及包装要求。
检查过程中应重点关注企业是否按照《医疗器械供应商审核指南》的要求对供应商进行管理;采购原材料实施控制方式和程度是否满足产品要求;采购记录是否完整可追溯,所购入原材料数量是否与产出成品数量相符。采购章节发现的主要问题如下:
3.2.1 供应商管理不规范
①未将灭菌受托企业纳入供应商管理;②未按《采购控制程序》要求对供应商保留供方评定表、能力调查表、业绩评估表;③未见主要供应商年度评价记录及报告;④未与成品存储受托方签订委托协议。
3.2.2 采购要求不完整
①《原材料检验规程》中未规定初包装(纸塑袋)质量要求;②熔喷布质量标准未规定非油性颗粒过滤率等主要指标标准值。
3.2.3 采购记录不完整
①未按规定核对熔喷布供应商检验报告;②未提供熔喷布入厂检验原始记录。
3.3 文件管理
医用口罩生产企业大多依据ISO13485:2016《医疗器械质量管理体系用于法规的要求》[9]、GB/T 19000-2016/ISO9000:2015《质量管理体系 基础和术语》[10]、GB/T 19001-2016/ISO9000:2015《质量管理体系 要求》[11]等标准建立质量管理体系。文件编制基本要求是保证文件内容适用于生产实际。
检查过程中应重点关注企业是否制定了满足企业质量管理要求的文件,文件体系是否满足规范要求。文件管理章节发现的主要问题如下:
3.3.1 部分文件内容缺失或不符合实际
①未制定一次性使用医用口罩过程检验(平均片重)检验规范和标准;②《医用外科口罩生产工艺规程》规定内包装为5只/袋,中包装为50只/盒,与实际情况不符;③企业对医用防护口罩包装形式进行变更,但未依据设计变更结果对《医用防护口罩质量标准》进行修订。
3.3.2 文件管理不规范
①制度引出的表单未按照《文件控制程序》要求受控管理;②未按《文件控制程序》对起草、变更的文件进行评审和批准。
3.3.3 记录保存不完整
①未按《产品的监视和测量控制程序》规定保留原材料放行通知单及检验报告;②未保留产品无菌检查原始记录。
4.小结
医用口罩生产企业应按设计开发确认的生产工艺组织生产,如发生原材料、生产设备、工艺参数变更时,应及时进行相关验证或确认,并开展设计变更评审及风险评估,必要时送第三方检验机构进行型式检验。
作为口罩质量安全的第一责任人,医用口罩生产企业应牢固树立主体责任意识,按辽宁省药品监督管理局发布的《医疗器械生产监督检查缺陷整改工作指南(试行)》[12],严格遵循调查分析、风险评估、风险控制、整改审核、整改效果评价等流程,结合缺陷类型及影响程度,有针对性完成问题整改,确保取得效果。此外应积极开展全体系内审和自查,做到举一反三,避免后续发生类似问题。企业负责人及质量负责人应加强医疗器械行业相关法律法规学习,提升质量管理意识,以质量管理体系为准则和工具,保证企业健康平稳发展。

