HR-HPV基因联合TV-CDFI在宫颈癌筛查及诊断中的应用
程明艳, 姜 浩, 孙亚男, 王艳春, 杨 涛,梅艳芳, 杜建文, 王晶华*
1. 承德市中心医院检验科, 河北 承德 067000; 2. 承德市中心医院妇科, 河北 承德 067000;3. 承德市中心医院心内二科, 河北 承德 067000; 4. 承德市中心医院生殖医学科, 河北 承德 067000;5. 承德市中心医院超声科, 河北 承德 067000
高危人乳头瘤病毒(HR-HPV)目前发现同宫颈癌发病具有密切关系,目前宫颈癌死亡率在发展中国家位居女性恶性肿瘤首位,因此越早对宫颈癌进行诊断并选择可靠的治疗方案越能够改善患者预后[1]。目前临床鉴别诊断宫颈癌方法较多,超声检查最为常用,可以实时观察并分析肿瘤内部血流状况,在诊断宫颈癌病变具有重要的价值。研究发现,HPV感染到发展为宫颈癌经历了子宫上皮内瘤变的过程。HPV E6/E7蛋白则是致病过程中重要的蛋白,目前已被确认为致癌蛋白,而且基因监测技术可以准确、快速地检测大量基因的表达情况。第二代杂交捕获(HC2)技术则可以对HPV DNA进行检测,了解体内病毒载量情况,目前在宫颈癌筛查中很少报道高危人乳头瘤病毒基因检查联合经阴道彩色多普勒超声(TV-CDFI)应用对于宫颈癌的筛查效果[2]。本研究采用HR-HPV基因检查联合经阴道彩色多普勒超声对宫颈癌、宫颈上皮瘤变(CIN)、宫颈炎分组进行诊断分析,目的是为临床宫颈癌早期筛查、诊断及监测预后提供一定的依据。
1 资料与方法
1.1 一般资料
选取2018年4月至2021年6月承德市中心医院收治的84例宫颈癌患者(宫颈癌组)、100例CIN患者(CIN组)、100例宫颈炎患者(炎性组)为研究对象。本研究经我院医学伦理委员会批准后实施。三组患者年龄、体质量指数(BMI)、人流史、绝经情况比较,差异无统计学意义(P>0.05)。纳入标准:年龄18~65岁;宫颈癌、宫颈上皮瘤变、宫颈炎诊断标准均参考人民卫生出版社《妇产科学》(第8版)中的标准;在我院接受HPVE6/E7mRNA法、HC2法检查,宫颈癌组患者的TV-CDFI检查资料完整;所有患者均接受阴道镜活组织检查;患者知情同意。排除标准:具有放化疗病史患者;梅毒、HIV感染患者;近期接受免疫调节剂资料患者;子宫颈手术史患者;经期或妊娠期患者。
1.2 方法
1.2.1TV-CDFI检查及分级
仪器采用GE Voluson E8彩色多普勒超声诊断仪,阴道检查探头:RIC5-9-D宽频带腔内微凸三维容积探头,频率:4~9 MHz。患者取截石位,阴道探头缓慢置于阴道后穹窿部,进行横向、纵向等多方位、多角度扫描,二维超声观察子宫体形态、大小、内部回声以及子宫内膜厚度和占位病变情况,同时对子宫颈旁情况肿块内部及周边血流动力学特征和血管分布情况进行分析。将血流信号进行Adler分级。0级:患者TV-CDFI检查未发现明显的血流信号;1级:超声检查时可探及1~2处较为细小的血管血流信号,超声测定的管径<1.0 mm;2级:超声检查探及宫颈部位2~3条小血管,血流信号较为明显;3级:超声检查探及宫颈部位血管条数>4条,血管多呈网状分布 。
1.2.2E6/E7mRNA法、HC2法检测
E6/E7mRNA检测法:将获取标本以3000 r/min离心5 min,在离心后加入200 μL裂解液和400 μL试验用水,混合后加入5 μL蛋白酶K,在65 ℃振荡3次后反应1 h。标本置入96孔捕获包被板,反应条件:55 ℃温箱保温3.5 h后取出,使用洗脱液冲洗3次,加入缓冲液(1 μL封闭反应液+17 μL裂解液+31 μL试验用水+1 μL检测探针)后在55 ℃杂交40 min,反复进行3次后将底物取出,加入31.5 μL底物催化剂,混匀后将液体去除,使用洗脱液进行冲洗,加入底物在46 ℃放置20 min,取出后立即上Quanti VirusTM冷光仪检测。HC2检测法:取样器插入宫颈口,沿同一方向旋转5周,停留10 s,留取标本,利用高危型杂交捕获检测试剂盒进行检测,步骤分为DNA裂解、杂交、捕获、反应、冲洗、结果信号、结果判读。检验结果采用相对光单位(RLU)方法表示,若RLU值>1.0则诊断为HR-HPV阳性。
1.3 统计学处理
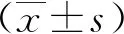
2 结果
2.1 三组患者的采取两种方法检测HR-HPV阳性率比较
对三组患者分别采用HPVE6/E7mRNA检测法、HC2法检测HR-HPV感染情况,结果显示宫颈癌组的HR-HPV阳性率显著高于CIN组、炎性组两组患者,CIN组的HR-HPV阳性率显著高于炎性组患者(P<0.05)。详见表1。
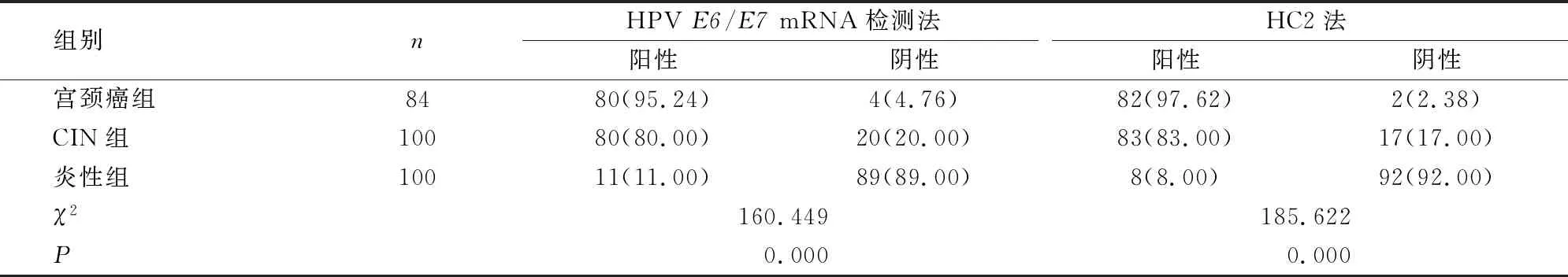
表1 三组患者的采取两种方法检测HR-HPV阳性率比较[n(%)]
2.2 两种方法鉴别诊断宫颈癌、CIN、宫颈炎的价值比较
HPVE6/E7mRNA检测法鉴别诊断宫颈癌与CIN患者的灵敏度为95.24%、特异度为20.00%;HC2法检测鉴别诊断宫颈癌与CIN患者的灵敏度为97.62%、特异度为17.00%;详见表2。HPVE6/E7mRNA检测法鉴别诊断宫颈癌与宫颈炎患者的灵敏度为95.24%、特异度为89.00%;HC2法鉴别诊断宫颈癌与宫颈炎患者的灵敏度为97.62%、特异度为92.00%;详见表3。

表2 两种检测方法鉴别诊断宫颈癌与CIN的价值[n(%)]

表3 两种检测方法鉴别诊断宫颈癌与宫颈炎的价值[n(%)]
2.3 宫颈癌患者Adler分级与病理学特征的关系
84例宫颈癌患者,TV-CDFI检查的Adler分级2~3级患者的病灶直径≥3.0 cm、血管浸润阳性率显著高于Adler分级0~1级患者(P<0.05)。详见表4。

表4 Ader分级与病理学特征的关系
3 讨论
子宫颈癌属于女性发病率较高的恶性肿瘤之一,高危HPV持续感染是发病的重要因素,早期诊断并治疗对预后的改善意义重大[3]。HPV从感染发展到宫颈癌变会经历宫颈上皮瘤变(CIN),其中CIN I型患者在1~2年内可以伴随HPV感染的消退而消退,临床以液基薄层细胞检测(TCT)为主,但是在诊断宫颈管内或者肌层病变技术上存在相应的缺陷,而且TCT检查具有一定创伤性[4,5]。
近年来,细胞学联合HPV DNA测定广泛应用在宫颈癌筛查过程中,但早期诊断价值不高。本研究分析了HPVE6/E7mRNA检测法、HC2法对宫颈病变患者诊断价值,发现宫颈癌组的HR-HPV阳性率最高,炎性患者阳性率最低。研究发现HPV感染的早期病毒呈游离状态,恶性肿瘤基因表达同上皮细胞分化处于不同阶段相关,癌基因E6和E7只在表面和中间层细胞处于分化晚期过程中进行表达,当病毒DNA整合入宿主DNA后会造成致癌基因E6和E7调节作用丢失,表达过度,因此E6和E7的表达情况可以识别女性HPV持续性感染[6,7]。HC2法则可以监测13种高危型HPV病毒,但是部分患者由于未发展至宫颈细胞学改变,可能导致临床假阳性率较高[8]。
本研究中发现HPVE6/E7mRNA检测法和HC2法在鉴别宫颈癌与CIN上灵敏度均较高,但是特异性较低,而在鉴别宫颈癌与宫颈炎患者时灵敏度和特异度均较高。目前临床中对于HR-HPV阳性患者医师会建议开展阴道镜下宫颈活检,但是由于HPV DNA监测的特异性较差可能会造成检查过度,对患者心理和生理上均会形成一定创伤[9,10]。本研究发现采用两种检测方法对于鉴别宫颈癌以及癌前病变和炎症反应患者的意义较大,可以明确患者是否属于炎症疾病,准确地发现宫颈高度病变患者,为临床指导治疗提供相应的依据。
超声检查具有可重复性、无创性,在宫颈癌筛查中发挥着重要作用,研究发现CIN阶段到宫颈浸润癌这一过程中会形成新生血管,病情不断发展后病灶微血管密度增加,体内新生血管形成因子增多,最终导致肿瘤血管血流丰富,同病情预后紧密关联[11]。本研究患者Adler分级越高病变直径超过3.0 cm和血管浸润阳性的概率越高,有研究发现,肿瘤体积越大所需血液和营养物质也会增加,恶性肿瘤血管形成显著,供血动脉出现扩张,造成肿瘤周围血流量显著增多,因此血流收缩峰值速度增加,阻力降低[12,13],同本研究结果基本一致。研究发现宫颈癌患者的超声影像检查发现血流显像增多,一般呈现低阻力型血流,部分患者则出现增多的血流信号,以点状血流信号改变为主,因此提示临床对于超声提示宫颈未见明显异常回声而仅仅有少量血流信号时,可以建议患者进行进一步的宫颈癌筛查,以免漏诊某些早期宫颈癌[14,15]。
本研究分析了不同无创检测方法在宫颈癌、CIN和宫颈炎症病变之间的差异性,初步印证了未来宫颈癌筛查可能在初期以HPV DNA筛查、超声检查作为初筛方法,细胞学诊断作为进一步检测分流方法的模式,同时也证实了HPVE6/E7mRNA检测法、HC2法和超声检查在宫颈癌、CIN和宫颈炎症中的表现差异,为临床早期筛查合理选择方法提供了一定的参考。
综上,HPVE6/E7mRNA法及HC2法检测HR-HPV感染情况,以及HPV阳性率鉴别诊断宫颈炎与宫颈癌方面均具有较高的价值,TV-CDFI检测宫颈癌Adler分级与疾病进展关系密切,因此,临床筛查宫颈癌患者可以考虑HR-HPV检查联合TV-CDFI方式,对于宫颈癌的诊断、病情评估具有较高价值。

