HTPB/Ni/μAl复合粒子的制备及其热氧化性能①
包淑霞,李廷润,郭春雨,赵洋洋,张慧娟,吴瑞凤
(内蒙古工业大学 化工学院,呼和浩特 010050)
0 引言
Al粉具有很高的燃烧焓,已广泛应用于新型高能推进剂及高能炸药体系中[1]。Al粉能够显著提高炸药体系的爆炸放热和能量的释放[2],还可以大幅降低爆炸材料的活化能,从而提高释能效率[3]。但Al粉表面活性位点多导致易氧化和团聚,阻碍其在体系中的分散和均化[4-5],导致其燃速和能量密度降低,点火温度升高[6]。通过包覆来提高Al粉的性能,使其在导电填料、固体推进剂和火炸药等领域更好地应用[7-9]。
为阻止Al粉表面氧化,提高活性铝的含量,已有多种金属(如Cu、Fe、Ag、Ni等)被用于Al粉表面改性[10]。Ni对固体推进剂组分具有良好的催化效果,因此Ni的引入不仅能够提高Al粉的抗氧化性能,还可以改善推进剂的燃烧性能[11]。研究表明,在μAl粉表面包覆一层纳米Ni,能够显著提高μAl粉的点火性能和燃烧行为[12]。用镍包覆Al粉,既可以保留Al粉的优点,还可以提高其导电性与抗腐蚀性,有利于Al粉的贮存和降低了运输成本[13]。相比于其他常见Al系含能材料(Al-W、Al-Ta等),Ni/Al复合物的理论能量密度更高[14],该复合材料在激光加热、热能等外力的作用下,将发生剧烈的界面反应,释放巨大能量,继而引爆携带的其他含能材料,使得能量释放速率在很大程度上得到提高[15-17]。丁羟胶(HTPB)作为高聚物粘合剂常用于固体复合推进剂中[19],得到在高温和低温下都具有一定强度的固体药柱[20]。近年来,HTPB也被用于铝粉的包覆剂[21]。郝洁等[22]采用复合型喷雾造粒工艺对纳米铝粉(nAl)进行了HTPB-TDI包覆研究,结果表明,包覆剂能够高覆盖nAl表面,很好地阻隔外界氧与nAl的反应,实现高活性nAl的长期存储。鞠子莹等[23]利用溶剂蒸发法将HTPB包覆在nAl表面得到HTPB/nAl,其活性铝含量高于未包覆的nAl,且在0.7 MPa下,固体药柱平均密度为2.004 g/cm3,证明HTPB的引入有利于复合材料的压装成型。李廷润等[24]采用溶剂蒸发法在Cu/μAl表面包覆了HTPB,并对其热性能进行了研究,结果表明,HTPB的加入有效地阻止了μAl的氧化。另外,HTPB还可作为高能燃料,与氧化剂反应生成CO2和H2O而产生推力[20]。
在制备方法研究方面,贾坤乐等[18]在Al粉中加入除膜剂,并在水溶液中加入适量的表面活性剂,用置换法制备了Ni/Al核壳结构复合粉末,但该制备过程中引入了非推进剂组分。贺振华等[11]采用化学镀法在水溶液中加入络合剂乙二胺四乙酸二钠,用联氨还原醋酸镍得到了Ni/Al,这种方法需要保持镀液的稳定性和pH值,对制备过程要求比较严格。程志鹏等[10]以NH4F为络合剂,在水溶液中加入表面活性剂,通过Al置换NiCl2·6H2O的方法得到了Ni/Al复合材料,但由于在实验过程中生成了[AlF6]3-络合物,需要在酸性环境下,才能进行置换反应。
以上研究表明,Ni包覆可以改善Al粉的性能。而HTPB包覆既能够阻止粒子的表面氧化和团聚,又能均匀地分布在推进剂组分之间,提供组分间的粘合性,有利于金属粉体的压装成型。本研究在不引入非推进剂组分的前提下,采用一锅法将液相还原法得到的Ni/μAl复合粒子用HTPB进行二次包覆,得到复合材料HTPB/Ni/μAl,对其结构和形貌进行表征,并对其热氧化性能进行研究。
1 实验
1.1 材料及试剂
μAl粉,上海攀田粉体材料,平均粒径1 μm,活性Al含量>99.0%;醋酸镍(Ni(CH3COOH)2·5H2O),上海麦克林生化科技有限公司;端羟基聚丁二烯(HTPB),淄博齐龙化工有限公司;氢氧化钠(NaOH),上海实验试剂有限公司;水合肼(N2H4·H2O),山东德享国际贸易有限公司,80 %;无水乙醇(CH3CH2OH),天津鑫铂特化工有限公司;无水乙醚(CH3OCH3),上海阿拉丁化学试剂公司。
1.2 Ni/μAl和HTPB/Ni/μAl样品制备
取1.500 6 g(0.008 5 mol)Ni(CH3COOH)2·5H2O放入250 ml的三口瓶中,加入20 ml乙二醇,50 ℃下溶解,用NaOH的乙醇溶液调节pH为9。然后加入1g μAl粉,在不断搅拌下向体系中加入13 ml水合肼,保持温度为50 ℃。反应3 h后,对产物进行醇洗、离心。洗涤3次后,80 ℃干燥10 h,得到Ni/μAl(83.4%)。
取1.500 6 g(0.008 5 mol)Ni(CH3COOH)2·5H2O放入250 ml的三口瓶中,加入20 ml乙二醇,50 ℃下溶解,用NaOH的乙醇溶液调节pH为9。然后加入1 g μAl粉,在不断搅拌下向体系中加入13 ml水合肼,保持50 ℃反应3 h。将体系温度降至25 ℃,加入用 10 ml无水乙醚溶解的HTPB 0.15 g,继续反应2 h。对产物进行醇洗、离心,洗涤3次后,80 ℃干燥10 h,得到HTPB/Ni/μAl(73.7%)。
1.3 样品表征
红外光谱测定,日本岛津公司IRTracer-100傅里叶红外光谱仪;XRD测试,日本理学(Rigaku)公司SmartLab 9KW的射线衍射仪;XPS测试,美国赛默飞世尔科技公司ESCALAB 250 Xi型X射线光电子能谱仪;SEM-EDS测试,荷兰Phenom公司Phenom LE型场发射扫描电子显微镜;TEM测试,美国FEI公司F20 S-TWIN型透射电子显微镜;DSC测试,北京恒久科学仪器厂HSC-1型热流式差示扫描量热仪;TG测试,美国耐驰NETZSCH STA 449 F3/F5热重分析仪。
2 结果和讨论
2.1 红外光谱(FT-IR)表征
为确定HTPB是否包覆在Ni/μAl表面,对比研究了HTPB、HTPB/Ni/μAl样品的FT-IR光谱,如图1所示。

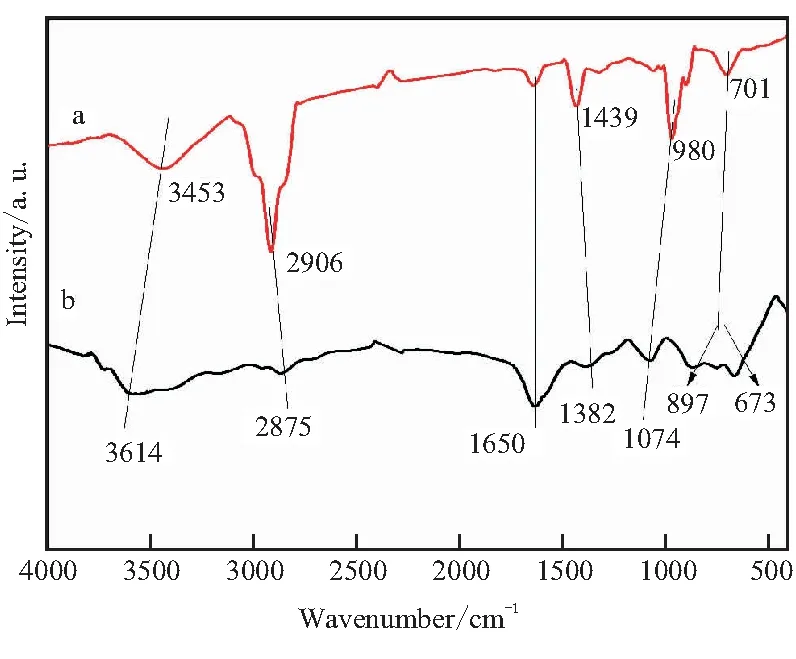
图1 HTPB、HTPB/Ni/μAl的FT-IR谱图
2.2 X-射线粉末衍射(XRD)表征
采用XRD图谱对Ni/μAl和HTPB/Ni/μAl的晶型结构进行物相分析,如图2所示。图2中,2θ分别为38.47°、44.74°、65.13°、78.28°和82.43°处归属于Al的衍射峰,这些衍射峰分别对应于面心立方(fcc)结构金属Al的(111)、(200)、(220)、(311)和(222)晶面的衍射,与标准相卡片相一致。这些尖锐的衍射峰表明复合后的Al粉具有良好的结晶度;2θ分别为44.57°、51.97°、76.41°分别为单质Ni的3个特征峰,对应于面心立方结构Ni的(111)、(200)和(221)晶面衍射峰,说明Ni2+被还原为Ni单质。
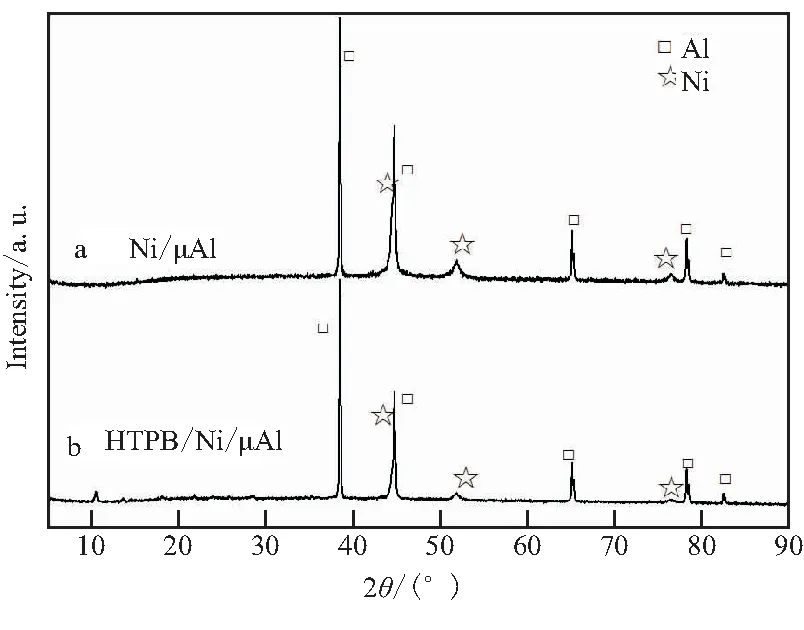
图2 Ni/μAl和HTPB/Ni/μAl的XRD谱图
2.3 X-射线光电子能谱分析(XPS)
为分析样品的表面氧化情况,采用XPS对Ni/μAl和HTPB/Ni/μAl复合粒子表面元素的化学价态进行表征,如图3所示。
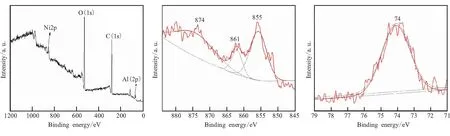
(a)Whole spectrum of Ni/μAl (b)Ni(2p) (c)Al(2p)
图3(a)、(d)分别为Ni/μAl和HTPB/Ni/μAl复合粒子的XPS全谱。可见,复合物表面均含有O、C、Al、Ni;其中O(1s)谱峰明显强于Ni(2p)和Al(2p),说明样品表面主要是氧化物;C(1s)的结合能峰也较强,主要是来自HTPB和XPS测试过程中校准用的C元素[26]。图3(b)、(e)分别为Ni/μAl和HTPB/Ni/μAl复合粒子中Ni(2p)的峰。有研究表明,Ni(2p)峰有2p3/2和2p1/2两个峰,且每个主峰附近还有对应的卫星峰[21]。图3(b)、(e)中位于855 eV的2p3/2峰为Ni单质,它们的卫星峰(861、874)表明包覆层中存在Ni2+,这说明Ni/μAl和HTPB/Ni/μAl中的Ni主要以单质和NiO的形式存在,表面的Ni在空气中已被氧化。此外,HTPB/Ni/μAl(图3(e))中855 eV对应的2p3/2峰较Ni/μAl(图3(b))更明显更尖锐,说明HTPB的引入保护了还原出的单质镍不易被氧化。图3(c)、(f)分别为Ni/μAl和HTPB/Ni/μAl复合粒子中Al(2p)的峰,其中位于74 eV的峰为Al2O3中的Al3+,说明样品表面的Al主要以Al3+形式存在。
2.4 形貌表征
HTPB/Ni/μAl的SEM和TEM图如图4所示。
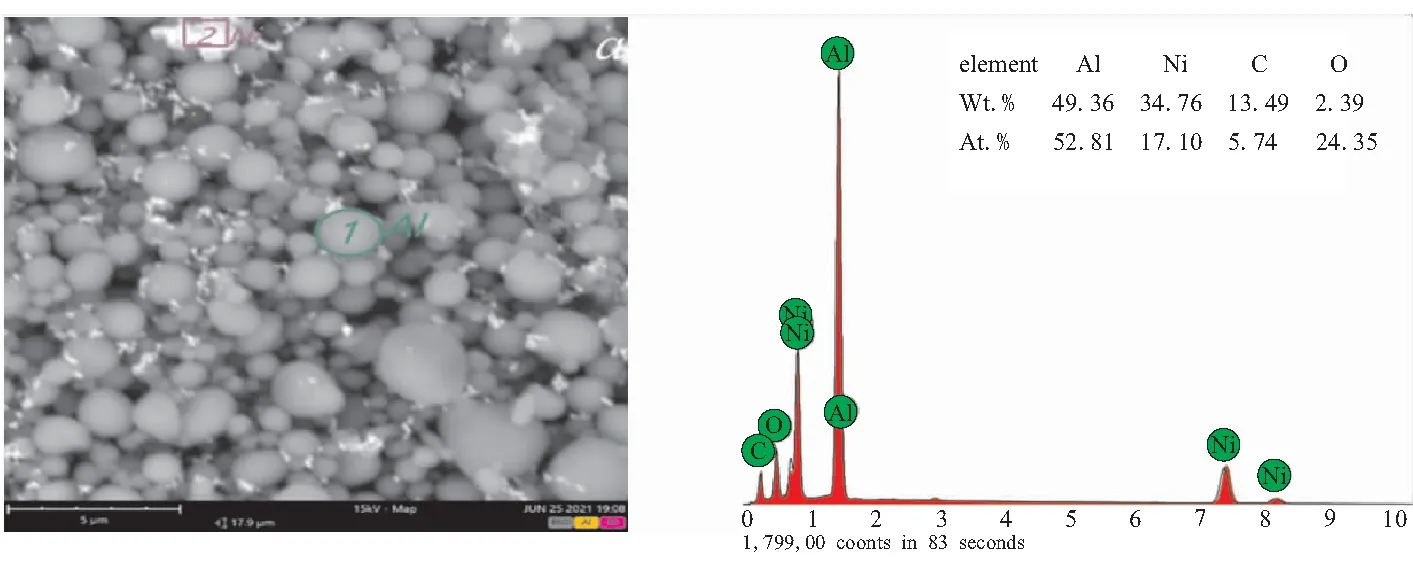
(a)SEM of HTPB/Ni/μAl (b)EDS
图4(a)为HTPB/Ni/μAl的扫描电镜图。可以看出,Al球周围存在分布不均匀的白色物质。通过选择不同区域进行EDS分析,发现复合粉末中主要含有Al、O、C和Ni四种元素,与XPS结果一致。其中1区域Al元素的质量百分含量为93%,2区域Ni质量百分含量为67%,可判断白色物质为还原出来的Ni粉,而且还原出来的Ni不规则地分布在μAl球周围。另外,从样品的热场能谱图像及元素分布图(图4(b)~(e))可以看出,HTPB包覆量较少,零星分布在Ni/μAl表面。图4(f)、(g)为HTPB/Ni/μAl的TEM图,可以看出,复合Al粉仍然保持核壳结构,壳层为无定型的Al2O3。另外,μAl的球形颗粒中心有条纹状的晶栅(图4(g)),表明μAl粒子内部的晶型结构未破坏,仍然保持较高的结晶度,与XRD所测结果一致。
2.5 热性能分析
在空气气氛中,以10 ℃/min的升温速率对样品Ni/μAl和HTPB/Ni/μAl在50~1100 ℃范围内的热行为进行探究,结果如图5所示。
从DSC曲线(图5(a))可见,μAl在50~1100 ℃范围内有2个放热峰,即在531~645 ℃范围内开始第一阶段氧化放热过程,峰顶温度为588 ℃,放热焓为1985 J/g。第一氧化过程结束后随即发生Al的融化过程(峰温660 ℃)。在730~1100 ℃范围内发生μAl粉的第二氧化放热过程,峰顶温度为965 ℃,放热焓为10 948 J/g。从μAl的TG-DTG曲线(图5b)可看出,在50~1100 ℃范围内存在2个增重过程,与DSC μAl的第一和第二氧化放热峰相对应,分别增重6%和37%。
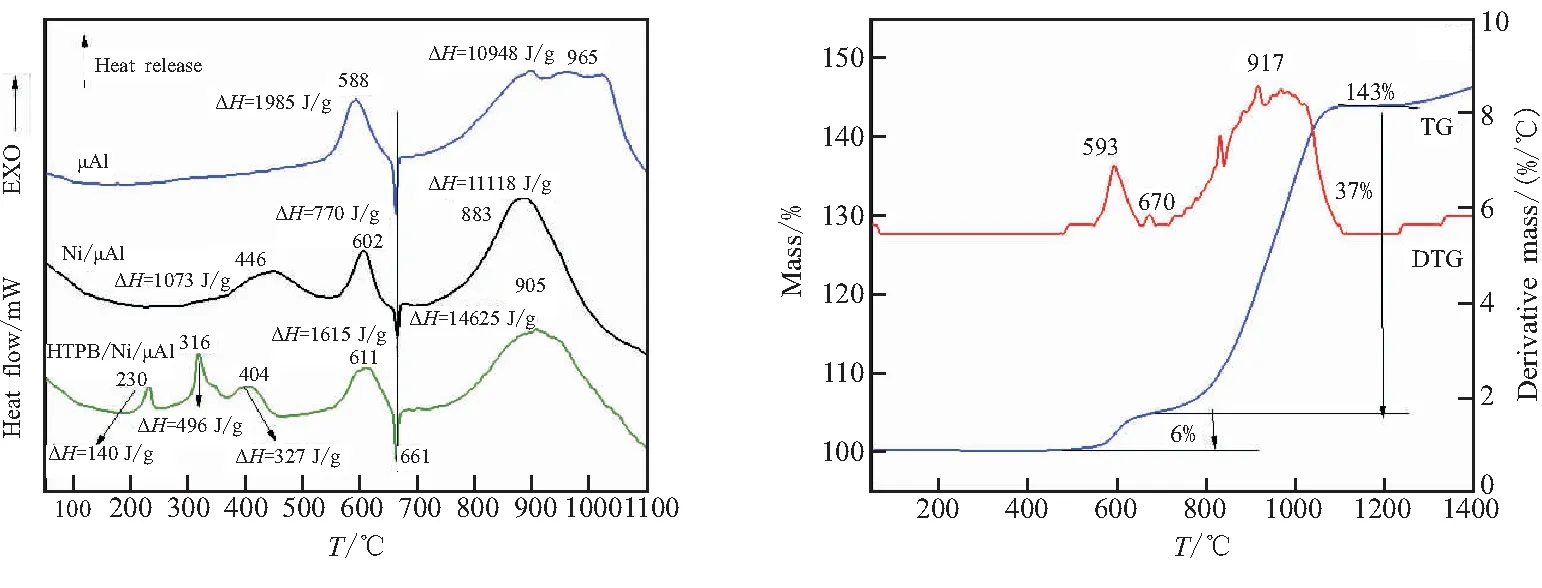
(a)DSC curves (b)TG-DTG curves of μAl
Ni/μAl在50~1100 ℃范围内有3个放热峰,其中在370~530 ℃范围内的放热峰为Ni的氧化放热峰,峰顶温度为446 ℃,放热焓为1073 J/g。μAl在556~650 ℃范围内开始第一阶段氧化放热过程,峰顶温度为602 ℃,放热焓为770 J/g。在725~1044 ℃范围内发生μAl粉的第二氧化放热峰,峰顶温度为883 ℃,放热焓为11 118 J/g,说明Ni有效催化了Al的氧化放热。如图6所示,被还原出的单质Ni代替了Al粉表面的部分Al2O3,接触到氧气后Ni被氧化为NiO,同时与内部紧密接触的Al发生置换反应放出大量热(NiO+Al→Ni+Al2O3),小尺寸的Ni粉又迅速被氧化,使得这个放热反应能够持续下去。纳米Ni在这一反应中是作为氧的载体通过铝热反应把氧从Al粉的表面一直传送到Al粉的芯核,从而促进了Al粉高温下快速氧化[27]。

图6 Ni促进Al氧化释热的机理
从Ni/μAl的TG-DTG曲线(图5(c))可以看出,在50~1100 ℃范围内存在3个增重过程,与DSC曲线Ni的氧化和Al的第一和第二氧化放热峰相对应,分别增重10%、6%和40%。Ni/μAl中μAl增重(46%)略高于纯μAl(41%)。
HTPB/Ni/μAl的DSC曲线在50~1100 ℃范围内有5个放热峰,在196~248 ℃和298~338 ℃范围内的放热峰均为HTPB的分解放热峰,峰顶温度分别为230 ℃和316 ℃,放热焓分别为496 J/g和140 J/g。362~460 ℃范围内的放热峰为Ni的氧化放热峰,峰顶温度为404 ℃,放热焓为327 J/g。μAl在546~657 ℃范围内开始第一阶段氧化放热过程,峰顶温度为611 ℃,放热焓为1615 J/g。753~1029 ℃范围内发生μAl的第二氧化放热峰,峰顶温度为905 ℃,放热焓为14 625 J/g,较μAl放热焓增加了3677 J/g,比Ni/μAl放热焓则增加了3507 J/g,说明HTPB有效地阻止了μAl的氧化。从复合物结构与组成考虑,HTPB/Ni/μAl中具有金属Ni的空穴轨道又具有推进剂组分HTPB做包覆层,实现了对μAl的较好的包覆,保证了Ni颗粒的分散性有效阻止μAl的氧化,更有利于发挥复合材料优异的催化性能[28]。
从HTPB/Ni/μAl的TG-DTG曲线(图5(d))可以看出,在50~1100 ℃范围内存在2个失重和3个增重过程,与DSC曲线中HTPB的两步分解、Ni的氧化和Al的第一和第二氧化放热峰相对应,其中失重10%为HTPB的分解过程,与理论值相符。3个增重过程分别为4%、5%和45%,其中HTPB/Ni/μAl复合粒子中μAl的总增重(50%),比Ni/μAl(46%)和纯μAl(43%)均有所提高,说明HTPB包覆可以进一步阻止Al的表面氧化,提高活性Al含量。
3 结论
(1)以水合肼为还原剂,HTPB为包覆剂,还原和包覆一锅完成,成功制备了有机-无机双包覆的复合粒子HTPB/Ni/μAl。该方法不引入非推进剂组分,工艺简单,可操作性强。
(2)结构和形貌表征结果表明,被还原的单质Ni和HTPB共同包覆在μAl粒子表面,μAl仍然保持为球型,且有较高的结晶度。
(3)DSC分析结果表明,与纯的μAl相比,过渡金属Ni的引入使μAl的低温氧化放热温度升高,而高温的氧化放热温度提前,氧化放热焓增加。其中,对μAl的高温氧化放热过程影响较大,HTPB/Ni/μAl高温氧化峰温(905 ℃)较μAl(965 ℃)提前了60 ℃。
(4)热重分析显示,目标复合物HTPB/Ni/μAl的氧化增重均大于Ni/μAl和纯μAl,说明HTPB包覆可以防止粒子的表面氧化。

