APP/PS1小鼠血脂与β-淀粉样蛋白、Tau蛋白表达水平的相关性及中链脂肪酸的干预作用
李峰,景洪江,李惠子,张新胜,徐庆,张永,薛长勇,刘英华*
(1空军特色医学中心临床营养科,北京 100142 ;2火箭军特色医学中心临床营养科,北京 100088;3中国人民解放军总医院第一医学中心临床营养科,北京 100853)
随着我国逐渐进入老龄化社会,预计到2030年阿尔兹海默症(Alzheimer disease,AD)的人数将达到1 646万,约占全球总病例数的1/4[1],这将给家庭和社会带来沉重的医疗和经济负担。AD的病理现象复杂、机制不清,但随着人们不断探究和认识的深入,各种发病机制假说被相继提出,最经典的就是β-淀粉样蛋白(β-amyloid,Aβ)和Tau蛋白学说,这是因为解剖AD患者大脑组织,发现普遍存在脑神经细胞外大量Aβ沉积形成的老年斑(senile plaques,SP),以及Tau蛋白异常磷酸化形成的细胞内神经原纤维缠结(neurofibrillary tangles,NFTs)。目前临床抗AD药物仅能够延缓病理症状的加重,并不能有效阻止、逆转疾病过程,并且停药后易复发,因此,对AD的有效预防才是关键。很多研究表明,膳食营养素特别是中链脂肪酸(medium chain fatty acid,MCFA)在防治AD方面的作用不容忽视[2]。大脑是人体脂肪含量最丰富的器官,上世纪90年代初,Sparks等[3]就指出胆固醇可能是AD的危险因素,随后有研究证实胆固醇确实能促进Aβ沉积[4]。前期本实验室细胞和动物实验研究均已证实MCFA能够改善C57BL/6J肥胖模型小鼠等实验对象的血脂水平[5,6],也能改善APP/PS1转基因小鼠学习记忆功能[7],人群试验显示MCFA还能降低轻中度AD患者的认知量表评分[8]。因此,本研究进一步探讨血脂和Aβ、Tau蛋白表达水平的相关性,为MCFA可能通过调节脂代谢来发挥改善AD的作用机制提供理论依据。
1 对象与方法
1.1 研究对象
将健康、12周龄的17只无特定病原体(specified pathogens free,SPF)级雄性APP/PS1转基因小鼠(APPSWe.PSEN1d9)按空腹体质量随机分为MCFA组(9只)和长链脂肪酸(long chain fatty acid,LCFA,8只)组,同窝阴性野生型(wide type,WT)小鼠(9只)作为WT组。实验动物许可证编号SCXK(沪)2017-0010,均由上海南方模式生物科技股份有限公司提供。动物房温度(22±2)℃,相对湿度40%~60%,12 h循环光照,干预期间每2天更换1次垫料和饮用水,并记录小鼠饲料消耗量,每周称量1次空腹体质量(禁食不禁水12 h)。
1.2 方法
1.2.1 实验用脂肪酸来源及饲料配方 在普通大小鼠维持期饲料(AIN-96G)上,MCFA组和LCFA组分别添加了10%的MCFA和LCFA,并经钴60辐照射灭菌,各种干预用脂肪酸均由日清奥利友(中国)投资有限公司提供。各组饲料营养素含量基本一致,即蛋白质占比约16.78%,脂肪占比约17.34%,碳水化合物占比约48.85%,含水量约8.80%,其他物质含量约8.23%,各组饲料脂肪酸具体含量由北京市营养源研究所提供检测报告(表1)。
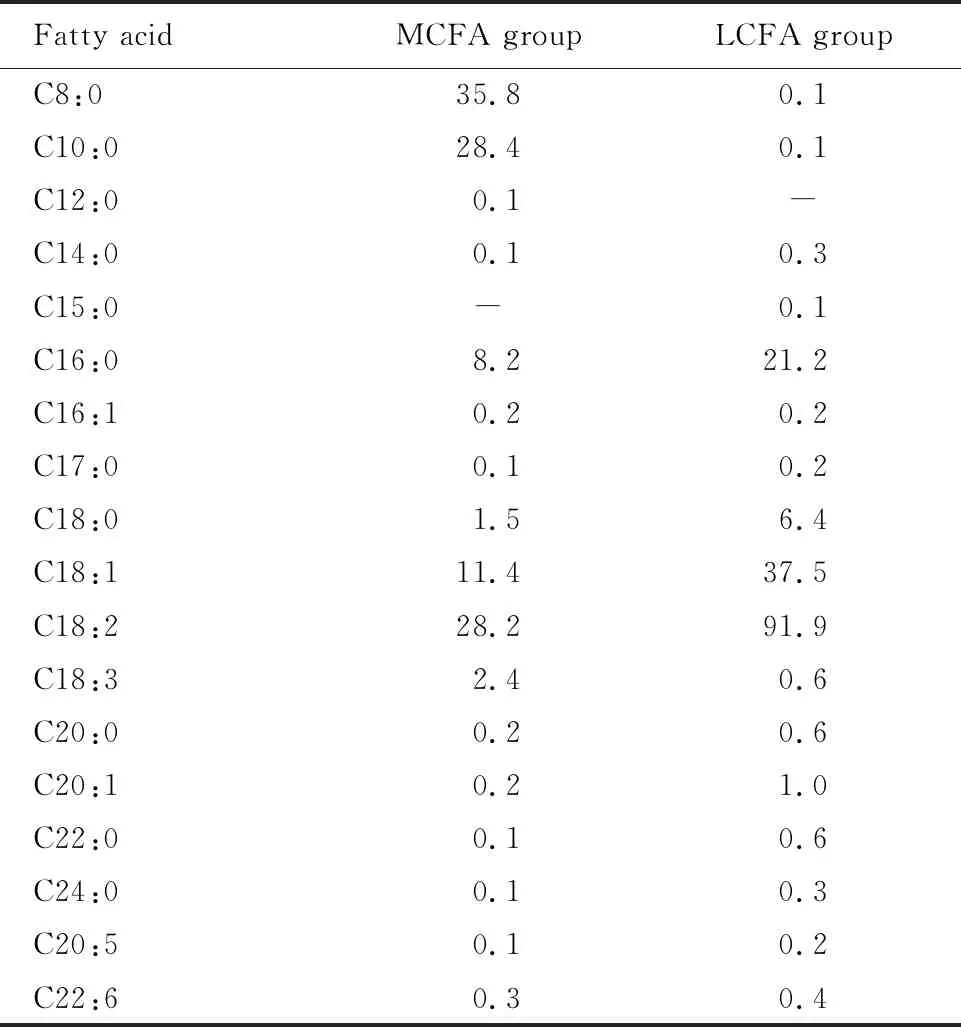
表1 各组饲料脂肪酸含量
1.2.2 检测指标 (1)血脂测定:小鼠经腹腔注射1%戊巴比妥麻醉后处死,从腹主动脉取血后用台式高速冷冻离心机TGL-16(湘仪公司)1 500×g离心15 min,取上清液,按照试剂盒说明书操作测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyce-rides,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。(2)大脑重量测定:剪开小鼠的头皮,暴露出头部,用直镊将小鼠脑壳拨开,小心取出大脑组织,冰上放置,用梅特勒ME104E分析天平称重,然后分离完整的皮层和海马组织并称量,所有组织用干净的锡箔纸分别包装,液氮保存后放于-80℃冰箱冷存备检。(3)Western blot免疫印迹检测:检测指标为大脑皮层和海马组织的Aβ前体蛋白(Aβ precursor protein,APP)、Aβ和Tau蛋白,即按质量与体积比1∶9加入1×细胞裂解液,并加入蛋白酶及磷酸酶抑制剂,超声破碎组织,离心取上清样品进行常规处理后,分别加入APP抗体(ab15272)、Aβ1-42抗体(ab201060)、Tau抗体(ab32057),4℃过夜,然后依次漂洗、标记并显影,将显色后的膜照相,采用scion image软件进行灰度分析。
1.3 统计学处理
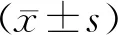
2 结 果
2.1 各组小鼠体质量、大脑质量和血脂情况比较
干预至36周龄后,MCFA组小鼠体质量、大脑质量和LDL-C明显高于WT组(P<0.05);LCFA组小鼠体质量、大脑质量和TC明显高于WT组(P<0.05)。MCFA组与LCFA组小鼠空腹体质量、大脑质量、HDL-C和LDL-C比较,差异均无统计学意义(P>0.05);而TC和TG比较,MCFA组明显低于LCFA组(P<0.01;表2)。说明MCFA具有改善血脂的作用。
表2 MCFA和LCFA对小鼠体质量、大脑质量和血脂的影响
Table 2 Effect of MCFA and LCFA on blood fat, body and brain mass of mice

表2 MCFA和LCFA对小鼠体质量、大脑质量和血脂的影响
MCFA: medium chain fatty acid; LCFA: long chain fatty acid; WT: wild type; TC: total cholesterol; HDL-C: high-density lipoprotein cholesterol; LDL-C: low-density lipoprotein cholesterol; TG: triglycerides.Compared with WT group,*P<0.05;compared with MCFA group, #P<0.05.
GroupnInitial body mass(4-week,g)End body mass(36-week,g)Brain mass(g)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)TG(mmol/L)WT914.82±1.9132.33±2.46 0.40±0.04 2.85±0.32 2.41±0.440.31±0.12 1.72±0.71 MCFA914.58±1.6838.00±3.96*0.45±0.02*3.17±0.29 2.88±0.220.50±0.15*1.36±0.28 LCFA814.14±1.4938.68±4.25*0.44±0.02*3.82±0.13*#2.90±0.710.47±0.17 2.44±0.77#
2.2 各组小鼠海马、皮层组织APP、Aβ和Tau蛋白表达水平比较
MCFA组和LCFA组小鼠海马和皮层组织APP、Aβ和Tau蛋白表达水平明显高于WT组(P<0.05);MCFA组小鼠海马和皮层组织Aβ、Tau蛋白表达量明显低于LCFA组(P<0.01),皮层组织APP蛋白表达量也明显低于LCFA组(P<0.05),而海马组织APP蛋白的表达水平无显著差异(P>0.05)。各项指标与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)内参值的面积灰度比值详见表3,图1。
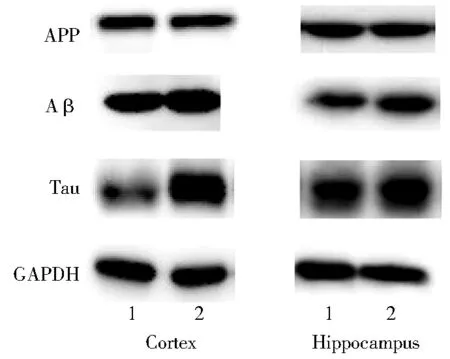
图1 各组小鼠大脑皮层和海马Aβ、APP与Tau蛋白的表达
表3 各组小鼠海马、皮层组织蛋白表达水平比较
Table 3 Protein expression levels of cerebral hippocampus and cortex in each group

表3 各组小鼠海马、皮层组织蛋白表达水平比较
WT: wild type; MCFA: medium chain fatty acid; LCFA: long chain fatty acid; Aβ:β-amyloid; APP: Aβ precursor protein. Compared with WT group, *P<0.05;compared with MCFA group, #P<0.05.
GroupnCortexAPPAβTauHippocampusAPPAβTauWT90.61±0.220.23±0.050.35±0.130.43±0.090.38±0.040.49±0.10MCFA90.96±0.07*0.45±0.07*0.89±0.07*0.71±0.03*0.56±0.02*0.78±0.05*LCFA81.15±0.19*#0.88±0.04*#1.42±0.21*#0.76±0.09*0.68±0.03*#1.01±0.03*#
2.3 血脂与海马、皮层组织Aβ、Tau蛋白表达水平的相关性
将MCFA组和LCFA组小鼠的TG、TC结果与其海马、皮层组织的Aβ、Tau蛋白表达水平进行相关性分析,结果显示TG与皮层组织Aβ蛋白表达水平呈正相关(r=0.399;P<0.05),而TC与皮层和海马组织Aβ蛋白表达水平均呈显著正相关(r=0.715,0.748;P<0.01),也与海马组织Tau蛋白表达水平呈正相关(r=0.603;P<0.05),说明小鼠血脂水平尤其是TC与Aβ之间具有显著线性相关,可以较方便地预测脑组织Aβ蛋白的表达水平(图2)。
图2 TC和小鼠皮层、海马组织Aβ表达水平的相关性
3 讨 论
大脑含有丰富的脂质,大多数胆固醇存在于髓鞘的少突胶质细胞、质膜星形胶质细胞和神经元,髓鞘含有70%的脂质,包括胆固醇、鞘脂和胆固醇磷脂。胆固醇、鞘脂是神经元质膜的基本成分,以脂阀的形式存在,参与信号转导、神经递质释放、突触发生和膜运输。Chew等[9]研究指出,胆固醇可以调节Aβ的代谢过程,如转运和清除等,即β-分泌酶1(β-site amyloid cleavage enzyme 1, BACE-1)和γ-分泌酶存在于神经元质膜的脂筏中,能促使APP裂解形成Aβ,而在AD中,增加的胆固醇脂筏聚集会增强BACE-1的作用,使Aβ产物增加,从而导致AD的病理特征SP的出现。此外,尽管大脑和血清中的胆固醇等脂类物质因血脑屏障而各自独立存在,但也有学者认为[10],高胆固醇血症时会导致循环和脑中27-羟基胆固醇(27-hydroxycholesterol,27-OHC)均升高,27-OHC能通过血脑屏障,最终影响大脑胆固醇代谢和AD致病进程的调节。Zhang等[11]研究显示,27-OHC和LDL-C水平上升、HDL-C水平下降时,大脑Aβ的水平则上升。因此,胆固醇代谢异常可导致大脑脂质稳态失调,从而导致认知障碍。国内外研究均已证实[12-14],血清中TC、TG、LDL等水平与AD的发生密切相关,而部分学者则认为只有TC与AD的发生有关联[15],与这些观点并不完全一致的是,本研究仅发现APP/PS1小鼠的血清TC水平与其皮层、海马组织Aβ蛋白表达水平呈显著正相关(r=0.715,0.748;P<0.01),也与海马组织Tau蛋白表达有明显正相关(r=0.603;P<0.05);而TG只与其皮层组织Aβ蛋白表达水平有相关性(r=0.399;P<0.05),由此可以推测胆固醇代谢在AD的发生和进展中可能占据更重要的位置,TC确实可以作为阿尔茨海默病早期诊断的生物标志物[16]。
不同脂肪酸对于脑神经组织和认知功能的影响历来是研究关注的热点,MCFA具有明显的生酮作用,很早引起人们的关注,主要源自其治疗难治性小儿癫痫、脂质吸收障碍等疾病有很好的疗效[17]。近年来很多研究相继证实,MCFA可以减少机体大脑Aβ沉积,改善AD患者认知水平,是因为其大脑神经元获取葡萄糖供能存在障碍,而MCFA生成的酮体是一种优秀的替代性能源物质[18]。一项纳入152例AD患者的随机对照双盲的多中心试验,证实了一种中链甘油三酯产品AC1202能够改善患者认知功能,因此被FDA批准用于轻至中度的AD代谢衰退过程的临床营养治疗中[19]。本实验室前期的动物实验和人群试验均得到了与上述结果基本一致的结论,MCFA确实能改善AD动物或人群的认知能力[7,8]。此外,长期摄入饱和脂肪酸或反式不饱和脂肪酸导致高胆固醇血症等是诱发AD的危险因素,而MCFA则能通过增加粪便胆固醇排泄和转化为胆汁酸排出等机制,改善机体脂代谢,显著改善机体的TC、TG、LDL-C等水平[5,6,20]。本研究也再次证实了MCFA改善TC、TG的作用,特别是相关性分析进一步阐明了TC与小鼠大脑皮层、海马组织Aβ蛋白表达呈显著正相关,尽管两者的因果关系尚未确定,但MCFA很可能通过调节脂代谢尤其是TC水平,从而降低AD小鼠大脑皮层和海马组织Aβ沉积,改善认知功能。
综上,AD的病理机制十分复杂,MCFA具有抗氧化、生酮、调脂等多种作用,这与AD的病程进展都有相关性,面对药物有效防治AD手段欠缺和疗效欠佳的现状,通过调整MCFA等膳食营养素,来达到防治AD的目的,逐渐引起众多学者的兴趣和认可。尽管MCFA通过调节脂代谢减少AD小鼠大脑皮层和海马组织的Aβ沉积,从而改善其认知功能的具体机制目前还不清楚,但其用于辅助防治AD具有独特的潜能和优势,值得进一步深入研究和应用推广。

