嗜黏蛋白阿克曼菌对高脂饲料诱导的肥胖ApoE基因敲除小鼠血脂代谢及炎症因子的影响
李丽雅,刘玉猛,张永,张新胜,杨雪艳,刘英华
(中国人民解放军总医院第一医学中心营养科,北京 100853)
随着全球经济的快速发展,人们的生活方式和饮食习惯发生了极大改变,全球肥胖人数逐年增加。超重和肥胖已经发展到“流行病”的程度,成为危害全球健康的严重公共卫生问题。肥胖是引起脂代谢紊乱的相关危险因素[1,2],多数肥胖患者均存在脂代谢紊乱。而脂代谢紊乱是动脉粥样硬化发生的独立危险因素[3,4],在相关疾病发生发展过程中扮演着重要角色。也有研究发现,慢性全身性炎症与代谢性疾病有关,而肥胖是一类慢性低度炎症反应[5,6],严重威胁人类身心健康,给家庭和社会带来了极大的经济负担。
近年来,随着肠道微生态学研究的发展以及测序和分析技术的进步,越来越多的研究表明,肠道菌群在肥胖的发生发展中发挥重要作用。本课题组前期研究发现,基线肠道微生物群作为个体减肥轨迹的预测指标优于其他因素。嗜黏蛋白阿克曼菌(Akkermansiamuciniphila,AKK)在瘦个体中显著富集[7],且通过动物实验证实AKK在改善肥胖大鼠糖脂代谢紊乱中发挥有益作用[8]。
既往研究发现,载脂蛋白E(apolipoprotein E,ApoE)[9]是乳糜微粒、极低密度脂蛋白及高密度脂蛋白的重要组成部分,可调节胆固醇和脂蛋白代谢,其缺失和变异都会引起体内代谢失常及功能紊乱,高脂饲料诱导的肥胖ApoE基因敲除(ApoE-/-)小鼠短期内即可出现脂代谢异常。本研究通过高脂饲料诱导ApoE-/-小鼠建立肥胖模型,观察AKK对其血脂代谢及炎症因子相关指标的影响,为肥胖的治疗提供实验依据,进而为动脉粥样硬化相关疾病的治疗提供新的思路。
1 材料与方法
1.1 实验动物
SPF级雄性C57BL/6J、ApoE-/-4周龄小鼠,平均体质量为(15.25±0.85)g,由北京华阜康生物科技股份有限公司提供,许可证号SCXK京2019-0008。
1.2 饲料及AKK
1.2.1 高脂饲料 喂养H10045饲料,由北京华阜康生物科技股份有限公司提供。能量占比为脂肪45%、碳水化合物35%、蛋白质20%。
1.2.2AKK为德国DSMZ原装进口,由北京孚曼生物技术有限公司扩增并提供经低温离心后的高浓缩菌混悬液。
1.3 主要试剂及仪器
全自动生化分析仪(日立HITACHI-7100);甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)及低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)检测试剂盒(北京新创科兴科技有限公司);Rayto RT-6100酶标分析仪(上海酶联生物科技有限公司);白细胞介素-L(interleukin-1, IL-1)、IL-6、IL-8、IL-10、C反应蛋白(C-reactive protein, CRP)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(上海酶联生物科技有限公司);万分之一电子天平(FA-N,中国民侨公司);台式高速冷冻离心机(TGL-16,湘仪公司);苏木精-伊红(hematoxylin-eosin,HE)染色仪(Pannoramic SCAN,匈牙利3DHistech公司),染色图像由武汉百仟度生物科技有限公司提供。
1.4 实验方法
1.4.1 肥胖模型建立 健康SPF级雄性C57BL/6J、ApoE-/-小鼠,均饲喂高脂饲料。小鼠饲养在温度24℃、湿度75%、12h光照-黑暗循环的实验室中,自由饮水,自由采食配好的饲料。观察并记录动物生长与进食情况。6周后称量小鼠空腹体质量,以C57BL/6J小鼠为对照组,体质量超过对照组小鼠平均体质量10%的ApoE-/-小鼠为肥胖建模成功。
1.4.2 动物分组 选取成功建模的ApoE-/-肥胖小鼠20只,按数字1~20随机捉取进行编号,奇数为模型组,偶数为AKK干预组,每组各10只;对照组小鼠10只,共3组。
1.4.3 干预方法 对照组及模型组灌胃不含AKK的甘油制剂,AKK干预组灌胃含1×109CFUAKK的甘油制剂。每日灌胃1次,每次0.1 ml,共灌胃4周。
1.5 观测指标
1.5.1 体质量、附睾脂肪组织质量及血液指标 干预结束后,小鼠禁食不禁水,12 h后测空腹体质量。水合氯醛3 ml/kg麻醉后,腹主动脉采血,取附睾脂肪组织。用含促凝剂的真空采血管采血后,以1 600 g/min离心15 min,取上清液并按试剂盒操作说明书对血液指标进行测定。采用生化法测定TG、TC、HDL-C及LDL-C水平,Elisa法测定IL-1、IL-6、IL-8、IL-10、CRP、TNF-α及MCP-1水平。用滤纸吸干附睾脂肪组织表面的组织液,用万分之一电子天平称重并记录各组小鼠数据,计算其体脂百分比。体脂百分比=(附睾脂肪质量/小鼠体质量)×100%。
1.5.2 HE染色 用福尔马林溶液固定附睾脂肪组织,经石蜡包埋切片后用HE染色。脱水封片后,用显微镜镜检采集图像。将附睾脂肪组织HE染色切片于200倍显微镜下观察脂肪细胞脂滴大小,每张切片随机摄取10个视野,并采用Image-Pro Plus 6.0软件分析附睾脂肪细胞平均面积。
1.6 统计学处理
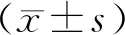
2 结 果
2.1 3组小鼠空腹体质量、附睾脂肪质量及体脂百分比的比较
3组小鼠初始空腹体质量比较,差异无统计学意义(P>0.05),具有可比性。喂养高脂饲料6周后,ApoE-/-小鼠空腹体质量显著增加(P<0.05),建模成功。灌胃干预4周后,AKK干预组小鼠空腹体质量、附睾脂肪质量及体脂百分比较模型组均有下降趋势,但差异均无统计学意义(P>0.05;表1)。
表1 3组小鼠空腹体质量、附睾脂肪质量及体脂百分比的比较
Table 1 Comparison of fasting body mass, epididymal fat mass and body fat percentage among three groups of mice
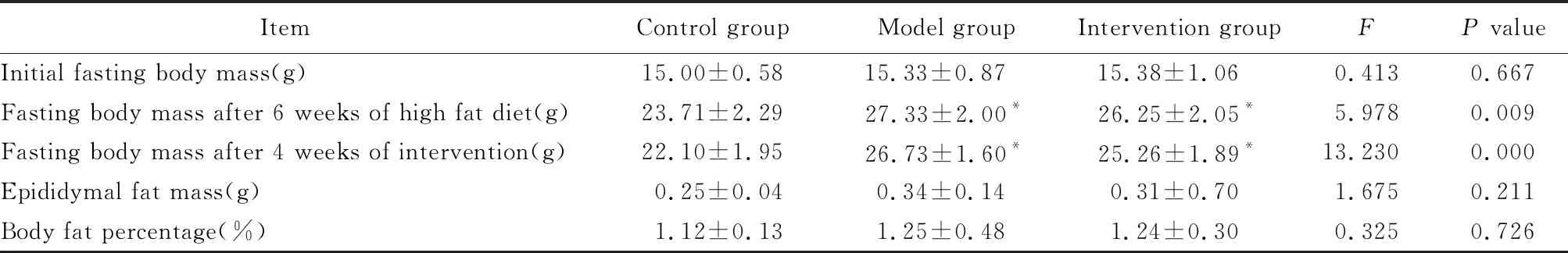
表1 3组小鼠空腹体质量、附睾脂肪质量及体脂百分比的比较
Compared with control group,*P<0.05.
ItemControl groupModel groupIntervention group FP valueInitial fasting body mass(g)15.00±0.5815.33±0.87 15.38±1.06 0.4130.667Fasting body mass after 6 weeks of high fat diet(g)23.71±2.2927.33±2.00*26.25±2.05*5.9780.009Fasting body mass after 4 weeks of intervention(g)22.10±1.9526.73±1.60*25.26±1.89*13.2300.000Epididymal fat mass(g)0.25±0.040.34±0.14 0.31±0.70 1.6750.211Body fat percentage(%)1.12±0.131.25±0.48 1.24±0.30 0.3250.726
2.2 3组小鼠血脂代谢相关指标的比较
灌胃干预4周后,AKK干预组血脂代谢指标TG、TC及LDL-C显著低于模型组,TG及LDL-C显著低于对照组,差异均有统计学意义(均P<0.05),AKK可逆转APOE-/-导致的血脂异常的趋势。AKK干预组HDL-C显著高于模型组及对照组,差异均有统计学意义(均P<0.05;表2)。

表2 3组小鼠血脂代谢相关指标的比较
2.3 3组小鼠炎症因子相关指标的比较
灌胃干预4周后,AKK干预组炎性因子指标IL-1、IL-6、IL-8、CRP、TNF-α及MCP-1均显著低于模型组及对照组,差异均有统计学意义(均P<0.05)。IL-10有升高趋势,但3组比较差异无统计学意义(P>0.05;表3)。

表3 3组小鼠炎症因子相关指标的比较
2.4 肥胖小鼠附睾脂肪组织HE染色结果
附睾脂肪组织HE染色切片于200倍显微镜下观察,发现对照组小鼠脂肪细胞排列紧密、界限清晰,单个视野下呈现出细胞直径短、体积小、数量多的特点。与对照组比较,模型组小鼠脂肪细胞大小不均、形态不规则,呈大空泡状,细胞壁变薄,单个视野下呈现出细胞直径长、体积大、数量少的特点。而AKK干预组较模型组小鼠脂肪组织细胞大小明显缩小,形态规整,单个视野下脂肪细胞数量明显增多(图1)。用Image Pro Plus 6.0软件分析附睾脂肪细胞平均面积,结果显示与对照组比较,模型组小鼠附睾脂肪组织细胞平均面积[(879.58±36.74)和(286.20±18.00)μm2]显著增大(P<0.05);与模型组比较,AKK干预组小鼠附睾脂肪组织细胞平均面积[(330.45±55.84)和(879.58±36.74)μm2]显著减小,差异均有统计意义(均P<0.05;图2)。
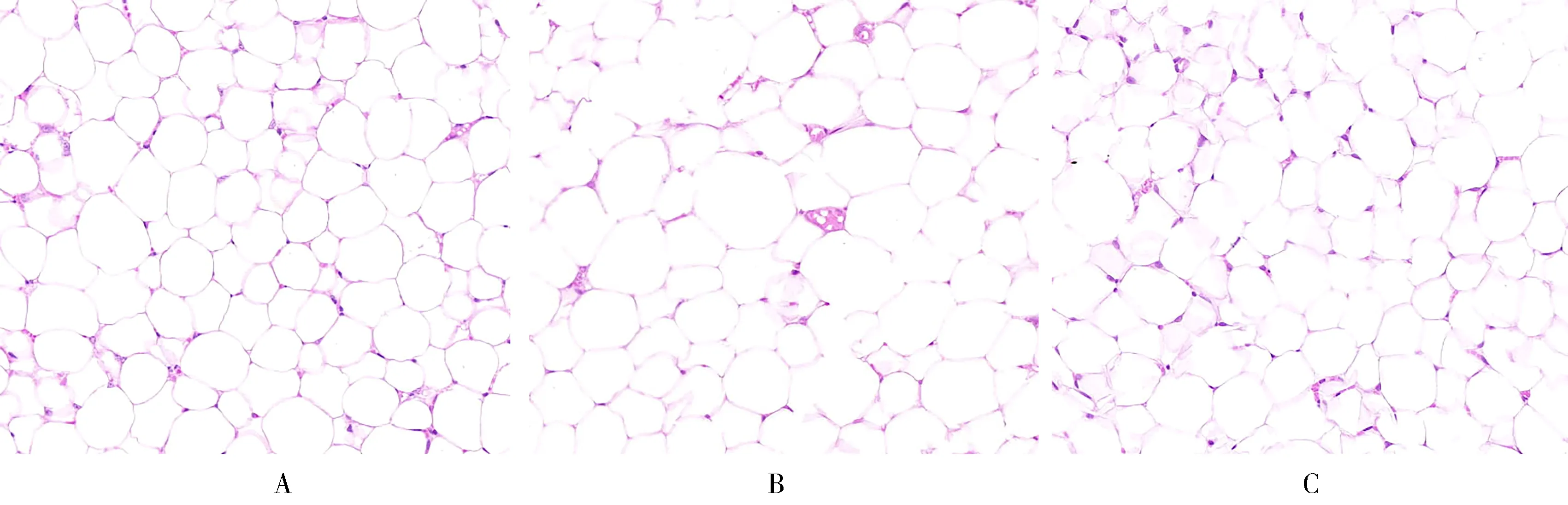
图1 3组小鼠附睾脂肪组织HE染色
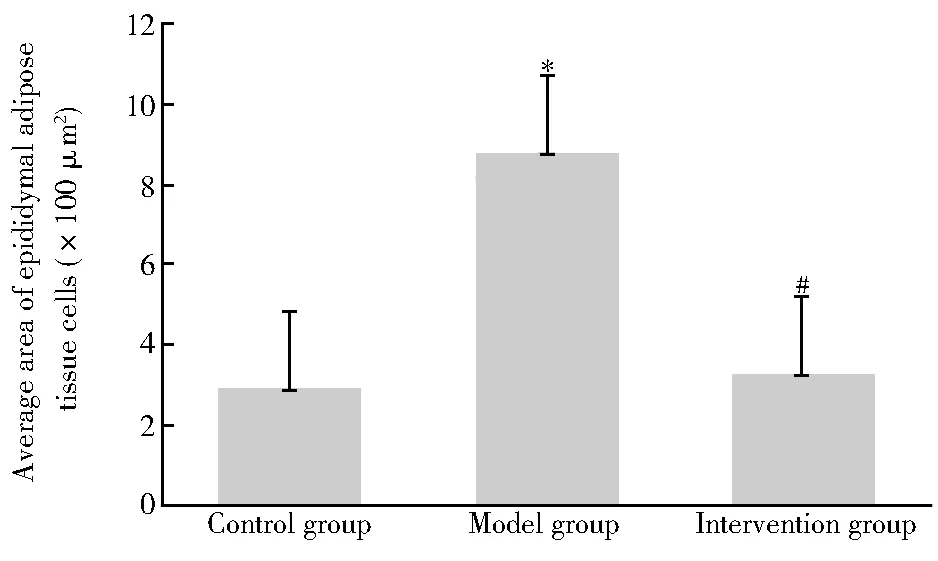
图2 3组小鼠附睾脂肪组织细胞平均面积比较
3 讨 论
肥胖个体多数伴随脂代谢紊乱。有研究发现,ApoE-/-小鼠喂养高脂饲料短期内会出现脂代谢紊乱[9,10]。本研究通过高脂饲料喂养ApoE-/-小鼠6周,设定按体质量超过对照组小鼠平均体质量10%的肥胖个体为实验动物模型。从实验结果分析,模型组血清血脂代谢指标及HE染色下脂肪组织细胞平均面积均高于对照组,差异有统计学意义。反向证实,本研究设定成立。本课题组前期研究证实,1×109CFU/d浓度的AKK在改善肥胖大鼠糖脂代谢紊乱中发挥有益作用。故本研究将AKK的干预浓度定为1×109CFU/d,通过空腹体质量、附睾脂肪质量、血脂代谢指标及血清中炎症因子指标水平评价AKK对脂代谢紊乱的干预作用,为临床深入研究AKK对脂代谢紊乱的作用机制提供实验依据。
本研究结果显示,灌胃干预4周后,与模型组相比,1×109CFU/d浓度的AKK可降低ApoE-/-小鼠TG、TC及LDL-C水平,升高HDL-C水平(均P<0.05),与Plovier等[11]的研究结果一致。AKK干预改善了肥胖ApoE-/-小鼠血脂代谢指标。此外,AKK干预组较模型组体质量虽有下降趋势,但差异无统计学意义。可能由于AKK干预时间短,体质量未出现明显差异。
本研究结果显示,1×109CFU/d浓度的AKK改善了高脂饲料喂养的肥胖ApoE-/-小鼠的血清炎症因子水平,与相关研究[12,13]结果一致,AKK对缓解宿主代谢炎症具有积极作用。1993年,Hotamisligil等[14]于动物模型中首次发现肥胖与炎症密切相关。随着研究的进展,肥胖作为慢性炎症性疾病的观点被广泛认可[15,16]。相关研究证实,肥胖患者脂肪组织增生会导致IL-1、IL-6、CRP、TNF-α及MCP-1等炎性因子的过度分泌和表达,缓解慢性炎症已成为治疗和预防肥胖及相关代谢性综合征的新靶点[17,18]。近年来,有研究显示,AKK有助于降低血清TNF-α、IL-8水平,增加IL-10的表达[19,20]。其可通过诱导T调节细胞减轻内脏脂肪组织的炎症[21]。AKK补充剂可减少肝脏和肌肉中的代谢性内毒素血症和炎症信号传导[22]。
本研究在200倍显微镜下观察附睾脂肪组织HE染色切片,发现AKK干预组较模型组小鼠脂肪组织细胞大小缩小,形态规整;附睾脂肪组织细胞平均面积显著减小(P<0.05),表明AKK可改善体内脂肪堆积。但是,AKK干预组及模型组,仅在附睾脂肪组织病理形态下呈现差异性,2组附睾脂肪质量比较,差异无统计学意义。可能由于本研究样本量小,附睾脂肪质量未能出现差异性,今后有待进一步大样本实验对结果进行验证。
综上,本研究为肥胖的治疗提供了进一步的实验依据,为动脉粥样硬化的防治提供新的治疗思路。此外,本课题组对研究中小鼠的肠道菌群丰度、组织中炎症因子的水平和表达也进行了相关测定,后续将进一步探讨AKK对血脂代谢及炎症因子的作用机制。随着人们对AKK研究的不断深入,相信不久的将来其会为超重与肥胖及肥胖代谢性疾病的预防及治疗提供新的方向和选择。

