一株益生型枯草芽孢杆菌液态发酵条件优化
◎ 余 薇,邓小华,刘 婷,潘笃杰,郑巧双
(湖北工业微生物菌种保藏与研究中心,湖北 武汉 430019)
枯草芽孢杆菌是一种广泛存在于自然界的好氧杆菌,该菌主要是通过消耗肠道内多余的氧、降低氧化还原电位及环境pH,从而创造厌氧环境,抑制某些有害病菌,达到预防及治疗某些肠道病的作用[1-2]。枯草芽孢杆菌还具有较强的多种酶促活性,能用于动物饲料添加剂中发挥益生菌的功效[3]。水产养殖行业中,在水体环境或者水产养殖饲料中使用枯草芽孢杆菌制剂能有效抑制甚至杀灭水体环境中的某些有害微生物,强化益生菌群体系,从而达到防治水产疾病的目的[4-5]。枯草芽孢杆菌在食品工业也有广泛的应用,例如日本学者发现枯草杆菌能发酵纳豆产生一种枯草杆菌蛋白激酶,这种酶能溶解血栓,可开发出一种新的溶栓药品[6]。在医药领域,枯草芽孢杆菌活菌剂还可以作为口服液治疗肠炎、支气管炎和腹泻等多种疾病,也能用来预防和治疗烧伤面感染等[7]。
目前枯草芽孢杆菌在饲料行业应用广泛,多采用固态发酵模式获得高活菌数,菌粉纯度不高,做法较为粗糙只能用于饲用行业及水产养殖行业,而医药行业以及食品行业所需要的菌剂要求纯度较高,有些也需要液态发酵代谢产物。因此,本研究对一株能改善肠道功能的药食性益生型枯草芽孢杆菌液态发酵工艺进行优化,期望解决现阶段液态发酵工业化生产中存在的活菌数低、成本高等问题,为工业化生产提供一定的指导。
1 材料和方法
1.1 材料与设备
1.1.1 试验菌种与培养基
枯草芽孢杆菌(Bacillus subtilisHB82025),来源于湖北工业微生物菌种保藏与研究中心。
营养肉汤NB:蛋白胨10 g、牛肉粉3 g、氯化钠5 g、蒸馏水1 000 mL,pH 7.2。
1.1.2 仪器与设备
三角瓶、量筒、pH计、UV2600分光光度计(岛津)、DL2002电子天平(梅特勒)、恒温振荡培养箱(上海一恒)、BSC-1600ⅡA2生物安全柜(苏净安泰)、cx31三目显微镜(奥林巴斯)、生化培养箱(上海一恒)、自动灭菌锅(上海申安)等。
1.2 实验方法
1.2.1 培养方法
将保藏好的菌种冻存管(编号HB82025),按照5%接种量,接种于10 mL营养肉汤(NB)培养基中, 37 ℃,200 r·min-1,活化16 h,然后将活化种按照5%接种量接种于50 mL NB培养基中,37 ℃,200 r·min-1,培养8 h,作为一级种子液,按照5%接种量接种于发酵液,采用三角瓶装发酵液,装液量为1/10(v/v),于37 ℃、200 r·min-1恒温振荡培养24 h,进行培养基及发酵条件优化试验。
1.2.2 碳源筛选
在原始NB培养基基础上分别添加葡萄糖、蔗糖、麦芽糖和淀粉作为额外碳源,添加量均为0.5%,并设置空白,于37 ℃、200 r·min-1恒温振荡培养24 h后采用倾注法[8]活菌计数,检测发酵液中的活菌含量以筛选最佳碳源。
1.2.3 氮源筛选
在上述1.2.2确定的最佳碳源基础上,分别以蛋白胨、大豆蛋白胨、牛肉粉、酵母粉和尿素作为氮源,添加量均为2%,于37 ℃、200 r·min-1恒温振荡培养24 h检测发酵液中的活菌含量以筛选最佳氮源。
1.2.4 无机盐筛选
无机盐选择1#—氯化钠、2#—MgSO4.7H2O、3#—MnSO4.H2O、4#—磷 酸 二 氢 钾(0.25%)+磷酸 氢 二 钾(0.25%)及5#—MgSO4·7H2O(0.07%)+MnSO4·H2O(0.03%)+磷酸二氢钾(0.2%)+磷酸氢二钾(0.2%);无机盐总量控制在0.5%,于37 ℃、200 r·min-1恒温振荡培养24 h,检测发酵液的活菌数以筛选最佳的无机盐。
1.2.5 菌株生长曲线测定
将保藏冻存管活化好后,种子液及发酵液均采用上述筛选出的最佳培养基,种子液活化及接种量、发酵参数等均同1.2.1,自接种后每2 h取样1次测定菌液的OD600,用未接种的培养基作为空白对照。
1.2.6 发酵模式优化
将24 h连续摇床发酵改为分段式补料发酵模式,发酵液接种后在第一阶段发酵14 h,然后将发酵培养基按照1∶1补料,再连续发酵10 h,结束发酵;取样测定发酵液活菌等指标。
2 结果与分析
2.1 发酵培养基优化
培养基中碳源、氮源、无机盐优化结果分别如图1~ 图3所示。
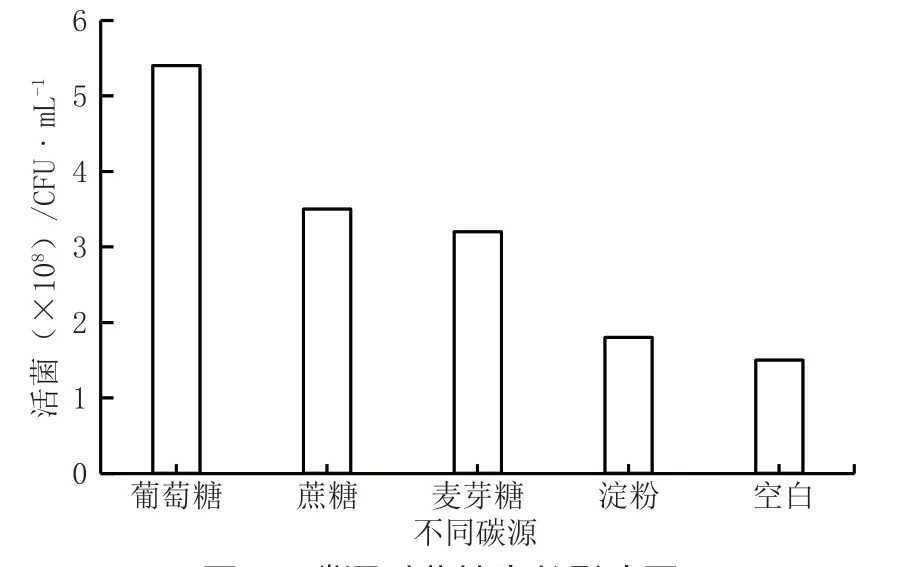
图1 碳源对菌株生长影响图
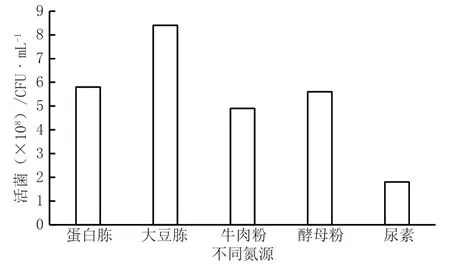
图2 氮源对菌株生长影响图
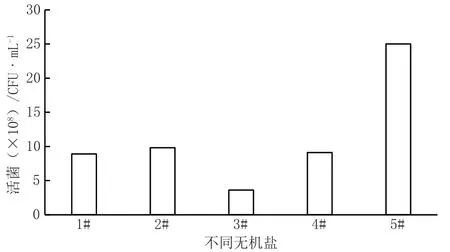
图3 无机盐对菌株生长影响图
(1)碳源筛选。在原始营养肉汤培养基基础上,额外添加0.5%葡萄糖、蔗糖等作为碳源,除了淀粉外,其他实验组均有明显的促生长作用,葡萄糖作为单糖也明显优于蔗糖和麦芽糖。
(2)氮源筛选。将大豆蛋白胨作为氮源替代普通蛋白胨,对该枯草芽孢杆菌有很明显的促生长作用,尿素作为氮源效果最差,而蛋白胨、牛肉粉、酵母粉效果相当。
(3)无机盐筛选。采用5组无机盐添加配比,筛选最佳的无机盐组分,由图3可以看到2#、4#分别采用MgSO4·7H2O以及磷酸二氢钾和磷酸氢二钾替代NaCl,对枯草芽孢杆菌的生长有一定促进作用,但是不显著;3#效果更差一些,可能是Mn+浓度过高,对菌株生长产生了抑制;5#采用MgSO4·7H2O、MnSO4·H2O、磷酸二氢钾和磷酸氢二钾4种无机盐进行复配,其促生长效果很显著。
2.2 发酵模式改进优化
该菌种采用上述最优培养基发酵,生长曲线如图4 所示。由图4可知,0~4 h为菌株生长的停滞期,菌数增长很少,而4 h后进入对数生长期,14 h到达生长高峰,10~14 h为生长稳定期,菌株生长缓慢, 14 h后生物量开始减少,进入衰亡期。以该生长曲线作为参考,在其到达最高点时调整发酵模式,在14 h后进行补料,添加新鲜培养基,再继续发酵10 h,延长其对数生长期。
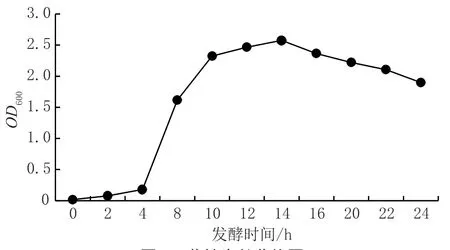
图4 菌株生长曲线图
改进发酵模式后,相应发酵液活菌如表1所示。

表1 不同发酵模式生物量表
由表1可知,更改发酵模式采用分段发酵,发酵14 h后补料,新加入培养基继续发酵10 h,因新增营养,有利于发酵过程中菌体生长期延长,能有效提高其发酵液活菌生物量情况。OD600提高近1倍,而活菌也由2.48×109CFU·mL-1提高到8.4×109CFU·mL-1,优化效果非常显著,该发酵模式对工业化生产发酵放大具有很大的指导意义。
3 结论
本实验对一株药食性益生型枯草芽孢杆菌的液态发酵条件进行了优化,优化后的培养基配方为0.5%葡萄糖、2%大豆蛋白胨、0.07% MgSO4·7H2O、0.03% MnSO4·H2O、0.2%磷酸二氢钾、0.2%磷酸氢二钾,pH=7.2,接种量5%,装液量10%,摇床转速 200 r·min-1、发酵14 h后按照1∶1补料新鲜培养基,继续发酵10 h,整个发酵时间为24 h。该液态发酵条件下,发酵液活菌高达8.4×109CFU·mL-1,优化效果显著。

