烟草DELLA基因家族的克隆与表达模式分析
蔡健宇,余婧,张景云,李翔宇,贾蒙骜,尹国英,叶定勇,薛晓兵,张盼,邹颉,郭玉双*
1.贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵阳市观山湖区龙滩坝路29号 550081 2.浙江省宁波市宁海县农业农村局,浙江省宁波市宁海县桃源中路118号 315600 3.江西省农业科学院蔬菜花卉研究所,南昌市青云谱区南莲路602号 330200 4.黑龙江省农业科学院作物资源研究所,哈尔滨市南岗区学府路368号 150030 5.贵州中医药大学药学院,贵阳市花溪区大学城栋青南路 550030
烟草是我国重要的经济作物之一,而赤霉素(Gibberellin,GA)是一种在烟草种植中被广泛使用的植物激素,能够影响烟草的株型、抗性和烟叶的质量[1-2]。DELLA蛋白在GA信号通路中为抑制效应因子,内源GA可诱导其降解并解除其抑制效应[3]。研究显示,GA缺失时,DELLA-GFP融合蛋白在细胞核中富集;GA存在时,融合蛋白在核中的信号消失[4],GA诱导的DELLA蛋白降解依赖于DELLA蛋白中的DELLA结构域[5],缺失该结构域的DELLA蛋白在GA存在的情况下仍然稳定。此外,研究者们以模式植物拟南芥(Arabidopsis thaliana)为研究对象,通过单突变或者多突变的方式逐个验证DELLA蛋白序列中关键结构域的功能,逐步解析其在拟南芥生长发育过程中的多面调节作用[6-8]。目前,拟南芥中已发现了包括GAI在内的5个DELLA蛋白家族类似基因。除拟南芥外,其他植物中也相继鉴定出了DELLA蛋白家族基因,包括水稻中的SLENDER RICE 1(SLR1)[9]、番茄中的PROCERA[10]、葡萄中的VvGAI1[11]、玉米中的DWARF8(D8)和DEARF9(D9)[12]等,且 鉴 定 出 的DELLA蛋白家族普遍N端有一个DELLA结构域,C端有一个GRAS结构域,且都是核定位[13]。
目前,拟南芥和一些其他模式植物中DELLA蛋白功能的研究较多[14-15],如韩雨欣等[16]利用生物信息学方法从茶树全基因组数据库中进行了分析,推测茶树DELLA基因广泛参与了茶树生长发育及非生物逆境胁迫的响应;陈英杰等[17]利用同源重组的方法,发现棉花DELLA蛋白GhGAI2b基因可能参与GA信号途径进而抑制植物生长发育。然而,烟草中的相关研究还鲜见报道。因此,利用电子克隆的方法,将拟南芥DELLA蛋白的GAI基因序列在NCBI烟草EST数据库中进行同源比对,结合RT-PCR和SMARTer RACE技术,在烟草K326基因组中克隆DELLA蛋白家族基因成员,并对它们的cDNA进行克隆。同时,结合生物信息学对烟草中DELLA蛋白基因的结构和进化等进行分析,在此基础上通过荧光定量PCR和基因芯片技术对其组织特异性、时期特异性、非生物胁迫下的表达模式进行研究,旨在了解烟草DELLA蛋白的抗逆机制,为其生物学功能研究奠定基础。
1 材料与方法
1.1 实验材料
供试烟草品种为K326(Nicotiana tabacum L.)。将K326种子进行消毒、浸种和催芽,在贵州省烟草科学研究院采用温室漂浮盘播种。温室温度设为28℃,每天交替进行12 h光照/12 h黑暗处理。采用100 mg/L GA和10μmol/L脱落酸(Abscisic acid,ABA)分别喷洒三周龄苗叶面,于喷洒后第0、2、5、8、11和14 h取叶片组织。此外,分别对三周龄烟苗采用100 g/L PEG6000浇灌根部模拟干旱胁迫,低温(4℃)处理、接种烟草花叶病毒(Tobacco mosaic virus,TMV),于处理后第7 d取叶片组织,用于检测基因的非生物胁迫响应。上述材料取样后液氮速冻,置于-80℃冰箱备用。
1.2 基因组DNA、RNA提取及cDNA合成
基因组DNA提取采用CTAB法[18],总RNA提取采用TRIZOL Reagent试剂盒[天根生化科技(北京)有限公司]。cDNA的合成使用TransScript®
One-Step gDNA Remocal and cDNA Synthesis SuperMi试剂盒(北京全式金生物技术有限公司),5’端扩增使用5’RACE试剂盒(日本TAKARA公司),具体操作步骤见试剂盒说明书。
1.3 烟草DELLA基因家族的鉴定及克隆
以拟南芥DELLA蛋白家族基因AtGAI全长cDNA序列(Gene Bank编号:NM-101361)为信息探针,在NCBI烟草EST数据库中进行BLAST检索,对检索到的部分高同源性EST,利用软件Geneious进行新的基因组装配分析,获得3条较长拼接序列,根据拼接序列设计引物,以烟草cDNA为模板进行PCR扩增,结合5’RACE获得基因全长。胶回收纯化后,将PCR产物与pMD-18T Vector连接,转化大肠杆菌DH5α,阳性克隆送上海生物工程股份有限公司测序。
1.4 基因结构与序列分析
使用Interpro Scan软件(https://www.ebi.ac.uk/interpro/search/sequence/)分析编码蛋白的相对分子质量、等电点等理化性质;采用最大似然法通过MEGA 5.0构建系统进化树;使用Cluster W多序列比对工具进行氨基酸序列比对;使用SWISS-MODEL在线软件(https://swissmodel.expasy.org/)进行蛋白质三维结构预测;通过植物蛋白质亚细胞在线分析工具Plant mPLoc(http://www.csbio.sjtu.edu.cn/cgi-bin/PlantmPLoc.cgi)对DELLA蛋白进行亚细胞定位预测。
1.5 发育时期表达谱分析
根据中国烟草基因组数据库中的烟草基因芯片数据,对烟草DELLA基因家族中的DELLA1~DELLA3基因在烟草不同发育时期的芯片数据进行了搜集整理,并用Origin软件对数据进行分析制图。
1.6 半定量PCR及荧光定量PCR分析
参照郭玉双等[19]2015年建立的基因表达检测方法进行RNA的提取、cDNA第一链的合成、半定量PCR及Real time RT-PCR扩增。以延伸因子基因EF-1-α(Elongation Factor 1-alpha 1 gene)作为Real time RT-PCR的内参。设计引物序列如表1所示。相对 表 达 量 采 用2-ΔΔCt[ΔΔCt=Ct(target gene)-Ct(internal reference gene)]法计算,用SPSS 22.0软件进行统计分析。

表1 引物信息Tab.1 Primer information
2 结果与分析
2.1 烟草DELLA基因家族的克隆
将拟南芥DELLA基因家族的序列在NCBI烟草EST数据库中比对,获得了部分烟草中与之同源度较高的EST序列,使用Geneious软件将收集到的EST进行新的基因组装配分析,发现可以组装出3条长于1 400 bp的EST序列(图1)。其中第一条序列(NtDELLA1)是由FG200921.1、FG177469、FG137259.1、EB442187、EB441042.1、EB439180和DV159588共7个序列信息组装拼接而成,全长1 870 bp,且通过ORF分析发现有一个编码570个氨基酸的通读框;第二条序列(NtDELLA2)由FG166698.1、EB451523.1、EB451304.1 和FG172890.1共4个EST组装拼接而成,全长1 413 bp,且通过ORF分析发现其有一个编码404个氨基酸的开放阅读框;第三条序列(NtDELLA3)由

图1 烟草DELLA基因的拼接Fig.1 Assembly of tobacco DELLA genes
FG170978.1、FG167716.1、FG134302.1、FG165341.1、FG138336.1、FG166698.1和FG165403.1共7个序列信息拼接而成,全长1 954 bp,且通过ORF分析发现其有一个编码390个氨基酸的开放阅读框。对3个开放阅读框对应的氨基酸序列进行结构域分析,发现DELLA蛋白家族均具有保守的DELLA基序和GRAS结构域,将拼接获得的3个烟草基因分别命名为NtDELLA1、NtDELLA2和NtDELLA3。
以栽培烟草K326的cDNA为模板,根据获得的3个基因开放阅读框序列分别设计引物,进行PCR扩增,获得NtDELLA1、NtDELLA2和NtDELLA3的CDS全长,结果如图2所示。NtDELLA1基因CDS全长1 704 bp,编码567个氨基酸;NtDELLA2基因全长1 764 bp,编 码587个 氨 基 酸;NtDELLA3全 长 为1 692 bp,编码563个氨基酸。
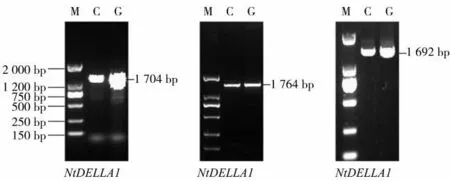
图2 以烟草cDNA和基因组DNA为模板NtDELLAs的扩增结果Fig.2 Amplification results of NtDELLAs using tobacco cDNA and genomic DNA as templates
为明确NtDELLA1、NtDELLA2和NtDELLA3在基因组中的基因结构,以栽培烟草K326基因组DNA为模板进行扩增,结果表明这3个烟草DELLA蛋白家族基因均没有内含子,这与拟南芥和水稻等模式植物中DELLA基因的结构一致。此外,NtDELLA1的基因组扩增条带经过切胶测序后,发现测序结果中存在一个长1 229 bp的片段。序列比对结果显示,该序列与NtDELLA1的CDS序列高度相似(相似度97%),但相比NtDELLA1其基因末端缺失约480 bp,此缺失导致其蛋白质序列的C端出现移码并提前终止,产生一个截短的蛋白。进一步序列分析发现该基因具有完整的开放阅读框,且其翻译的蛋白质序列含有DELLA特征结构域,因此命名为NtDELLA4(图3A)。同时,以基因组DNA和cDNA分别作为模板对NtDELLA4进行扩增,发现基因组中能扩增出NtDELLA4的条带,但是cDNA中无法扩增(图3B),这表明NtDELLA4很有可能由于结构缺失演化为一个不表达的假基因。

图3 NtDELLA4和NtDELLA1蛋白结构比较Fig.3 Protein structures of NtDELLA4 and NtDELLA1
2.2 烟草DELLA蛋白的生物信息学分析
将NtDELLA1、NtDELLA2和NtDELLA3基因编码的蛋白质氨基酸序列在EBI的蛋白结构特征在线分析软件Interpro Scan中进行分析后,发现NtDELLA1蛋白全长为567个氨基酸,分子质量为62.287 kDa,等电点为4.94;NtDELLA2蛋白全长为587个氨基酸,分子质量为64.246 kDa,等电点为4.76;NtDELLA3蛋白全长为563个氨基酸,分子质量为62.172 kDa,等电点为4.61。
通过结构域分析,发现这3个蛋白的氨基酸序列有2个明显的结构特征,包括N端的DELLA结构域和C端的GRAS特征结构域,可见这3个蛋白为典型的DELLA家族成员(图4)。多重序列比对结果(图5)显示烟草DELLA蛋白含有2个DELLA家族的特征结构域(DELLA结构域和GRAS结构域),且N端的DELLA结构域含有高度保守的VHYNP基序。3个烟草的DELLA蛋白与拟南芥的该蛋白高度同源,故它们的作用机制可能相似。

图4 3个烟草DELLA蛋白结构Fig.4 Structures of three tobacco DELLA proteins


图5 NtDELLAs蛋白和其他物种NtDELLAs蛋白的氨基酸序列比对Fig.5 Amino acid sequence alignment of tobacco NtDELLAs and those of other plants
对烟草DELLA蛋白的氨基酸序列进行进化树分析,结果发现NtDELLA1和水稻的OsGAI聚类在一起,亲缘关系较近;NtDELLA2和拟南芥RGL2聚类在一起;NtDELLA3和拟南芥RGA聚类在一起(图6)。

图6 不同物种DELLA蛋白的进化树Fig.6 Phylogenetic tree of DELLA proteins of different species
三维结构建模结果如图7所示,在3个DELLA蛋白的三维结构中有保守的N端DELLA结构域和C端的GRAS结构域,两者由中间的部分肽段相连。且蛋白两端结构非常保守,而连接DELLA和GRAS结构域的中间部分氨基酸序列变化较大。此外,烟草中的3个DELLA蛋白与拟南芥的DELLA蛋白GAI空间结构高度相似,所以可能也有相似的功能——作为赤霉素信号通路中的抑制因子发挥作用。

图7 烟草NtDELLAs蛋白三维结构预测Fig.7 Predicted tertiary structures of NtDELLAs
通过Plant-mPLoc植物蛋白质亚细胞定位在线预测工具对本研究中的烟草DELLA蛋白家族成员DELLA1~DELLA4进行亚细胞定位预测,发现DELLA1~DELLA4定位在细胞核中,这与其他作物中DELLA蛋白的亚细胞定位结果一致,说明烟草DELLA蛋白也定位于细胞核中,并在细胞核中发挥其转录抑制功能。
2.3 不同生长发育时期NtDELLAs表达特异性分析
烟草不同生长发育时期烟草DELLA基因家族的表达量如图8所示。由表达曲线可见NtDELLA1基因整体表达量较高,各个时期NtDELLA2和NtDELLA3表达量相近且趋势相同。从小十字期到团颗期NtDELLA1表达水平有一个缓慢的上升趋势,在团棵期的表达量达到最高,旺长期表达量明显下调,在盛花期表达量最低,且NtDELLA1在不同时期的表达量均高于NtDELLA2和NtDELLA3,这也表明NtDELLA1可能是烟草DELLA家族成员的主效基因;NtDELLA2在不同的生长发育时期表达波动较小,但从营养生长到生殖生长时期表达量有逐渐降低的趋势,但在成熟期略有回升;NtDELLA3基因在烟苗营养生长阶段表达量逐渐上升,旺长期达到最高,但旺长期到盛花期NtDELLA3的表达量急剧下调,在盛花期达到最低,在衰老过程中表达量又有所回升。由此可见,NtDELLA3可能参与调控烟草开花及衰老。

图8 不同生长发育时期烟草NtDELLAs表达量Fig.8 Relative expression levels of NtDELLAs at various growth and development stages
2.4 逆境条件及激素处理对烟草DELLA基因家族表达的影响
3个烟草DELLA基因对不同的外界因素刺激表现出不同的响应模式。如图9所示,烟草DELLA基因家族3个基因对低温、干旱和TMV接种响应较为强烈,而盐胁迫对DELLA基因家族的表达影响不大。在低温胁迫的条件下,NtDELLA1基因的表达显著上调,而NtDELLA2和NtDELLA3基因的表达则没有显著差异;在干旱胁迫条件下,DELLA基因家族3个基因的表达均明显下调,其中NtDELLA1和NtDELLA2的下调尤其明显。此外,TMV接种导致烟草DELLA基因家族的3个基因上调表达,说明烟草DELLA基因家族的表达能够被TMV接种显著诱导。

图9 NtDELLAs对多种逆境的响应Fig.9 Responses of NtDELLAs to various stress
施加外源GA和ABA的烟草DELLA基因家族的表达模式见图10。在施加外源GA时,烟草的3个NtDELLA基因在第0~14 h区间整体显示出了下降趋势,NtDELLA1在处理后第11 h降至最低值,之后逐渐回升;但NtDELLA2在处理后第5~8 h区间内显著下降,之后缓慢下降,在处理后第14 h达到最低水平。施加外源ABA后DELLA家族成员的表达结果显示,在ABA施加后的第11~14 h,DELLA蛋白的转录水平被抑制最为显著,NtDELLA1和NtDELLA3在处理后第0~14 h整体呈下降趋势,但NtDELLA1在处理后第5~8 h间有显著下降,之后缓慢下降,在处理后第14 h达到最低值;NtDELLA2在处理后第11 h达到最低水平,之后出现回升趋势。

图10 NtDELLAs对GA和ABA的响应Fig.10 Responses of NtDELLAs to GA and ABA
3 讨论
本研究中发现NtDELLAs对低温、干旱和TMV侵染3种胁迫的响应较明显,对盐胁迫不敏感,其中NtDELLA1对低温胁迫响应最为明显,所有NtDELLAs对干旱胁迫均表现出明显的下调模式,这与前人的研究结果一致[20-21],说明GA信号通路和ABA信号通路存在交联,干旱胁迫条件下NtDELLA基因的下调可能和ABA应答干旱胁迫相关。NtDELLA2在TMV接种后表现出明显的上调,说明烟草DELL A基因家族参与烟草对TMV的应答过程。
GA处理导致DELLA基因家族成员表达下调,说明外源GA不仅诱导内源DELLA蛋白降解,同时施加外源ABA也出现了和GA处理类似的结果,尤其是在ABA施加后的第11~14 h时DELLA基因的转录水平受抑制的程度最大,这和前人的研究结果一致[22],说明GA也可通过某种调节方式,在转录水平上抑制DELLA基因的转录,其机制有待进一步研究。DELLA基因转录水平的变化又会导致其蛋白水平的变化,DELLA蛋白精细调控植物的生长发育与抗逆性以适应环境因子变化的相关分子机制也仍待进一步研究。同时,随着基因编辑技术的发展,可通过基因编辑技术改变烟草DELLA基因的序列,从而创制出在烟草株型、生物量和抗逆性等方面具有独特表型的烟草株系,为烟草育种提供重要的种质资源。
4 结论
烟草中克隆的4个NtDELLA基因,除NtDELLA4基因结构N端出现缺失为假基因外,NtDELLA1、NtDELLA2和NtDELLA3编码的蛋白均具有典型的DELLA蛋白结构。NtDELLAs在烟草不同组织及不同生长发育时期均有表达,其中NtDELLA1表达量最高,说明NtDELLAs基因家族成员间功能存在冗余,NtDELLA1可能为烟草DELLA基因家族的主效基因。此外,烟草NtDELLAs在低温胁迫、干旱胁迫、盐胁迫和TMV接种4种逆境条件下均有转录水平的响应,响应模式各异。NtDELLAs对GA和ABA的响应模式类似,均表现出转录水平的抑制。

