瘦素基因启动的新型脂肪细胞表达Cre工具小鼠的构建
曾帆,王澜,万小勤,黄荣凤,张志辉,李旻典
研究报告
瘦素基因启动的新型脂肪细胞表达Cre工具小鼠的构建
曾帆,王澜,万小勤,黄荣凤,张志辉,李旻典
陆军军医大学第一附属医院心血管内科,代谢生物钟与心血管病中心,重庆 400038
脂肪组织是发挥能量储存与内分泌功能的重要代谢组织。脂肪细胞的发育、稳态与病理生理功能是重要的研究方向。空间转录组学研究表明脂肪细胞至少存在3种不同亚型,其标记基因包括瘦素(leptin,)、脂联素(adiponectin,)、围脂滴蛋白(perilipin-1/4,)和血清淀粉样蛋白(serum amyloid A,)等。瘦素基因与脂联素基因分别标记了不同亚型的脂肪细胞。目前通常用脂联素基因Adipoq-Cre工具小鼠研究成熟脂肪细胞的生理功能,但缺乏瘦素基因启动的Cre工具小鼠以追踪LEP+亚型脂肪细胞的发育与稳态。本研究通过CRISPR-Cas9技术编辑小鼠基因,形成Lep-P2A-Cre融合基因,其产物通过P2A肽的自剪切作用,解离为LEP与CRE蛋白,从而实现内源基因启动的Cre表达(Lep-Cre)。本研究通过tdTomato示踪工具,分析Lep-Cre在不同脂肪组织与非脂肪组织的活性,结果发现Lep-Cre在白色脂肪和米色脂肪组织中活性最强,其次是棕色脂肪,在下丘脑核团不表达,但在多个外周器官存在不同程度的活性。本研究构建了瘦素基因启动的Lep-Cre工具小鼠,为深入研究LEP+亚型脂肪细胞的发育与功能提供新工具。
瘦素;脂肪细胞;Cre-loxP;脂肪组织
脂肪组织不仅是一种能量储存组织,也是一种重要的内分泌组织,在维持能量稳态和代谢调节中发挥核心作用[1]。脂肪组织有3种不同类型,即白色、米色和棕色脂肪组织,其功能与作用不同[2]。白色脂肪组织主要功能是通过储存和释放脂质调节能量稳态以及分泌脂肪因子(如脂联素、抵抗素等)调节代谢[3]。米色和棕色是属于产热脂肪组织,其中米色脂肪组织是机体响应冷刺激后经表型转换获得适应性产热能力[4]。健康的脂肪组织能灵活地响应合成代谢和分解代谢信号以保持机体能量平衡,脂肪功能异常是糖尿病前期与肥胖的重要病理生理基础[5]。
近年来,单细胞测序和空间转录组学研究提示,脂肪组织可能存在至少3种不同亚型的成熟脂肪细胞[6]。针对小鼠脂肪组织的空间转录组研究发现,这3种不同亚型的脂肪细胞在能量代谢、炎症因子、特异性基因等方面存在差异,其标记基因包括瘦素(leptin,)、脂联素(adiponectin,)、围脂滴蛋白(perilipin-1/4,)和血清淀粉样蛋白(serum amyloid A,)[7]。LEP+脂肪细胞富集表达脂肪酸转运蛋白、细胞间相互作用、瘦素分泌和铁代谢等通路的基因;PLIN+细胞富集表达脂联素和糖脂代谢基因;SAA+细胞富集表达视黄醇代谢相关基因[7]。采用单细胞核的测序研究也将脂肪细胞分为3种亚型,其中LEP标记的脂肪细胞与应激相关,在高脂诱导肥胖中更容易增加细胞体积[8]。针对成人的脂肪细胞单细胞测序结合荧光成像实验表明LEP与ADIPOQ可以独立标记不同的脂肪细胞,而且的表达与细胞脂肪含量没有统计学相关性[9]。因此来自小鼠与人类的脂肪细胞单细胞研究中均发现LEP与ADIPOQ标记不同的脂肪细胞。
在目前的研究中,作为脂肪细胞的特异性基因,其启动子驱动的Adipoq-Cre转基因小鼠是研究脂肪细胞功能的最重要的工具鼠。为了将来进一步研究不同亚型的脂肪细胞功能提供Cre工具鼠,本研究选取与分属不同亚型的基因用CRISPR-Cas9内切酶系统构建原位插入Cre序列的Lep-Cre工具小鼠。编码的基因(NCBI参考序列:NM_008493.3)位于小鼠6号染色体上,含有3个外显子,ATG起始密码子在外显子2,TGA终止密码子在外显子3。为了明确Lep-Cre的组织表达分布,本研究利用loxP-Stop-loxP (LSL)-tdTomato示踪工具,追踪Lep-Cre在不同脂肪组织与非脂肪组织或器官中的表达情况。
1 材料与方法
1.1 实验动物
B6J-Lepem1(Cre)Mdli(Lep-Cre)基因改造小鼠采用CRISPR/Cas9基因编辑技术构建。首先根据CRISPOR数据库(http://crispor.tefor.net/)设计针对基因的gRNA序列(5′-CTGAAGTTTCAAA-GGCCACC-3′),继而用基因编辑技术将小鼠基因序列重组形成“Lep-Peptide 2A (P2A)-Cre”序列。Lep-P2A-Cre序列删除了位于基因外显子3的编码序列(CDS)末尾的TGA终止密码子,并连接具有自水解断裂特性的P2A序列与Cre序列(图1)。“Lep-P2A-Cre”序列由于的终止子被删除,接上P2A的碱基序列,其翻译产物在P2A作用下断裂,形成合成C端带上P2A的LEP蛋白和N端带脯氨酸的CRE。Lep-Cre小鼠委托赛业生物(Cyagen)构建。RosaLSL-tdTomato/+(LSL-tdTomtato)是在ROSA26位点插入一个loxP- Stop-loxP-tdTomato 元件框,loxP-Stop-loxP可以阻断tdTomato的转录及表达,在表达CRE重组酶的细胞中loxP-Stop-loxP元件将被剪切,剪切后tdTomato将重新表达,tdTomato在波长为510~560 nm的激发光下显示红色荧光[10]。
通过内切酶介导的突变技术在小鼠瘦素基因的编码区序列后插入肽2A(P2A)与Cre重组酶()基因序列。gRNA: 向导RNA;3′-UTR:3′端非翻译区。
1.2 B6J-Lepem1(Cre)Mdli/+; RosaLSL-tdTomato/+小鼠构建
Lep-Creem/+与LSL-tdTomtatoTg/+杂交,选取后代Lep-Creem/+与LSL-tdTomtatoTg/+(Lep-Cre reporter)作为研究对象。对照组为6周龄雌性C57BL/6J小鼠购自重庆恩斯维尔生物科技有限公司。6周龄雌性实验小鼠在12 h光照/12 h黑暗、24~26℃、40%~70%湿度条件下饲养。本研究动物实验方案获得陆军军医大学伦理审查委员会批准,动物饲养于陆军军医大学高原军事医学系SPF级动物房。
1.3 DNA提取及基因分型鉴定
待鉴定的每只小鼠取尾部2 mm置于EP管中,每管添加蛋白酶K消化液(MK539480,美国Merck公司) 100 μL,将组织在56℃孵育过夜,过夜后在98℃孵育13 min,使蛋白酶变性,采用5000 ×离心15 min,取上清液用于PCR (引物序列见表1)。基因分型采用2×Master Mix (P222,南京Vazyme公司)在退火温度为60℃下扩增35个循环,扩增产物用于DNA凝胶鉴定。
1.4 组织切片及荧光观察
Lep-reporter小鼠用1%的戊巴比妥钠腹腔麻醉后取下丘脑室旁核(the paraventricular nucleus of the hypothalamus)、肝脏、腓肠肌、肾脏、心脏、腹股沟皮下脂肪(简称皮下脂肪)、性腺脂肪、肠系膜脂肪、肩胛间棕色脂肪、肾周脂肪。取下的组织浸泡在4℃的4%多聚甲醛中过夜,过夜后组织在新鲜PBS洗涤3次后,换新鲜PBS在4℃中过夜,取出组织浸泡在PBS-15%蔗糖溶液中4℃过夜。组织预处理后,用滤纸吸干组织表面水分,OCT胶(4583,日本SAKURA公司)包埋组织,白色脂肪在–45℃条件下进行切片,切片厚度30 μm,其余组织在–20℃进行切片,棕色脂肪切片厚度12 μm,其他组织切片厚度6 μm。组织切片在4%多聚甲醛中浸泡5 min,PBS洗涤3次,甩干,然后进行DAPI (C1005,上海碧云天生物技术有限公司)染色,脂肪组织和室旁核染色10 min,其他组织染色5 min,PBS洗涤3次,抗荧光淬灭封片剂(AR1109,武汉博士德公司),荧光显微镜(NI-U,日本Nikon公司)采用510~560 nm的激发光,曝光150 ms进行图片采集。

表1 基因分型引物
F:上游引物(forward primer);R:下游引物(reverse primer);WT:野生型;Tg:基因改造型。
2 结果与分析
2.1 Lep-reporter小鼠构建结果
为了明确Cre重组酶在小鼠基因启动子调节下表达,采用了3只Lep-Creem/+小鼠与5只LSL- tdTomatoTg/+小鼠进行杂交繁殖(图2A)。利用PCR与DNA电泳对50只子代小鼠的尾部组织提取的基因组DNA开展基因型分析,获得4只携带Cre与tdTomato的杂合子小鼠(Lep-Creem/+; LSL-tdTomatoTg/+),即Lep-reporter小鼠。以其中的3只Lep-reporter小鼠为例,图2B和C分别表明42#、45#和49#这3只小鼠携带413 bp的Cre特征片段和200 bp的tdTomato特征片段。这3只小鼠同时也表达300 bp的野生型DNA特征片段(图2C),表明这些小鼠是携带tdTomtato的杂合子小鼠。

图2 Lep-reporter杂交小鼠基因分型鉴定
A:Lep-reporter繁殖示意图。B:PCR分析检测Lep-Cre特征DNA片段。DNA凝胶只有413 bp 条带的为Lep-Cre,无条带的为WT。C:PCR分析检测LSL-tdTomato特征DNA片段。DNA凝胶只有200 bp 条带的为LSL-tdTomato 纯合子,同时有200 bp和300 bp 条带的为LSL-tdTomato 杂合子,只有300 bp条带的为WT。Lep-reporter小鼠为同时具有Lep-Cre和LSL-tdTomato,编号为42#、45#和49#的小鼠符合实验要求,即为Lep-reporter小鼠。M:DNA Marker;WT:野生型;em:核酸内切酶介导的突变。
2.2 Lep在小鼠脂肪组织中的表达情况
对4只Lep-reporter小鼠与1只WT小鼠进行免疫荧光显微成像分析,以明确Lep-Cre在不同类型和解剖部位的脂肪组织的表达活性。分别解剖与固定2个解剖部位的白色脂肪组织(性腺脂肪、肠系膜脂肪)、米色脂肪组织(皮下脂肪)和2个解剖部位的棕色脂肪组织(肾周脂肪和肩胛间棕色脂肪)。结果显示,Lep-Cre的信号在性腺脂肪、皮下脂肪和肠系膜脂肪大量存在,但在肾周脂肪和肩胛间棕色脂肪以中等偏高且明显高于WT组信号强度存在(图3)。这表明Lep-Cre在白色脂肪与米色脂肪大量表达,在棕色脂肪以中等偏高的程度表达,但这些脂肪组织的Lep-Cre均发挥切割loxP序列的功能。
2.3 Lep在其他组织器官中的表达情况
为探明Lep-Cre是否在非脂肪细胞表达,在采集脂肪组织数据的同时,针对5种不属于脂肪组织的器官(下丘脑室旁核、心脏、腓肠肌、肝脏、肾脏)开展荧光显微成像。结果表明,Lep-Cre产生的tdTomato荧光信号在肝脏大量存在,几乎在视野中所有的肝细胞中检测出;但未在下丘脑室旁核组织检测出(图4)。荧光信号在其他外周组织如肾脏、肌肉与心脏的强度较低,并且不是所有细胞都检测到信号。因此,Lep-Cre在多种外周组织的非脂肪细胞表达,尤其是在肝细胞大量表达,但未在下丘脑室旁核组织表达。
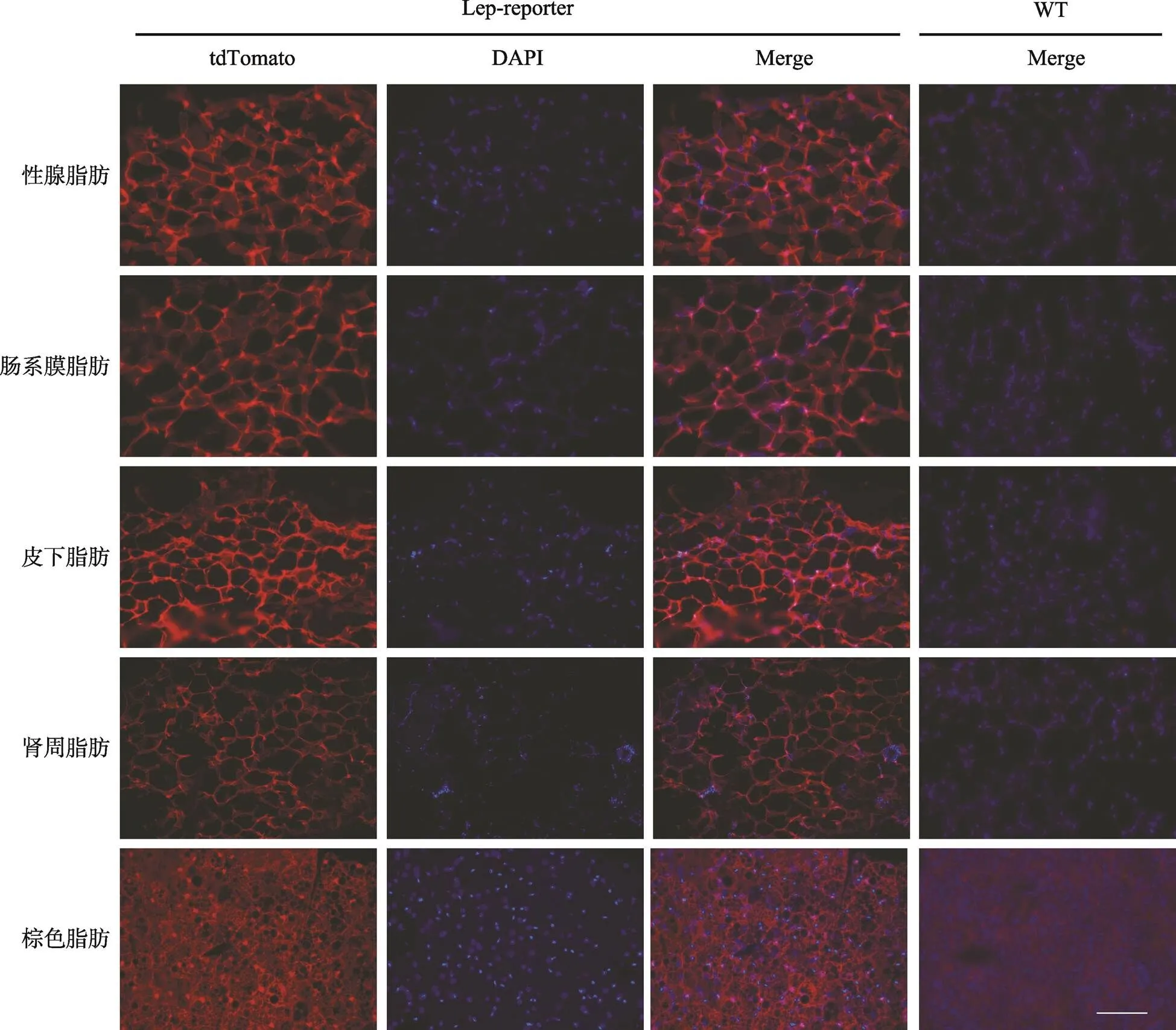
图3 Lep-Cre在小鼠脂肪组织中的表达活性
WT:野生型对照;tdTomato 标记显示为红色;DAPI 染细胞核,显示为蓝色;标尺:200 μm。
3 讨论
本研究通过CRISPR-Cas9编辑小鼠瘦素基因,在不破坏原基因编码区序列的情况下,引入Cre重组酶,从而实现内源瘦素基因顺式调节元件驱动的Cre表达。借助LSL-tdTomato工具鼠与免疫荧光成像分析,本研究发现这种Lep-Cre工具鼠在至少两处白色脂肪组织和一处米色脂肪组织中Cre活性最强,其次是在两处棕色脂肪组织,这符合旨在实现追踪LEP+脂肪细胞的研究目的。Lep-Cre在不同脂肪组织的活性与基因表达的特点一致,例如在棕色脂肪组织中的表达受环境温度影响,热中性的环境温度诱导棕色脂肪组织高表达,室温抑制在棕色脂肪表达[11]。然而,Lep-Cre在肝脏、肾脏和心脏有非特异性表达,尤其是肝脏;室旁核中无活性,这些泄漏表达可能限制Lep-Cre在生理学或代谢生物学的应用。
目前作为脂肪细胞特异性Cre的工具鼠有aP2-Cre和Adipoq-Cre。脂肪细胞型脂肪酸结合蛋白(adipocyte fatty acid binding protein,AFABP,FABP4或aP2)是脂肪细胞表达量最高的几个蛋白之一[12],因此成为第一代脂肪细胞特异性表达Cre (aP2-Cre)工具鼠的靶向基因[13]。但近年来研究发现,aP2-Cre不仅在成熟脂肪细胞中表达,也内皮细胞和脂肪组织基质血管细胞驱动loxP位点的同源重组[14]。此外,aP2-Cre 可导致约2%的精子中 loxP位点发生重组[15]。脂联素基因调控元件构建的Cre工具鼠(Adipoq-Cre)较aP2-Cre对成熟脂肪细胞具有更高的选择性,在目前已报道的其他组织中未显示出重组活性[16]。Adipoq-Cre作为脂肪组织特异性Cre工具小鼠具有明显的优点,但目前广泛使用的Adipoq-Cre工具鼠的Cre序列插入在基因的外显子6和7之间,存在影响胚胎发育的风险[17]。是胚胎发育的关键基因,在该位点插入Cre潜在影响了的功能;这可能是Adipoq-Cre纯合子出生较少的原因。
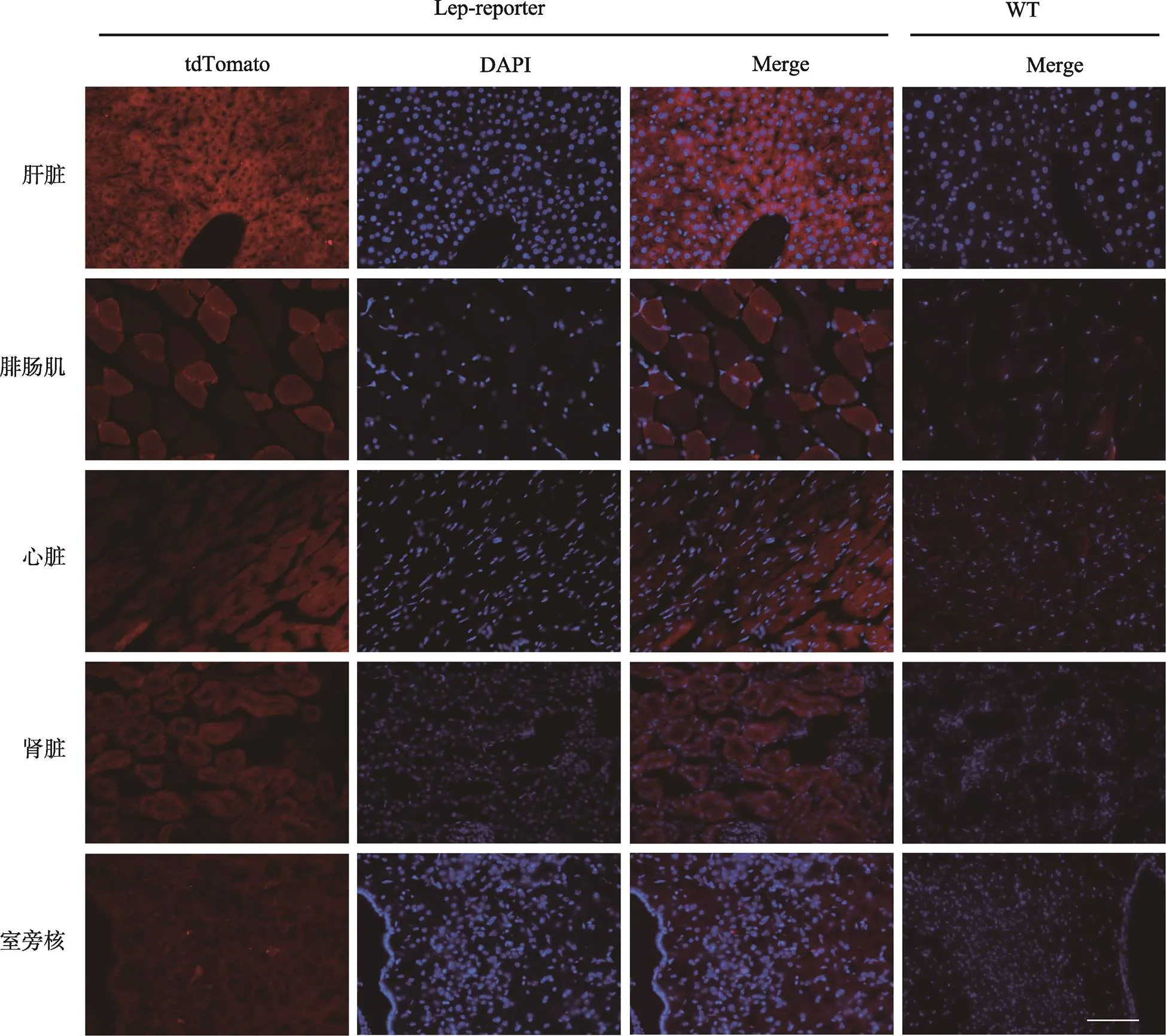
图4 Lep-Cre在部分非脂肪组织的表达活性
WT:野生型对照;tdTomato 标记显示为红色;DAPI 染细胞核,显示为蓝色;标尺:200 μm。
作为一种新型的脂肪细胞标记基因,在白色和米色脂肪组织中大量表达[18]。本研究表明,Lep-Cre活性主要在白色和米色脂肪组织中,与报道的脂肪组织中活性一致,可以用于追踪脂肪组织中LEP+脂肪细胞。尽管很多文献报道了LEP与ADIPOQ标记不同的脂肪细胞[7~9],最近的一篇针对小鼠与成人的脂肪组织的大型单细胞研究没有报道该现象[19]。在本研究中也没有观察到完全不表达的脂肪细胞,这可能是由于组织切片方法限制了分析所有脂肪细胞的LEP蛋白水平,而且不同发育阶段和解剖部位的脂肪组织可能存在LEP+与LEP-亚型脂肪细胞的比例差异。该问题可以通过采用更全面的小鼠模型结合流式细胞分析或单细胞测序解决。基于以上结果,本研究成功构建了一种新型的脂肪细胞表达的Lep-Cre工具小鼠,为进一步研究LEP+脂肪细胞在不同脂肪组织的发育、稳态与代谢功能提供了工具。
[1] Cypess AM. Reassessing human adipose tissue., 2022, 386(8): 768–779.
[2] Zhang F, Hao GY, Shao ML, Nham K, An Y, Wang Q, Zhu Y, Kusminski CM, Hassan G, Gupta RK, Zhai QW, Sun XK, Scherer PE, Oz OK. An adipose tissue atlas: an image-guided identification of human-like BAT and beige depots in rodents., 2018, 27(1): 252–262.e3.
[3] Zhang ZH, Xin HR, Li MD. Circadian rhythm of lipid metabolism in health and disease., 2020, 4(7): 1900601.
[4] Cohen P, Kajimura S. The cellular and functional complexity of thermogenic fat., 2021, 22(6): 393–409.
[5] Sakers A, De Siqueira MK, Seale P, Villanueva CJ. Adipose- tissue plasticity in health and disease., 2022, 185(3): 419–446.
[6] Lee KY, Luong Q, Sharma R, Dreyfuss JM, Ussar S, Kahn CR. Developmental and functional heterogeneity of white adipocytes within a single fat depot., 2019, 38(3): e99291.
[7] Bäckdahl J, Franzén L, Massier L, Li Q, Jalkanen J, Gao H, Andersson A, Bhalla N, Thorell A, Rydén M, Ståhl PL, Mejhert N. Spatial mapping reveals human adipocyte subpopulations with distinct sensitivities to insulin., 2021, 33(9): 1869–1882.e6.
[8] Sárvári AK, Van Hauwaert EL, Markussen LK, Gammelmark E, Marcher AB, Ebbesen MF, Nielsen R, Brewer JR, Madsen JGS, Mandrup S. Plasticity of epididymal adipose tissue in response to diet-Induced obesity at single-nucleus resolution., 2021, 33(2): 437–453.e5.
[9] Min SY, Desai A, Yang Z, Sharma A, DeSouza T, Genga RMJ, Kucukural A, Lifshitz LM, Nielsen S, Scheele C, Maehr R, Garber M, Corvera S. Diverse repertoire of human adipocyte subtypes develops from transcriptionally distinct mesenchymal progenitor cells., 2019, 116(36): 17970–17979.
[10] Madisen L, Zwingman TA, Sunkin SM, Oh SW, Zariwala HA, Gu H, Ng LL, Palmiter RD, Hawrylycz MJ, Jones AR, Lein ES, Zeng HK. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain., 2010, 13(1): 133–140.
[11] Cancello R, Zingaretti MC, Sarzani R, Ricquier D, Cinti S. Leptin and UCP1 genes are reciprocally regulated in brown adipose tissue., 1998, 139(11): 4747–4750.
[12] Charles KN, Li MD, Engin F, Arruda AP, Inouye K, Hotamisligil GS. Uncoupling of metabolic health from longevity through genetic alteration of adipose tissue lipid-binding proteins., 2017, 21(2): 393–402.
[13] Barlow C, Schroeder M, Lekstrom-Himes J, Kylefjord H, Deng CX, Wynshaw-Boris A, Spiegelman BM, Xanthopoulos KG. Targeted expression of Cre recombinase to adipose tissue of transgenic mice directs adipose-specific excision of loxP-flanked gene segments., 1997, 25(12): 2543–2545.
[14] Shan TZ, Liu WY, Kuang SH. Fatty acid binding protein 4 expression marks a population of adipocyte progenitors in white and brown adipose tissues., 2013, 27(1): 277–287.
[15] Lee KY, Russell SJ, Ussar S, Boucher J, Vernochet C, Mori MA, Smyth G, Rourk M, Cederquist C, Rosen ED, Kahn BB, Kahn CR. Lessons on conditional gene targeting in mouse adipose tissue., 2013, 62(3): 864–874.
[16] Straub LG, Scherer PE. Metabolic messengers: adiponectin., 2019, 1(3): 334–339.
[17] Wong AM, Patel TP, Altman EK, Tugarinov N, Trivellin G, Yanovski JA. Characterization of the adiponectin promoter + Cre recombinase insertion in the Tg(Adipoq-cre)1Evdr mouse by targeted locus amplification and droplet digital PCR., 2021, 10(1): 21–27.
[18] Pereira S, Cline DL, Glavas MM, Covey SD, Kieffer TJ. Tissue-specific effects of leptin on glucose and lipid metabolism., 2021, 42(1): 1–28.
[19] Emont MP, Jacobs C, Essene AL, Pant D, Tenen D, Colleluori G, Di Vincenzo A, Jørgensen AM, Dashti H, Stefek A, McGonagle E, Strobel S, Laber S, Agrawal S, Westcott GP, Kar A, Veregge ML, Gulko A, Srinivasan H, Kramer Z, De Filippis E, Merkel E, Ducie J, Boyd CG, Gourash W, Courcoulas A, Lin SJ, Lee BT, Morris D, Tobias A, Khera AV, Claussnitzer M, Pers TH, Giordano A, Ashenberg O, Regev A, Tsai LT, Rosen ED. A single-cell atlas of human and mouse white adipose tissue., 2022, 603(7903): 926–933.
Targeting leptin-positive adipocytes by expressing the Cre recombinase transgene under the endogenous leptin gene
Fan Zeng, Lan Wang, Xiaoqin Wan, Rongfeng Huang, Zhihui Zhang, Min-Dian Li
Adipose tissue plays an important role in metabolic physiology through energy storage and endocrine functions. Spatial transcriptomics is revealing the complexity of cell types and their interaction in the adipose tissue with regards to development, homeostasis and disease. Emerging evidence suggests the existence of different subtypes of mature adipocytes that may have distinct functions, the markers of which include leptin (), adiponectin (), perilipin-1/4 (), and serum amyloid A (), marking different adipocyte subtypes. Currently, Adipoq-Cre is widely used to study adipocyte biology, however, there is no Cre line that specifically targets LEP+adipocytes. Here, we report the construction and validation of a Lep-Cre mouse line, which has the endogenousgene edited by the CRISPR-Cas9 technology to generate the Lep-peptide 2A (P2A)-Cre fusion gene. P2A induces an auto-hydrolysis of the fusion protein, leading to expression of the Cre recombinase by thegene activity. The activity of Lep-Cre in different depots of adipose tissues and non-adipose tissues was visualized by the immunofluorescence microscopy in the Lep-Cre Rosa26-loxP-Stop-loxP-tdTomato mice. We showed that Lep-Cre marked white/beige adipose depots extensively, followed by brown adipose depots. Leaky activity was observed in varying degrees among peripheral organs but not in the paraventricular nucleus of the hypothalamus. In summary, we have constructed a new adipocyte-targeting Cre mouse line that would be useful to study the development and physiology of LEP+adipocytes.
leptin; adipocyte; Cre-loxP; adipose tissue
2022-07-15;
2022-09-02;
2022-09-13
国家自然科学基金青年科学基金项目(编号:81900776)资助 [Supported by the National Natural Science Foundation of China (No. 81900776)]
曾帆,硕士,研究实习员,研究方向:代谢生物钟与心血管疾病。E-mail: zengf719@163.com
李旻典,博士,研究员,研究方向:代谢生物钟与心血管疾病。E-mail: mindianli@tmmu.edu.cn
10.16288/j.yczz.22-236
(责任编委: 孟卓贤)

