六甲蜜胺联合培美曲塞治疗中晚期乳腺癌的疗效
赵 钦 王立欣
乳腺癌因具有较高的发病率和致死率,现已成为影响女性生命和身体健康的头号杀手,其发病机制复杂,影响因素众多,如激素水平异常、家族遗传等。乳腺癌在早期发病比较隐匿,故被确诊时大部分已发展至中晚期,错失了手术的最佳时期。化疗是治疗中晚期乳腺癌的主要手段之一。目前,常用于乳腺癌治疗的化疗药物有紫杉醇、卡帕等,其虽在初期取得较好疗效,但长期使用易产生耐药性,且不良反应明显,患者依从性较差[1-2]。培美曲塞属于多靶点抗叶酸制剂,而六甲蜜胺属于嘧啶类抗代谢类药物,患者可以将其带至家中口服化疗。现大量研究证实两者可以在多种癌症的治疗中发挥作用,但关于两者联用研究较少。故为了明确六甲蜜胺联合培美曲塞在乳腺癌化疗中的作用,本研究就六甲蜜胺联合培美曲塞治疗中晚期乳腺癌疗效及对血管内皮因子、血清miR-155、miR-497及HCY水平的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年12月抚顺市中医院收治的56例中晚期乳腺癌患者作为研究对象,随机分为对照组与观察组,各28例。对照组年龄37~63岁,平均(46.78±6.54)岁;TNM分期:Ⅱa期10例,Ⅱb期8例,Ⅲa期8例,Ⅲb期2例。观察组年龄38~62岁,平均(46.14±5.98)岁;TNM分期:Ⅱa期9例,Ⅱb期6例,Ⅲa期10例,Ⅲb期3例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
1.2 纳入与排除标准
纳入标准:1)符合中晚期乳腺癌诊断标准[3];2)TNM分期属于Ⅱ~Ⅲ期;3)卡氏评分60分以上;4)自愿参与试验并签署了知情同意书。排除标准:1)其他恶性肿瘤;2)病情严重生存期短于3个月;3)配合度较差;4)对本试验使用药物不耐受。
1.3 治疗方案
两组患者均在治疗前一周口服叶酸400 μg/次,1次/d,化疗期间继续服用;并肌内注射1 mg维生素B12,每4周注射1次。对照组静脉滴注500 mg/m2培美曲塞(上海凯茂生物医药有限公司,国药准字H20080210)10 min,第1天。观察组在对照组基础上口服六甲蜜胺片(葵花药业集团有限公司,国药准字H23020451),150 mg/d。两组均连续化疗8周。
1.4 观察指标
1)疗效判定标准:完全缓解,目标病灶消失并持续一个月;部分缓解,目标病灶直径缩短>50%;稳定,目标病灶缩小未达部分缓解标准或增加18%以下;进展,出现新病灶,目标病灶直径无变化或增加[4]。治疗有效率(%)=(完全缓解例数+部分缓解例数)/总例数×100%。2)治疗前后,分别收集患者空腹静脉血5 ml,使用免疫荧光法检测患者肿瘤标志物糖类抗原125(CA125)、癌胚抗原(CEA)、糖类抗原153(CA153)、糖类抗原199(CA199)水平;使用酶联免疫吸附试验法测定患者血清血管内皮因子-121(VEGF-121)、血管内皮因子-145(VEGF-145)、血管内皮因子-165(VEGF-165)水平,操作严格按照试剂盒说明书进行。3)取患者治疗后空腹静脉血5 ml,静置15 min,3 500 r/min离心10 min,取上清液检测。通过循环酶法检测HCY;通过Trizol试剂盒提取总RNA,通过一步法将RNA反转录为cDNA(16 ℃ 0.5 h,42 ℃ 0.5 h,85 ℃ 5 min),并通过实时荧光定量检测试剂盒对cDNA中的miR-155和miR-497进行扩增反应,反应条件:95 ℃预变性10 min,95 ℃ 15 s,60 ℃退火45 s,反复40个循环,运用比较阈值循环值方法(2-ΔΔCt)计算miR-155和miR-497的相对表达量。4)详细记录患者出现的不良反应,严重者及时停药,留院观察。
1.5 统计学分析
采用SPSS 25.0统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
观察组治疗有效率明显优于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者临床疗效比较
2.2 肿瘤标志物
治疗前,两组肿瘤标志物CA125、CEA、CA153、CA199水平比较差异无统计学意义(P>0.05);治疗后,观察组肿瘤标志物CA125、CEA、CA153、CA199水平低于对照组(P<0.05)。见表2。
表2 两组患者肿瘤标志物水平比较(±s)

表2 两组患者肿瘤标志物水平比较(±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 CA125(U/ml)CEA(ng/ml)CA153(U/ml)CA199(U/ml)对照组 28 治疗前 75.36±7.62 17.25±2.08 42.59±6.14 80.38±9.85 治疗后 60.24±4.76a 10.51±1.94a 33.48±4.01a 68.44±7.96a 观察组 28 治疗前 75.88±6.65 17.58±1.99 41.83±5.97 81.02±9.59 治疗后 45.28±4.37ab 7.36±1.45ab 21.85±3.47ab 50.41±6.95ab
2.3 血管内皮因子
治疗前,两组血管内皮因子VEGF-121、VEGF-145、VEGF-165水平比较差异无统计学意义(P>0.05);治疗后,观察组血管内皮因子VEGF-121、VEGF-145、VEGF-165水平低于对照组(P<0.05)。见表3。
表3 两组患者血管内皮因子水平比较(ng/L,±s)
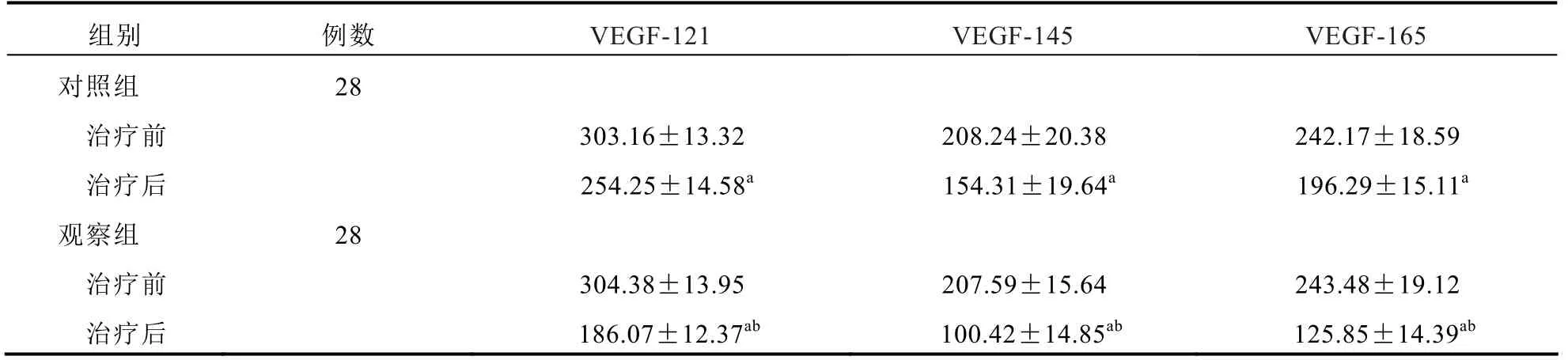
表3 两组患者血管内皮因子水平比较(ng/L,±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 VEGF-121 VEGF-145 VEGF-165 对照组 28 治疗前 303.16±13.32 208.24±20.38 242.17±18.59 治疗后 254.25±14.58a 154.31±19.64a 196.29±15.11a 观察组 28 治疗前 304.38±13.95 207.59±15.64 243.48±19.12 治疗后 186.07±12.37ab 100.42±14.85ab 125.85±14.39ab
2.4 miR-155、miR-497、HCY表达水平
治疗后,与对照组比较,观察组miR-155、HCY表达水平明显降低(P<0.05),miR-497表达水平明显升高(P<0.05)。见表4。
表4 两组患者miR-155、miR-497、HCY表达水平 比较(±s)
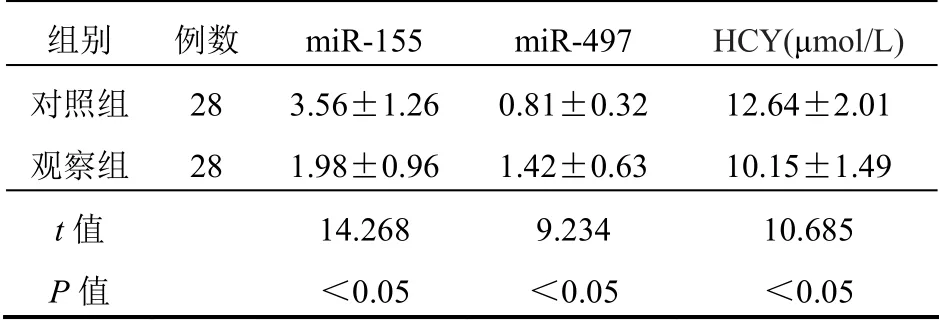
表4 两组患者miR-155、miR-497、HCY表达水平 比较(±s)
组别 例数miR-155 miR-497 HCY(μmol/L)对照组28 3.56±1.260.81±0.32 12.64±2.01 观察组28 1.98±0.961.42±0.63 10.15±1.49 t值 14.268 9.234 10.685 P值 <0.05 <0.05 <0.05
2.5 不良反应发生率
治疗后,观察组骨髓抑制、肝肾功能损害、血小板下降、白细胞降低、厌食恶心、腹泻、神经毒 性发生率均明显低于对照组(P<0.05)。见表5。
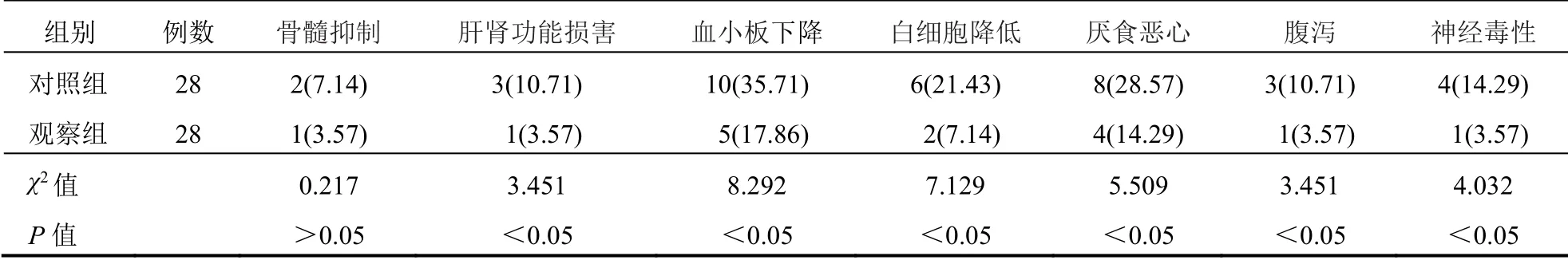
表5 两组患者不良反应发生率比较[例(%)]
3 讨论
乳腺癌是女性常见恶性肿瘤之一,其发生率在我国高达23%。乳腺癌发病机制复杂,现在临床上普遍认为乳腺癌的发生与高水平雌激素刺激、长期酗酒、致癌性RNA病毒感染、家族遗传等关系密切。有研究表明其与表观遗传学改变有关,在乳腺癌中,总体高甲基化的概率高,而局部高甲基化的概率较低[5],还存在DNA甲基化修饰组蛋白尾部、染色质结构改变以沉默基因表达和核小体重构等表观遗传机制[6]。目前,西医临床上常用手术、放疗、化疗等手段治疗乳腺癌[7],虽然能有效抑制肿瘤细胞,延长患者生存期,但长期应用易造成骨髓抑制、消化道反应及肝肾功能异常等,依从性较差,且仍不能阻止肿瘤细胞的转移,此外内分泌治疗无明显针对性,晚期患者手术难度依然较大,预后较差,所以常用的方案还是以化疗为主,且其治疗是一个长期的过程,常规单纯化疗效果并不十分理想,目前已有大量试验证实在肿瘤治疗中联合化疗方案具有较好疗效,同时也可以降低患者耐药性,减轻毒副作用,因此主张采用联合化疗方案。故本研究采用六甲蜜胺联合培美曲塞,以期提高疗效。
本研究对照组给予培美曲塞化疗方案,培美曲塞是一种新型的多靶点抗叶酸制剂,抗肿瘤作用机制与抑制二氢叶酸还原酶、胸苷酸合酶等酶活性有关,其可以通过阻断嘧啶核苷酸和嘌呤核苷酸的合成,妨碍细胞内正常代谢,使细胞分裂停止在S期,进而抑制肿瘤细胞增殖,促使肿瘤细胞凋亡,此外其还可以降低肿瘤的耐药性[8-9]。六甲蜜胺是一种周期特异性抗代谢药物,具有广谱抗癌活性,近年来已在卵巢癌、子宫内膜癌等恶性肿瘤治疗中被证实有确切疗效。其可以通过干扰二氢叶酸还原酶、抑制叶酸代谢,并选择性抑制DNA、RNA与蛋白质合成来发挥抗肿瘤作用。六甲蜜胺在使用时与烷化剂无交叉耐药性,不良反应较少,此外,患者还可以将药物带回家口服,可减轻其在医院就医的心理负担,且价格较易接受。六甲蜜胺经口服后血浆达峰时间(Tmax)1~3 h,起效迅速,可快速缓解不适症状。六甲蜜胺在患者体内需经过肝脏微粒体P-450单氧化酶活化后成为N-去甲基代谢物,发挥细胞毒效应,同时其代谢物经尿液排出体外,可以有效控制局部肿瘤复发,提高生存率[5]。本研究结果显示,观察组治疗有效率明显优于对照组,且肝肾功能损害、血小板下降、白细胞降低、厌食恶心、腹泻、神经毒性发生率均明显降低,表明与单纯使用培美曲塞比较,六甲蜜胺联合培美曲塞能够提高中晚期乳腺癌的近期疗效,且具有良好的安全性。
研究证实肿瘤标志物在肿瘤患者体内高表达,其水平一定程度上可以预测肿瘤的恶性程度并有效监测肿瘤的发展[10]。CA125与CEA均属于肿瘤标志物指标,其在乳腺癌中的阳性表达分别占25%、50%。CA153是从乳腺组织碎片中提取出来的糖蛋白的一种变异体,属于糖类抗原物质,其在乳腺癌患者机体内水平明显上升。CA199对乳腺癌转移、复发有一定的诊断价值。故对这几项标志物进行检测可以在分析乳腺癌的进展及恶性程度中产生积极参考作用[11]。新生血管对肿瘤细胞的生长和转移起到了至关重要的作用,VEGF是血管生成过程中重要的促进因子,可由肿瘤细胞分泌,诱导肿瘤血管生成,增加血管通透性,还可以加速肿瘤细胞的分裂及分化,促进其转移等。按照剪切方式可分为VEGF-121、VEGF-145、VEGF-165等分泌型可溶性蛋白。乳腺癌肿瘤组织中VEGF高表达,与乳腺癌转移、复发等关系密切[12]。本研究结果显示,治疗后观察组CA125、CEA、CA153、CA199水平均明显低于对照组,且观察组血管内皮因子水平下降程度也比对照组更显著,说明六甲蜜胺联合培美曲塞化疗治疗中晚期乳腺癌,可以下调患者体内肿瘤标志物水平,缓解肿瘤的恶性程度,并有效降低肿瘤细胞新生血管的形成,抑制肿瘤细胞生长。
mRNA在近年来的肿瘤研究中备受关注,其可以广泛参与人体细胞增殖、分化、代谢及凋亡过程,同时其也是一类抑癌基因,可调控肿瘤的发生发展[13]。众多研究显示,miRNAs与乳腺癌之间存在密切关联。miR-155是具有促癌活性的miRNA,其表达水平在乳腺癌患者血清中升高,且可促进体内外乳腺癌细胞生长、增殖,是一个可行的诊断乳腺癌、监测疗效和预后评估的生物标志物[14]。miR-497是miR-15家族成员之一,属于内含子编码的高度保守的miRNA,在多种肿瘤中呈低表达,其在肿瘤的进展过程中具有抑癌基因的作用[15]。HCY是含有硫基的肿瘤标记物之一,属于蛋氨酸代谢过程中产生的非必需氨基酸。HCY主要通过转硫化途径、甲基化途径在体内代谢掉。有研究显示,HCY可以促进过氧化氢生成,导致代谢紊乱,进而可能促进癌症的发生[16]。本研究结果显示,治疗后,与对照组比较,观察组miR-155、HCY表达水平明显降低,miR-497表达水平明显升高,表明六甲蜜胺联合培美曲塞能有效调节乳腺癌患者体内miR-155、miR-497等抑癌基因的表达,这可能与两者联合协同增效有关。
综上所述,六甲蜜胺联合培美曲塞治疗中晚期乳腺癌患者可以提高近期疗效,同时降低体内肿瘤标志物及血管内皮因子水平,此外还可以调节miR-155、miR-497、HCY表达水平,且具有良好的安全性。

